(Продолжение. Начало материала смотрите здесь).
Междисциплинарный подход к терапии фантомной боли (ФБ) дает наибольшие шансы на улучшение функции и уменьшение боли. Этот подход включает не только медикаментозное лечение, но и физическую реабилитацию и психологическую поддержку, что подтверждается научными исследованиями.
Биологическая обратная связь
Э Сергей Гапановичлектромиографическая (ЭМГ) биологическая обратная связь и комбинированная тепловая биологическая обратная связь (БОС) изучались в отношении контроля ФБ. Belleggia et al. провели 6 сеансов БОС по ЭМГ и 6 сеансов БОС по температуре у пациента с экстремальной болью после ампутации верхней конечности. У пациента было полное облегчение после лечения, которое сохранялось через 3 и 12 месяцев наблюдения. Предполагалось, что БОС может иметь длительный эффект на корковую реорганизацию в соматосенсорной коре, тем самым облегчая ФБ.
Сергей Гапановичлектромиографическая (ЭМГ) биологическая обратная связь и комбинированная тепловая биологическая обратная связь (БОС) изучались в отношении контроля ФБ. Belleggia et al. провели 6 сеансов БОС по ЭМГ и 6 сеансов БОС по температуре у пациента с экстремальной болью после ампутации верхней конечности. У пациента было полное облегчение после лечения, которое сохранялось через 3 и 12 месяцев наблюдения. Предполагалось, что БОС может иметь длительный эффект на корковую реорганизацию в соматосенсорной коре, тем самым облегчая ФБ.
Последующее пилотное исследование, проведенное Harden et al., изучало эффективность БОС в лечении 9 человек с ФБ, которые получили до 7 сеансов термальной/аутогенной БОС в течение 4–6 недель. Результаты показали 20 % снижение баллов по ВАШ у 5 из 9 пациентов после 4-го сеанса и снижение по крайней мере на 30 % у 6 пациентов после 6-го сеанса.
Десенсибилизация и переработка движениями глаз (ДПДГ)
 Ольга МычкоСчитается, что длительная боль перед ампутацией или болезненные воспоминания, вторичные по отношению к травматическому повреждению, частично ответственны за ФБ. De Roos et al. исследовали, снижает ли психологическое лечение, направленное на обработку эмоциональных и соматосенсорных воспоминаний, связанных с ампутацией, интенсивность боли. 10 пациентов лечили с помощью ДПДГ.
Ольга МычкоСчитается, что длительная боль перед ампутацией или болезненные воспоминания, вторичные по отношению к травматическому повреждению, частично ответственны за ФБ. De Roos et al. исследовали, снижает ли психологическое лечение, направленное на обработку эмоциональных и соматосенсорных воспоминаний, связанных с ампутацией, интенсивность боли. 10 пациентов лечили с помощью ДПДГ.
Состояние 8 из них улучшилось, а 4 сообщили об отсутствии боли через 3 месяца наблюдения. Шестеро наблюдались долгосрочно. У 3 из них боли отсутствовали, а у 2 интенсивность уменьшилась. Это также подтверждают Schneider et al., которые оценивали ДПДГ как метод лечения у 5 пациентов с ФБ.
Эти случаи продемонстрировали улучшение не только по уровню боли, но и тяжести депрессии и посттравматического стрессового расстройства. Авторы предполагают, что физиологическое накопление ноцицептивной боли во время травмы способствует фантому и что эти воспоминания могут быть переработаны, таким образом уменьшая боль. Неясно, какие пациенты могут получить наибольшую пользу от ДПДГ. Дальнейшие исследования должны ответить на эти вопросы.
Электросудорожная терапия
Имеются ограниченные данные, оценивающие потенциальное использование электросудорожной терапии (ЭСТ) при лечении ФБ. Rasmussen et al. выполнили ЭСТ 2 пациентам, у которых не было сопутствующего психиатрического диагноза. Оба пациента сообщили о значительном облегчении боли после сеансов ЭСТ. У одного наблюдалось стойкое облегчение ФБ через 3,5 года после лечения.
Зеркальная терапия
Считается, что механизм ФБ связан с изменениями в корковом представительстве областей, прилегающих к ампутированной конечности. Эта реорганизация корковой карты может быть ответственна за феномен, и ее восстановление может облегчить боль.
Терапия обычно проводится путем размещения зеркала перед ампутированной конечностью таким образом, чтобы пациент видел в нем отражение своей неповрежденной конечности. Эта иллюзия дает ощущение неповрежденной конечности вместо утраченной.
Впервые этот метод продемонстрирован в 1995 году, с тех пор было проведено множество небольших исследований, поддерживающих зеркальную терапию как потенциально многообещающий метод. Также не было отмечено значительных побочных эффектов.
Фантомные упражнения
Фантомные упражнения, также называемые фантомным моторным исполнением, включают в себя выполнение пациентом одних и тех же движений как неповрежденной, так и ампутированной конечностью. В случае ФБ в левой руке пациент двигал правой рукой и представлял, что двигает левой (ампутированной) рукой таким же образом. Механизм, с помощью которого эта практика может уменьшить боль, четко не выяснен.
Работа Maciver et al. продемонстрировала снижение реорганизации коры у тех, кто лечился фантомными упражнениями с использованием данных фМРТ с сопутствующим снижением интенсивности ФБ. Это предполагает, что метод может проявлять свои терапевтические эффекты, улучшая неадекватную корковую реорганизацию.
Что касается пациентов с двусторонней ампутацией, Gaggioli разработала систему виртуальной реальности с миоэлектрическим управлением для лечения ФБ у пациентов с двусторонней трансрадиальной ампутацией верхних конечностей. Система позволяет пациенту напрямую управлять виртуальной конечностью, распознавая паттерны мышц культи, записанные датчиками ЭМГ.
Мультимодальная сенсомоторная тренировка
Работа Gagne et al. продемонстрировала положительную корреляцию между ЭМГ-активностью, полученной в культе во время движения фантомной конечности, и интенсивностью боли. В ежедневной тренировочной программе с помощью визуальной и тактильной обратной связи, вызванной мышечной активностью культи, пациент обучался лучше контролировать двигательную активность фантомной конечности.
Пациенты достигли первоначального снижения интенсивности боли в среднем на 21,6 % в конце тренировочного периода, которое увеличилось до 32,1 % через 6 недель последующего наблюдения. Хотя это и потенциально многообещающий вариант лечения ФБ, исследование ограничено отсутствием контрольной группы. Необходимо дальнейшее изучение, чтобы оценить такой терапевтический метод.
Иммерсивная виртуальная реальность
Зеркальная терапия определенно показала себя многообещающей с точки зрения потенциальной безопасности и эффективности, но существуют ограничения, затрудняющие ее применение. Пациент должен сосредоточиться на отражении неповрежденной руки, чтобы получить иллюзорную визуальную обратную связь с фантомной конечностью. Однако если он ненадолго теряет фокус и действительно смотрит на свою неповрежденную конечность, эта зрительная иллюзия разрушается.
Кроме того, пациент должен оставаться в фиксированном положении, повернув голову к зеркалу, чтобы не изменять отражение в нем. Наконец, каждый человек имеет свое собственное восприятие фантомной конечности, которое может отличаться от его здоровой конечности. Это может объяснить, почему зеркальная терапия очень полезна для некоторых пациентов, но одновременно совершенно неэффективна для других.
Использование иммерсивной виртуальной реальности изучалось как потенциальный метод лечения, который может преодолеть некоторые из ограничений традиционной зеркальной терапии. Кроме того, было высказано предположение, что, поскольку системы виртуальной реальности позволяют проводить больше интерактивных игр, это может бросить вызов пациенту и поддерживать его мотивацию, что может привести к улучшению соблюдения режима лечения и лучшим терапевтическим результатам.
Рекомендации по ведению пациентов
На сегодняшний день отсутствуют крупные, хорошо контролируемые проспективные клинические испытания, непосредственно сравнивающие различные терапевтические методы. Без четких согласованных данных уровня Ia для принятия клинических решений мы должны использовать клиническое мышление, чтобы наилучшим образом адаптировать режим лечения для удовлетворения индивидуальных потребностей пациентов.
Тщательное рассмотрение сопутствующих заболеваний и тяжести течения болезни поможет определить медикаментозное лечение. Терапия, обеспечивающая оптимальное клиническое улучшение, представляет собой междисциплинарный подход, сочетающий фармакологические и немедикаментозные вмешательства. Кроме того, оптимизация перипроцедурного контроля боли является важным шагом в предотвращении сенсибилизации и корковых изменений, которые, по-видимому, являются ключевым патологическим механизмом, посредством которого развивается ФБ (см. рис. 2).
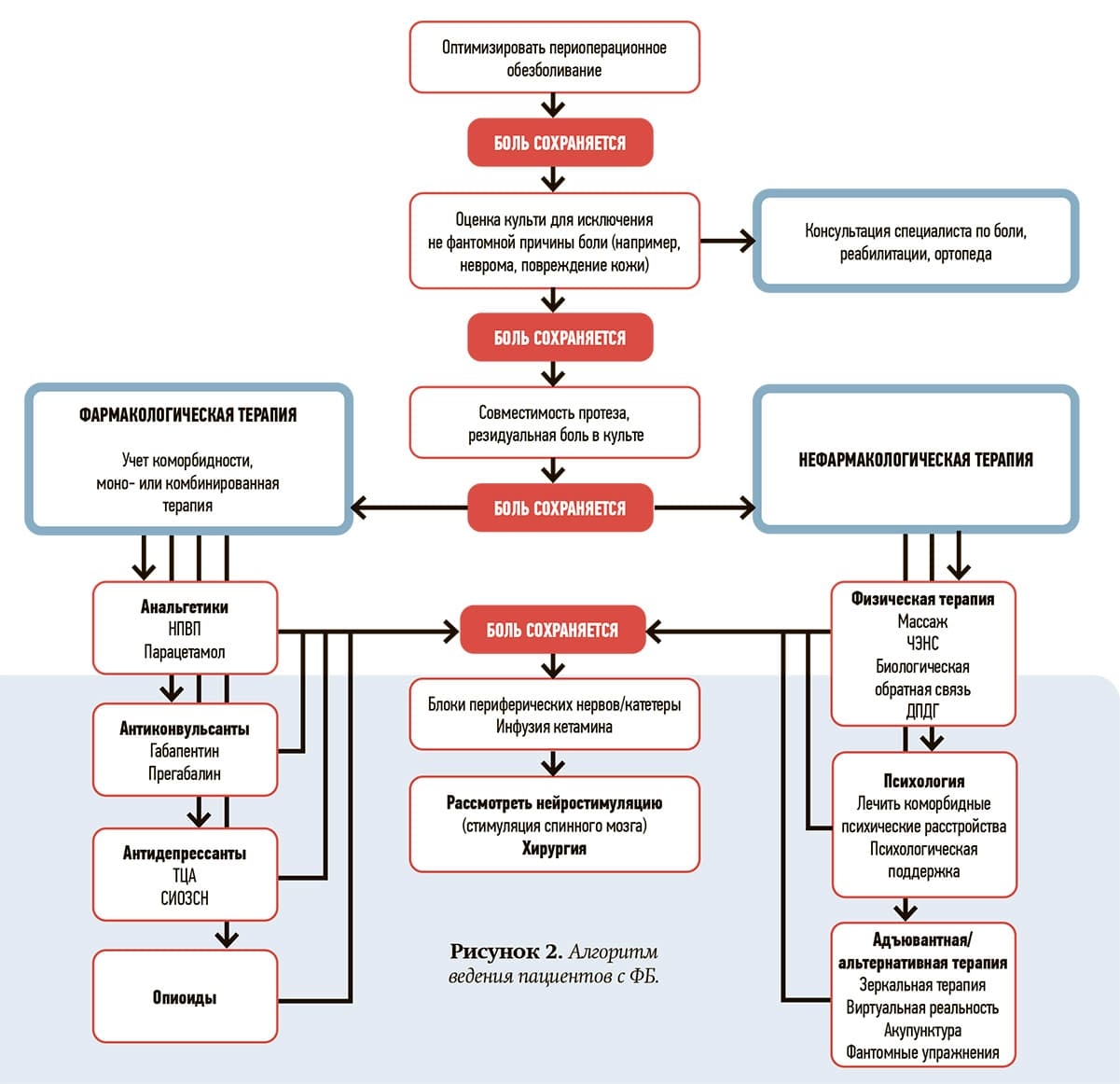
Фантомная боль в онкологии
У пациентов с онкопатологией дополнительными факторами, провоцирующими нейропатическую боль, являются химио- и лучевая терапия, что особенно актуально для переносящих ампутацию, т. к. эти виды противоопухолевого лечения нередко используются в пред- и/или послеоперационном периоде и способствуют усилению ФБ.
В МНИОИ им. П. А. Герцена Минздрава России разработан и успешно внедрен в практику онкоортопедической хирургии способ специальной лекарственной профилактики (СЛП) ФБ путем использования комплекса фармакологических средств, способных блокировать конкретные звенья механизма ФБ на уровне периферических и центральных нервных структур.
Показаниями к использованию СЛП являются ампутация/экзартикуляция конечности, межподвздошно-брюшное вычленение, межлопаточно-грудная ампутация, реконструктивные и реконструктивно-пластические операции на тазовом кольце.
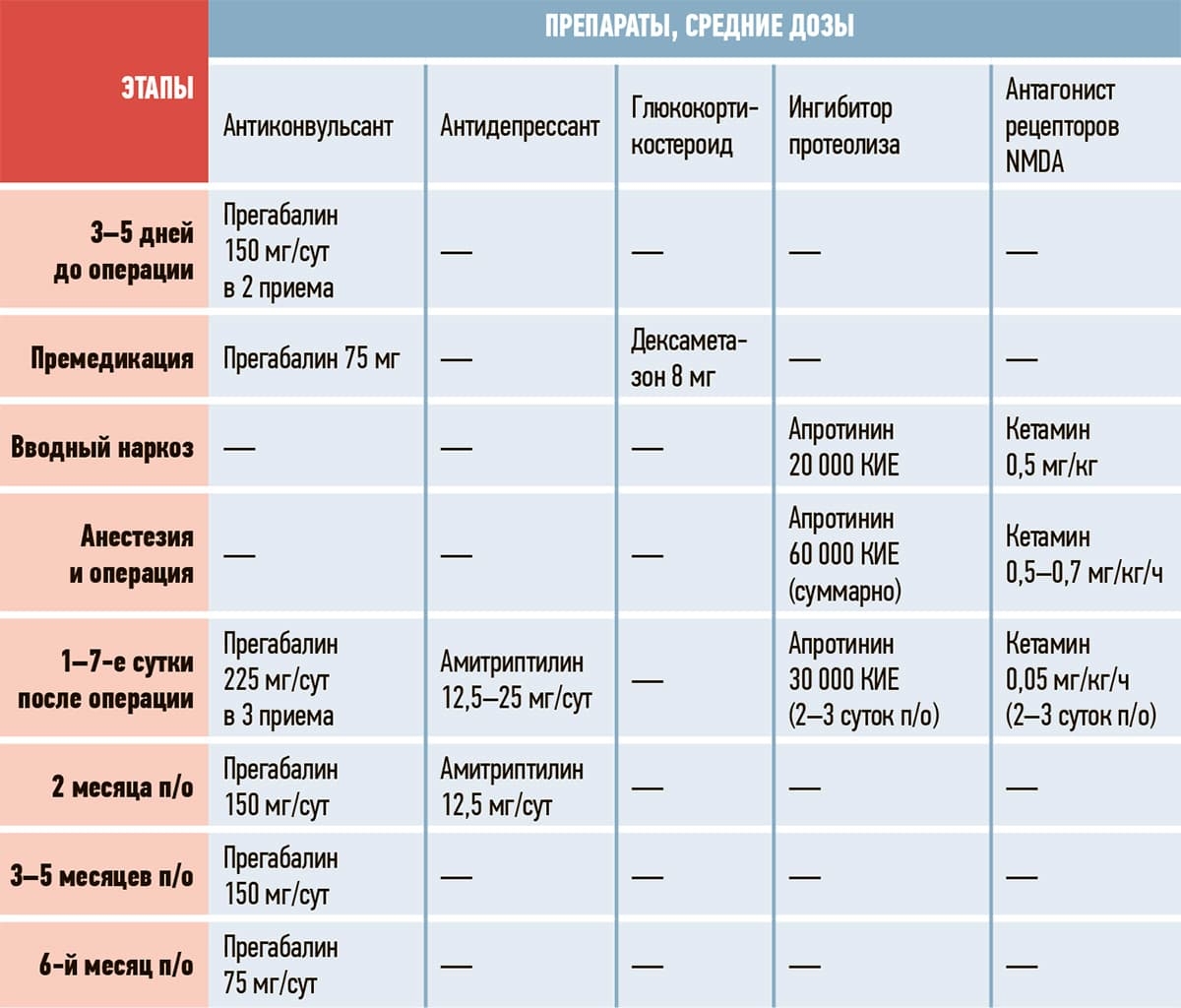
СЛП включает 5 патогенетически обоснованных компонентов, используемых дополнительно к традиционным средствам анестезии и аналгезии на разных этапах:
- антиконвульсант (прегабалин или габапентин);
- глюкокортикостероид (дексаметазон);
- ингибитор протеаз (апротинин) — угнетает протеолиз при травме тканей и продукцию кининовых пептидов — медиаторов боли, воспаления и отека, уменьшает активацию периферических болевых рецепторов;
- антагонист рецепторов NMDA (кетамин);
- трициклический антидепрессант (амитриптилин).
Тактика пред-, интра- и послеоперационного применения указанных средств СЛП представлена в таблице 2.
Таблица 2. СХЕМА ПОЭТАПНОЙ СЛП ФАНТОМНОЙ БОЛИ.
Перед операцией информируют о сути ФБ, о роли самого пациента в правильной оценке специфических симптомов ФБ и в успехе назначенной СЛП, особенно после выписки из стационара, когда пациент должен самостоятельно продолжать СЛП, не допуская перерывов.
Анестезиолог-реаниматолог по данным анамнеза, осмотра, предоперационного обследования и информированного согласия пациента осуществляет предоперационную подготовку, определяет метод анестезии и назначает СЛП. При наличии исходного болевого синдрома его необходимо устранить к моменту операции.
При проведении ампутации используют 2 метода мультимодальной анестезии:
- первый — общая анестезия (ОА): мидазолам в среднем 0,04 мг/кг/ч, пропофол 0,7 мг/кг/ч, фентанил 0,0025 мг/кг/ч, N2O 50–60 % плюс 2 компонента из состава СЛП — кетамин 0,7 мг/кг/ч и апротинин 60 000 КИЕ суммарно. Показан при ампутации верхних конечностей и у больных с ограничениями к эпидуральной анестезии (ЭА) при ампутации нижней конечности;
- второй — ЭА (LII-LIII, ропивакаин в среднем 65±10,8 мг) в сочетании с ОА. При этом достоверно снижаются по сравнению с первым методом средние дозы фентанила (0,0012 мг/кг/ч, р<0,05) и кетамина (0,47 мг/кг/ч, р<0,05) при аналогичных дозах гипнотических компонентов и апротинина. Используется при ампутации нижней конечности.
Независимо от метода анестезии всем больным проводится однотипная премедикация: дексаметазон 8 мг в/м, бензодиазепин (диазепам или мидазолам 0,13/0,1 мг/кг в/м), атропин в стандартной дозе п/к.
В конце операции всем пациентам независимо от метода анестезии с целью превентивной послеоперационной аналгезии проводится в/в инфузия парацетамола 1 г и инъекция трамадола 100 мг в/м.
По окончании операции и поступлении пациента в ОРИТ во всех случаях продолжается плановая профилактическая терапия апротинином/контрикалом 30 000 КИЕ/сут в течение 2–3 суток. Оперированным в условиях комбинированной анестезии (общая+эпидуральная) для поддержания послеоперационной аналгезии проводят продленную ЭА (ропивакаин 0,2 % 8–12 мл/ч), со вторых суток после операции ее продолжают в условиях профильного отделения в течение 5–7 суток с помощью эластомерной помпы. Получившим общую анестезию осуществляют плановую внутривенную инфузию микродоз кетамина 0,05 мг/кг/ч шприцевым дозатором в течение 2–3 суток и прекращают при отсутствии фантомных болевых и сенсорных симптомов.
В день операции вечером возобновляется профилактическая терапия антиконвульсантом и начинается терапия антидепрессантом в дозах, указанных в таблице 2. Далее в течение месяца доза прегабалина/габапентина составляет 225/900 мг/сут, затем прием препарата продолжается в постепенно убывающей дозе до 6 месяцев, принимая во внимание возможность отсроченного развития ФБ. Предпочтительно использование прегабалина благодаря его оптимальным фармакокинетическим характеристикам.
Разработанная СЛП предотвращает развитие острой и отсроченной постампутационной ФБ независимо от используемого метода анестезии/аналгезии (системной или сочетание с продленной эпидуральной блокадой).
Описанный способ профилактики ФБ может быть использован в работе хирургических отделений ортопедического, онкологического, травматологического, сосудистого профиля.
Что касается фармакологического лечения ФБ в конечностях, следует использовать консервативную терапию с хорошими профилями безопасности в качестве первой линии перед назначением опиоидов и хирургического лечения.
Когда это возможно, предпочтительнее лечить ФБ, а также связанные с ней сопутствующие заболевания, используя как можно меньше препаратов.
Например, пациенту, страдающему сопутствующим расстройством настроения, может быть полезна специфическая терапия СИОЗСН. Пациенту с нарушением сна может помочь вечерний прием трициклических антидепрессантов.
Заключение
Постампутационная боль может быть инвалидизирующей, ограничивать способность пациента функционировать.
Крайне важно разработать план лечения. К сожалению, многие традиционные методы не приводят к уменьшению боли и повышению функциональности.
Таким образом, теории, касающиеся центральной причины этого болевого синдрома, получают все большую поддержку и ведут к более творческой терапии. Появляются новые доказательства того, что наш мозг более пластичен, чем считалось ранее. Поэтому есть надежда, что мы сможем сосредоточиться на этой пластичности, чтобы найти новые способы лечения определенных болевых состояний, включая ФБ. Именно здесь использование зеркальной терапии и виртуальной реальности имеет большие перспективы, поэтому настоятельно рекомендуется проводить дополнительные исследования в данных областях.
Фантомная боль. Междисциплинарный подход как ключ к успешной терапии. Часть 2
