Главной целью иммунотерапии является специфическое уничтожение опухолевых клеток с минимальным повреждением здоровых тканей. Добиться этой цели позволяет использование естественных механизмов иммунной системы, которые отличаются тонкой регуляцией и высокой точностью. Одна из таких технологий — CAR-T-терапия.
САR-T-рецептор
Терапия Т-лимфоцитами, экспрессирующими химерный антигенный рецептор, или CAR-T-терапия (англ. CAR — chimeric antigen receptor), является вариацией на тему классического клеточного иммунного ответа, в котором Т-лимфоцит атакует пораженную вирусом клетку после распознавания на ее поверхности фрагмента вирусного антигена.
В природе распознавание антигена и запуск цитотоксического ответа обеспечивается Т-клеточным рецептором и ассоциированным с ним комплексом корецепторов. Однако в случае CAR-T-клеток все эти реакции координируются одной молекулой — CAR-рецептором, сконструированным искусственно. Его внеклеточная часть представлена одноцепочечным фрагментом моноклонального антитела, которое распознает определенный антиген на поверхности опухолевой клетки. Внутриклеточная часть в свою очередь активирует сигнальные пути цитотоксического ответа.
В отличие от естественного Т-клеточного рецептора, распознавание которого ограничено главным комплексом гистосовместимости HLA, CAR способен взаимодействовать с молекулой антигена напрямую. Это позволяет сконструировать химерный рецептор со специфичностью к абсолютно любой молекуле на абсолютно любой клетке. Однако несмотря на столь широкие возможности, CAR-T-терапия так и не стала «волшебной пулей» в лечении многих онкологических заболеваний.
Проблемы аутологичной CAR-T-терапии
Первыми клинически испытанными CAR-T-продуктами стали анти-CD19-клетки, которые продемонстрировали впечатляющие результаты при лечении тяжелых случаев В-клеточного острого лимфобластного лейкоза с частотой выхода в полную ремиссию 80–90 %. После этого стали пытаться создавать CAR-T к различным опухолевым антигенам.
Однако с началом клинических испытаний стало очевидно, что секрет успеха заключается далеко не только в конструкции рецептора. Оказалось, что на эффективность терапии влияет множество дополнительных факторов: доступность опухолевой массы для CAR-T-клеток, иммуносупрессорное микроокружение опухоли, потеря антигена опухолевыми клетками в ходе клональной эволюции и др.
Кроме того, вскоре стало понятно, что эффективность CAR-T-продукта также зависит от функционального состояния Т-лимфоцитов пациента и степени их вызревания. Оба этих параметра сильно варьируют в зависимости от типа опухоли и особенностей предшествующего лечения. Итогом опухолевой иммуносупрессии и агрессивной химиотерапии становится развитие у Т-лимфоцитов состояния «истощения» и смещение их популяционного состава в сторону терминальных эффекторов.
CAR-T-клетки, полученные на основе таких лимфоцитов, характеризуются сниженной способностью к пролиферации и цитотоксическому ответу, а также непродолжительным периодом персистенции в организме пациента. Кроме того, трудности с пролиферацией ex vivo, а также ограниченное количество исходных Т-лимфоцитов становятся очень частой причиной технического провала в попытке получить CAR-T-продукт для конкретного пациента.
Если проблемы взаимодействия CAR-T и опухолевой клетки решаются на уровне дизайна рецептора, то физиологическое состояние Т-лимфоцитов пациентов остается данностью, с которой необходимо мириться.
Аллогенные CAR-T-клетки как альтернатива аутологичным
В попытке улучшить внутренние характеристики CAR-T-клеток, а также сделать терапию более доступной как в клиническом, так и в экономическом смысле, мировое научное сообщество обратилось к альтернативному ресурсу Т-лимфоцитов — здоровым донорам (см. рисунок).
Рисунок. Особенности аутологичной и аллогенной CAR-Т-терапии.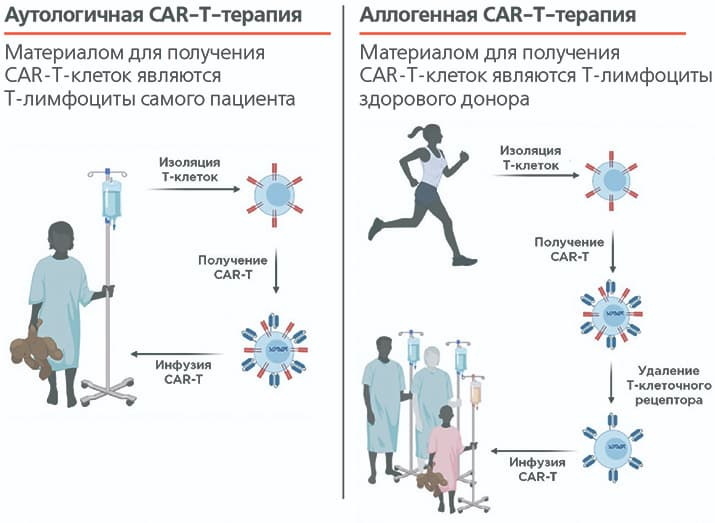 Так как Т-лимфоциты здоровых доноров, в отличие от Т-лимфоцитов пациентов, не испытывают на себе иммуносупрессии, они не имеют проблем с пролиферацией и запуском цитотоксического ответа, а в их популяционном составе преобладают долгоживущие наивные клетки и клетки центральной и стволовой памяти. Кроме того, донорские Т-лимфоциты можно получать в неограниченных количествах, что дает возможность за один производственный цикл получить сразу несколько доз CAR-T-продукта, которые можно длительно хранить и использовать по мере необходимости.
Так как Т-лимфоциты здоровых доноров, в отличие от Т-лимфоцитов пациентов, не испытывают на себе иммуносупрессии, они не имеют проблем с пролиферацией и запуском цитотоксического ответа, а в их популяционном составе преобладают долгоживущие наивные клетки и клетки центральной и стволовой памяти. Кроме того, донорские Т-лимфоциты можно получать в неограниченных количествах, что дает возможность за один производственный цикл получить сразу несколько доз CAR-T-продукта, которые можно длительно хранить и использовать по мере необходимости.
Донорские Т-лимфоциты могут применяться для создания CAR-T только при условии отсутствия у них свойств аллореактивности и иммуногенности, что будет гарантировать их безопасность и длительную персистенцию в организме пациента.
Проблему получения таких клеток можно решить на клеточном и генетическом уровнях.
Клеточный подход подразумевает выделение определенной фракции лимфоцитов, не участвующих в развитии реакции «трансплантат против хозяина» (РТПХ): вирус-специфических лимфоцитов, iNKT или gdТ-клеток, но их изоляция связана с дополнительными техническими сложностями.
Генетический подход подразумевает нокаут (перевод в нефункциональное состояние) генов, продукты которых задействованы в реакциях алло-распознавания. Эта стратегия предполагает придание донорским CAR-T-лимфоцитам селективного преимущества в условии действия определенных иммуносупрессорных препаратов.
Таблица. Сравнительные характеристики аутологичных и аллогенных CAR-T-клеток.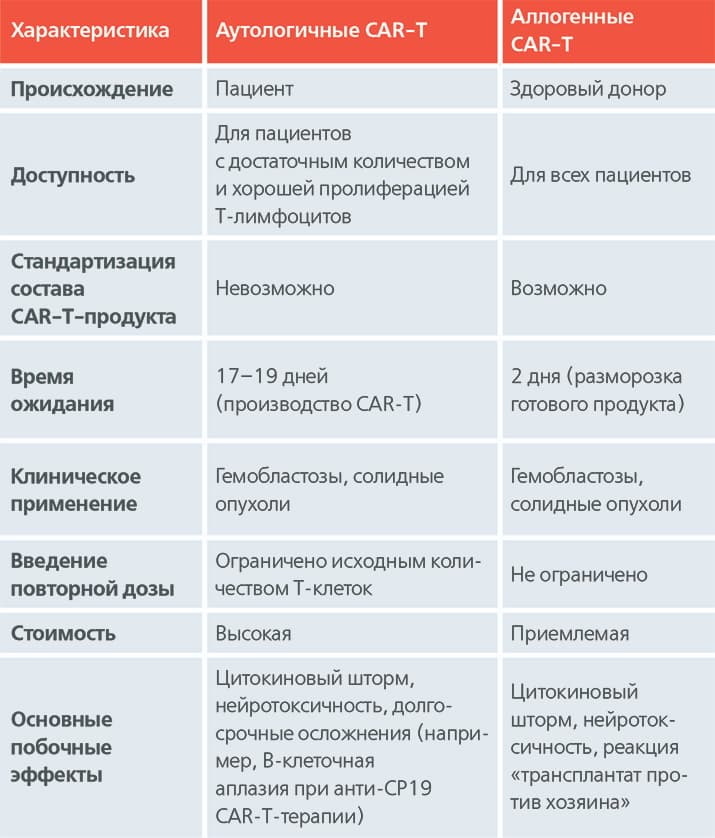
Клиническое применение аллогенных CAR-T-клеток
Клинические испытания подтверждают безопасность аллогенного CAR-T-продукта. Так, среди опубликованных на данный момент результатов пяти испытаний с количеством участников от 6 до 19 человек не было обнаружено ни одного случая развития РТПХ, при этом противоопухолевая эффективность не уступает аналогичным аутологичным CAR-T-продуктам.
В настоящее время в лаборатории генетических биотехнологий РНПЦ детской онкологии, гематологии и иммунологии впервые в Беларуси начата работа по получению универсальных аллогенных CAR-T-клеток путем CRISPR/Cas9 удаления генов TCR, HLA-I и II. Технология редактирования была успешно проверена на клеточных линиях HEK293T, Raji и Jurkat.
Нам удалось с помощью технологии CRISPR/Cas9 редактирования удалить HLA-I в 60 % клеток HEK293T и Т-клеточный рецептор в 71 % клеток Jurkat. Cейчас отрабатывается модификация Т-лимфоцитов донора с одновременной трансдукцией вирусом, доставляющим в клетки целевой CAR-рецептор.
Дальнейшие планы научного коллектива лаборатории генетических биотехнологий заключаются во внедрении технологии геномного редактирования Т-лимфоцитов в уже существующую схему производства анти-CD19 CAR-T-клеток для терапии острого лимфобластного лейкоза. В настоящий момент материалом для получения анти-CD19 CAR-T являются аутологичные Т-лимфоциты пациента.
Это ограничивает применимость CAR-T-терапии пациентами, у которых возможен забор достаточного стартового количества Т-лимфоцитов с хорошими функциональными характеристиками. Использование геномного редактирования позволит получать безопасные «универсальные» CAR-T-клетки на материале Т-лимфоцитов здоровых доноров, что значительно расширит область применения CAR-T-терапии в нашей стране.