Лучевая терапия — один из трех ключевых методов лечения онкологических заболеваний наряду с хирургией и химиотерапией. Основным инструментом является ионизирующее излучение, которое при неконтролируемом применении опасно, но в медицине становится высокоэффективным средством лечения. За последние десятилетия возможности лучевой терапии значительно возросли благодаря внедрению современных технологий. Речь идет не просто о фокусированном облучении опухоли, а о точных, персонализированных методах, которые позволяют разрушать опухолевые клетки, почти не затрагивая окружающие ткани.
Этапы подготовки пациента
Лучевая терапия назначается только при наличии показаний. Решение о ее проведении принимает врач — радиационный онколог, в сложных случаях — консилиум специалистов на основе клинических, инструментальных и лабораторных данных, включая КТ и результаты морфологического исследования опухоли. Подготовка к лучевой терапии состоит из нескольких этапов, требующих участия специалистов разных профилей.
Первый этап — выбор оптимального положения пациента и фиксирующих устройств, которые обеспечивают комфорт и неподвижность во время облучения, что необходимо для точности и безопасности лечения.
Во многих случаях применяются специальные термопластические маски, особенно при облучении области головы и шеи. При нагревании до 70 °C материал становится мягким и принимает форму поверхности тела, а после охлаждения затвердевает, обеспечивая надежную фиксацию пациента во время лечения.
Второй этап — сканирование на КТ в лечебном положении с использованием фиксирующих устройств, последующая обработка изображений (КТ-симуляция).
На полученных КТ-изображениях врач — радиационный онколог, основываясь на данных обследований и протоколах операций, оконтуривает целевой объем облучения и органы риска. Для уточнения границ опухоли изображения КТ при необходимости совмещают с изображениями МРТ, которая обеспечивает лучшую визуализацию мягких тканей, или ПЭТ-КТ, показывающей метаболическую активность опухоли. Для ускорения и повышения точности подготовки внедряются технологии искусственного интеллекта, позволяющие автоматически обрабатывать изображения и предлагать оптимальные контуры.
Третий этап — создание планов лучевой терапии.
Медицинский физик рассчитывает параметры облучения, выбирает настройки оборудования и совместно с лечащим врачом оценивает результат. После утверждения плана облучения проводится дозиметрический контроль — проверка соответствия расчетной и измеренной дозы с помощью фантомов и детекторов. Только после подтверждения точности подведения дозы облучения можно приступать к лечению.
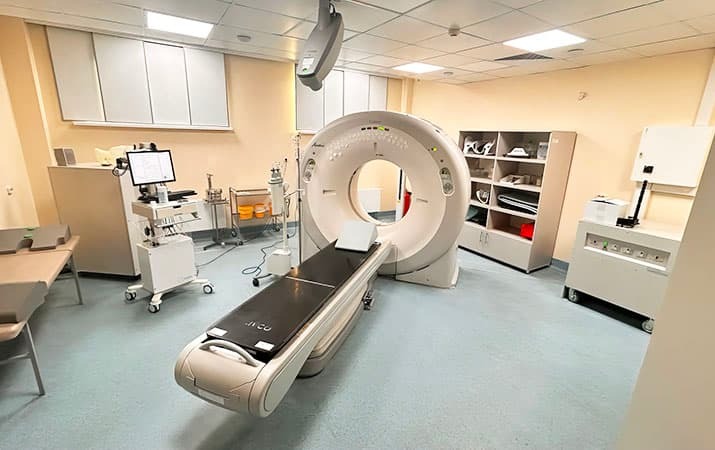
Компьютерный томограф, используемый при планировании лучевой терапии.
Специализированное оборудование
Около 70 % пациентов проходят лечение на современных цифровых линейных ускорителях электронов. В отличие от аппаратов прошлых десятилетий, они не содержат постоянного источника излучения — пучок генерируется ускорителем, преобразующим электрическую энергию в ионизирующее излучение. Это делает лечение более управляемым, безопасным и точным.
Помимо линейных ускорителей в Беларуси используется специализированная установка высокоточной дистанционной лучевой терапии — гамма-нож, применяемый при внутричерепных патологиях (опухоли головного мозга, артериовенозные мальформации). Облучение проводится с помощью 192 источников кобальта-60, сфокусированных в одной точке, что позволяет достичь субмиллиметровой точности.
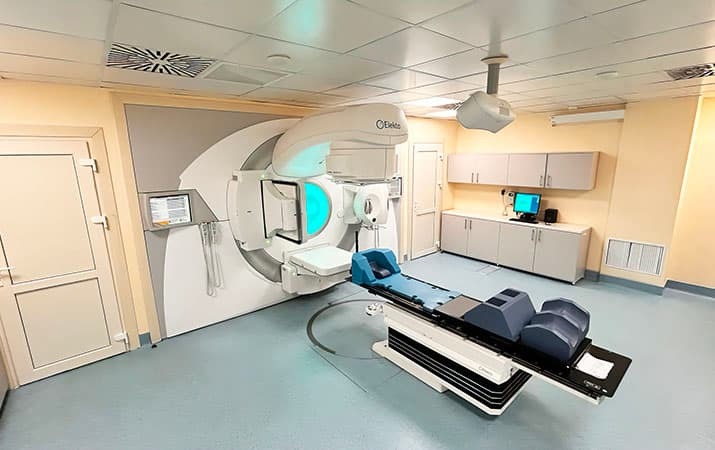
Линейный ускоритель электронов.
К высокотехнологичным методам относится и брахитерапия (контактная лучевая терапия), при которой источник излучения помещается внутрь опухоли или в близлежащую полость. Благодаря резкому снижению дозы за пределами зоны воздействия здоровые ткани почти не страдают. Пример — лечение рака шейки матки, при котором в полость матки и влагалища устанавливаются аппликаторы с источником иридия-192. Такой метод называется HDR-брахитерапией (брахитерапия с высокой мощностью дозы).

Брахитерапевтический аппарат.
Передовые методы
IMRT (Intensity-Modula-ted Radiation Therapy) — позволяет изменять интенсивность излучения в пределах одного поля, формируя оптимальное распределение дозы облучения. Преимущество метода — возможность лечить опухоли сложной формы, прилежащие к критическим органам, например к спинному мозгу.
VMAT/RapidArc (Volumetric Modulated Arc Therapy) — развитие метода IMRT. Линейный ускоритель вращается вокруг пациента по одной или нескольким дугам, при этом одновременно меняются форма поля, интенсивность излучения и скорость вращения. Сеанс длится всего несколько минут, что снижает влияние дыхательных движений и повышает комфорт пациента.
IGRT (Image-Guided Radiation Therapy) — терапия под визуальным контролем. Перед облучением выполняется контрольное КТ-сканирование (чаще всего конусно-лучевая КТ), которое сравнивается с планировочными изображениями. При выявлении смещения целевого объема система автоматически корректирует положение пациента с точностью до миллиметра. Без IGRT невозможно безопасно подводить высокие дозы облучения.
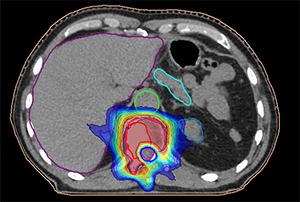 Планирование СЛТ при опухоли позвонка.Стереотаксическая радиохирургия и стерео-таксическая лучевая терапия (СЛТ) — методы, обеспечивающие подведение очень высокой дозы за один или несколько сеансов с субмиллиметровой точностью. Только за 2024 год в МГКОЦ лечение по данной технологии получили более 100 пациентов. В мировой практике известны системы «Кибер-нож» и «Гамма-нож», последняя успешно применяется в РНПЦ онкологии и медрадиологии им. Н. Н. Александрова.
Планирование СЛТ при опухоли позвонка.Стереотаксическая радиохирургия и стерео-таксическая лучевая терапия (СЛТ) — методы, обеспечивающие подведение очень высокой дозы за один или несколько сеансов с субмиллиметровой точностью. Только за 2024 год в МГКОЦ лечение по данной технологии получили более 100 пациентов. В мировой практике известны системы «Кибер-нож» и «Гамма-нож», последняя успешно применяется в РНПЦ онкологии и медрадиологии им. Н. Н. Александрова.
Развитие технологий лучевой терапии привело к созданию методов, учитывающих смещения внутренних органов, вызванные дыханием: при каждом вдохе и выдохе положение диафрагмы и органов брюшной полости изменяется, что требует точной синхронизации. Для этого применяются системы слежения на основе рентгеновского, оптического или ультразвукового контроля. Эти методы получили название лучевая терапия, синхронизированная с дыханием (Gating). Видеокамера отслеживает движение метки на груди пациента, и облучение включается только в выбранную фазу дыхательного цикла, когда положение опухоли наиболее предсказуемо. Это позволяет уменьшить поле облучения и снизить дозу на здоровые ткани.
Персонализация и контроль качества
Современная лучевая терапия — это не один метод, а их интеллектуальное сочетание. Например, лечение рака предстательной железы может включать VMAT и IGRT для основного объема, а затем — локальную брахитерапию. Главный тренд — персонализация: создание индивидуального плана, учитывающего форму, движение и биологические особенности опухоли. Это позволяет снизить риск осложнений и повысить эффективность лечения.
Решение о выборе технологии принимает врач — радиационный онколог совместно с медицинским физиком. На этапе планирования они оценивают не только ожидаемый эффект, но и возможные осложнения.
Качество лучевой терапии обеспечивается системой контроля, включающей регулярную калибровку ускорителей, проверку планов на фантомах, использование детекторных матриц и in vivo дозиметрии. Метрологическое обеспечение гарантирует соответствие расчетной и измеренной дозы, что особенно важно при применении IMRT, VMAT и стереотаксических методик.
Опыт Беларуси
В нашей стране внедрены практически все современные технологии: IMRT, VMAT, IGRT, стереотаксическая радиохирургия и брахитерапия. В клиниках установлено передовое оборудование, позволяющее реализовывать высокотехнологичные методы лечения. Это обеспечивает соответствие уровню ведущих европейских центров и доступность современной лучевой терапии для белорусских пациентов. Благодаря системному подходу и кадровому потенциалу пациенты сегодня имеют возможность получать лечение, соответствующее мировым стандартам, что повышает шансы на успешный исход и качество жизни.
Случай из практики
Пациент П., мужчина, 84 года.
Установлен диагноз периферического рака верхней доли левого легкого cT1bN0M0, Ia стадия. В связи с выраженной сопутствующей кардиологической патологией и высоким риском осложнений хирургическое лечение не проводилось. Пациенту проведено три сеанса СЛТ с разовой дозой 18 Грей за сеанс, с интервалом через 1 день (рис. 1). По данным ПЭТ/КТ через 4 месяца после лучевой терапии опухоль уменьшилась в размерах, перестала накапливать фтордезоксиглюкозу (рис. 2). Имеет место полный метаболический ответ опухоли на лечение.
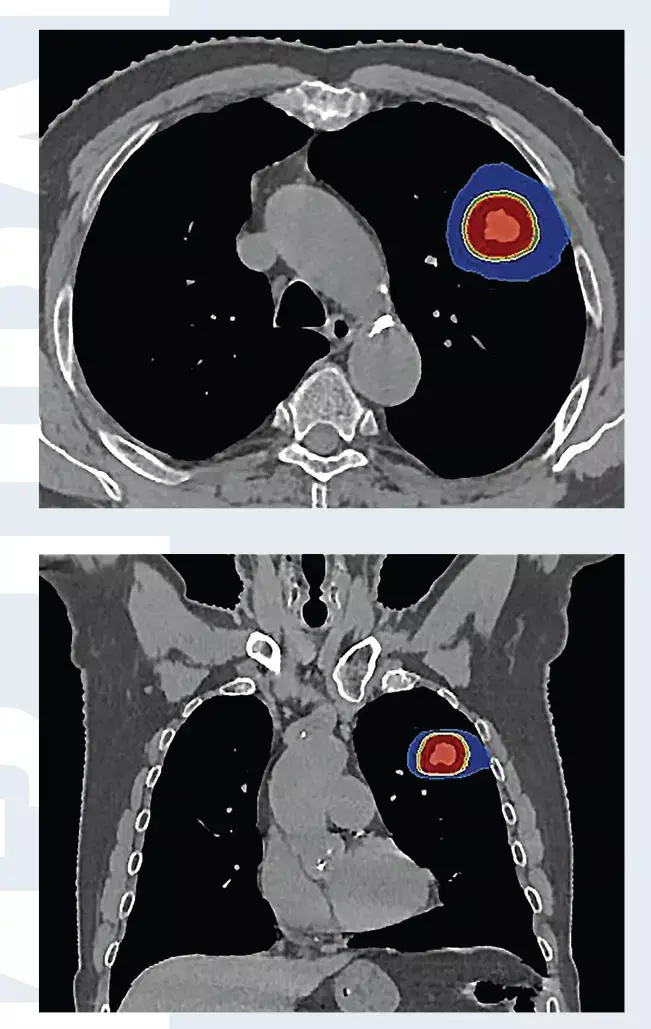 Рис. 1. План стереотаксической лучевой терапии при периферическом раке левого легкого. Максимальная доза облучения (красным цветом) подводится локально на опухоль, окружающие нормальные ткани практически не облучаются.
Рис. 1. План стереотаксической лучевой терапии при периферическом раке левого легкого. Максимальная доза облучения (красным цветом) подводится локально на опухоль, окружающие нормальные ткани практически не облучаются.
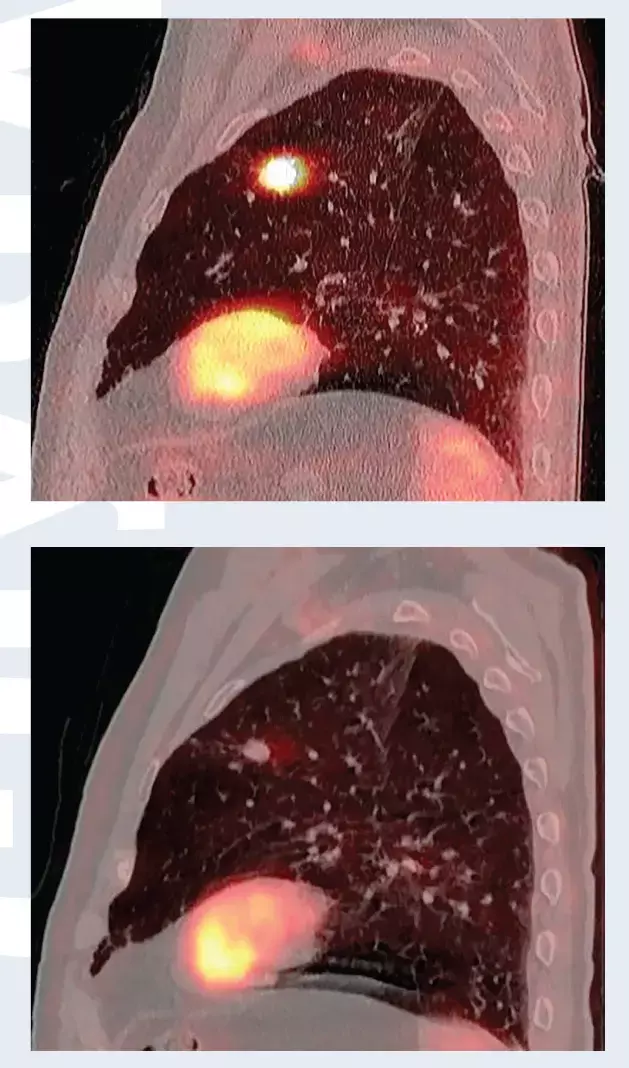
Рис. 2. ПЭТ/КТ до стереотаксической лучевой терапии (вверху) и 4 месяца спустя (внизу). Полный метаболический ответ опухоли на лечение.
