Сообщения о детях с новым заболеванием, имеющим признаки болезни Кавасаки и синдрома токсического шока, впервые в мире проявились в марте 2020 года. Патология ассоциирована с коронавирусной инфекцией (предполагается, что в организме происходит иммунный сбой, вследствие чего в различных органах и тканях возникает тяжелое воспаление, могут поражаться сердце, легкие, почки, ЖКТ, кожа, глаза и даже ЦНС) и получила название детского мультисистемного воспалительного синдрома, ассоциированного с COVID-19, — ДМВС (в англоязычной литературе Multisystem inflammatory syndrome in children, MIS-C).
 Оксана РомановаВ Беларуси первый ребенок с ДМВС (мальчик 4 лет) был госпитализирован в Минскую ГДИКБ 19 мая 2020 года. На данный момент пролечено уже более 80 детей с ДМВС, патология выявлялась при всех вариантах коронавируса — начиная с первого уханьского штамма и заканчивая «омикроном». В настоящее время примерно один ребенок в месяц госпитализируется с таким редким заболеванием. Об этом рассказала Оксана Романова, заведующая кафедрой детских инфекционных болезней БГМУ, доктор мед. наук, профессор.
Оксана РомановаВ Беларуси первый ребенок с ДМВС (мальчик 4 лет) был госпитализирован в Минскую ГДИКБ 19 мая 2020 года. На данный момент пролечено уже более 80 детей с ДМВС, патология выявлялась при всех вариантах коронавируса — начиная с первого уханьского штамма и заканчивая «омикроном». В настоящее время примерно один ребенок в месяц госпитализируется с таким редким заболеванием. Об этом рассказала Оксана Романова, заведующая кафедрой детских инфекционных болезней БГМУ, доктор мед. наук, профессор.
Гипотезы гипервоспаления при ДМВС
Оксана Романова:
Детский мультисистемный воспалительный синдром — это тяжелое гипервоспалительное состояние, ассоциированное с вирусом SARS-CoV-2, возникающее через 2–6 недель после перенесенной коронавирусной инфекции, в т. ч. перенесенной бессимптомно. С мая 2020 года в Беларуси диагностируется ДМВС.
Наибольшее количество детей (40) имело уханьский штамм SARS-CoV-2, и, к сожалению, тогда был даже один летальный исход. В волну варианта «альфа» произошло снижение случаев, затем некоторое увеличение в волну «дельты». В растянувшуюся волну «омикрона» диагностировали 16 случаев ДМВС (см. рисунок).
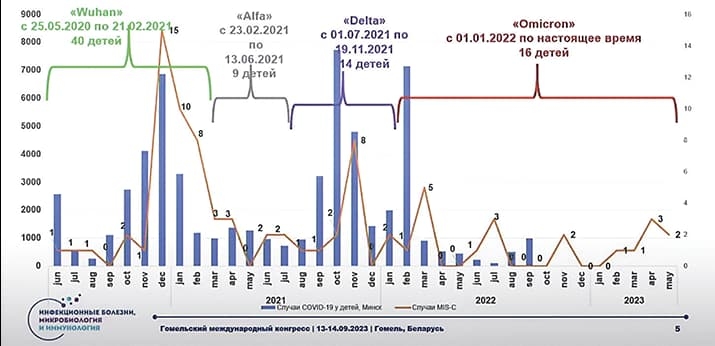
Рисунок. Число пациентов с ДМВС, пролеченных в ГДИКБ.
Рассматриваются 4 гипотезы возникновения ДМВС.
Оксана Романова:
Первоначальное предположение было основано на суперантигенной стимуляции Т-клеток: активация Т-клеток приводит к цитокиновому шторму и мультиорганному повреждению.
Вторая гипотеза связана с хроническим воспалительным ответом на постоянное воздействие вирусного антигена и последующим истощением Т-клеток. Третья касается вовлечения в процесс ЖКТ.
Четвертый предполагаемый механизм связан с выработкой аутоантител. Вполне вероятно, что в патогенезе ДМВС задействованы все перечисленные механизмы: первичная персистенция вируса в кишечнике вызывает антигенемию с обилием суперантигенов, длительная чрезмерная активация иммунных механизмов приводит к образованию аутоантител. Недавно появились данные о выявлении генов, которые отвечают за предрасположенность к ДМВС.
Клиническая симптоматика
Оксана Романова представила результаты исследования, в котором проанализированы истории болезни 82 детей с диагнозом ДМВС, госпитализированных и пролеченных в ГДИКБ Минска. Цель проведенного анализа — описать клинические проявления, течение заболевания, в том числе с учетом штамма SARS-CoV-2, применяемые методы терапии.
Структура ДМВС. Среди заболевших заметно превалирует число мальчиков — 68 % (девочек — 32 %). Никто из заболевших детей не имел серьезной сопутствующей патологии. Средний возраст — 8 лет (зарегистрированы пациенты от года до 17 лет). По словам Оксаны Романовой, в волну варианта «омикрон» ДМВС «помолодел» — средний возраст сдвинулся в сторону 5 лет. Такая же ситуация и по международным данным.
Связь с перенесенным COVID-19. Только 31 % родителей отмечали, что за месяц до развития симптоматики ДМВС ребенок перенес коронавирусную инфекцию либо в семье был случай COVID-19, но ребенок не болел. Однако при этом абсолютно у всех детей выявлен высокий уровень антител класса G (IgG).
Гипертермический синдром. Все дети при госпитализации имели повышенную температуру: 87 % — фебрильную, 13 % — субфебрильную.
Поражение слизистых возникало на 2–3-й день болезни. Чаще это были склерит (71 %), хейлит (70 %), у 3 % — поражения слизистой половых органов.
Поражение кожных покровов. На 2–3-й день болезни у 84 % детей отмечалась разнообразная сыпь, как правило, пятнистая, редко — мелкоточечная и геморрагическая.
Отечный синдром наблюдался у 46 % пациентов, развивался обычно на 4-й день болезни, проявлялся пастозностью лица, кистей и стоп.
Поражение ЖКТ и почек. Дисфункция ЖКТ (64 %) проявлялась болевым синдромом, послаблением стула, рвотой, отказом от еды и питья. Также отмечались гепатомегалия (71 %), спленомегалия (37 %), реномегалия (39 %), свободная жидкость в полости малого таза (43 %), протеинурия (64 %), повышение креатинина (51 %), мочевины (23 %).
Поражение дыхательной системы. 42 % детей имели пневмонию или интерстициальные изменения в легких. Однако дыхательная недостаточность регистрировалась только у 29 %. В продленной ИВЛ нуждались 6 % детей.
Поражение сердечно-сосудистой системы. Более выраженным поражение сердечно-сосудистой системы было в волну «дельты» — миокардит, коронарит, перикардит. При «омикроне» — реже и менее выраженные поражения, но присутствуют изменения на ЭКГ: нарушение реполяризации, синусовая брадикардия, АВ-блокада 1-й степени, миграция водителя ритма, снижение вольтажа.
Действия на амбулаторном этапе и при госпитализации
Оксана Романова подчеркнула важность тщательного сбора анамнеза при наблюдении на амбулаторном этапе детей со стойкой лихорадкой на протяжении 3 дней, имевших контакт с носителями COVID-19 или перенесших коронавирусную инфекцию 2–6 недель назад.
Оксана Романова:
Если у такого ребенка наряду с повышенной температурой имеется сыпь, склерит/хейлит, отечный синдром, дисфункция ЖКТ, при этом в общем анализе крови выявляется нейтрофилия, лимфоцитопения, тромбоцитопения, анемия, IgG (могут быть IgG и IgM), изменения КОС, необходима госпитализация в стационар. В приемном отделении пациент обязательно консультируется врачом-анестезиологом-реаниматологом и по результатам может госпитализироваться сразу в отделение реанимации и интенсивной терапии. Врачебный мультидисциплинарный консилиум обязателен в первые 24 часа госпитализации.
Поскольку при ДМВС поражаются различные органы и системы, лечение требует участия и координации действий врачей различных специальностей: анестезиологов-реаниматологов, инфекционистов, кардиологов, ревматологов, педиатров, хирургов, рентгенологов, врачей УЗД.
Оксана Романова:
Дифференциальная диагностика проводится с хирургической патологией, потому что выраженная боль в животе требует исключения клиники острого живота. Для этого проводится УЗИ, КТ брюшной полости. Иногда очень сложно дифференцировать ДМВС с болезнью Кавасаки, при которой также присутствуют воспалительные маркеры, миокардиальная дисфункция.
Необходимо выполнить УЗИ сердца, оценить лабораторные данные в динамике. Чтобы исключить бактериальный сепсис, токсический шок, выполняются посевы сред, экспресс-тест на стрептококк, оценивается характер сыпи. ДМВС имеет схожесть с вирусными инфекциями (парвовирус В19, ротавирус, энтеровирусы, краснуха, цитомегаловирус, вирус Эпштейна — Барр), для их исключения выполняются лабораторные исследования (ПЦР, ИФА). Также необходимо провести дифференциальную диагностику с системной красной волчанкой, васкулитом, тяжелыми формами коронавирусной инфекции, гемофагоцитарным лимфогистиоцитозом.
Терапия ДМВС
Оксана Романова:
Терапия ДМВС основана на оценке общего состояния и витальных функций, мониторинге витальных функций, проведении противошоковых мероприятий. Питание энтеральное либо парентеральное (частичное или полное). Если ребенок нуждается в кислороде, применяем кислородную маску, носовые канюли. Строго мониторим волемическую нагрузку, так как высок риск кардиогенного шока.
По всем методическим рекомендациям первой линией терапии являются высокодозные внутривенные иммуноглобулины (ВВИГ). Вторая линия —глюкокортикостероиды, третья — моноклональные антитела. В нашей клинике мы ни разу не прибегали к применению моноклональных антител.
Внутривенные иммуноглобулины. Доза ВВИГ 2 г/кг вводится однократно в течение 6–12 часов. У пациентов с ожирением доза должна основываться на рассчитанной идеальной массе тела. Пациентам со значительной дисфункцией левого желудочка при опасении, что они не перенесут объемную нагрузку полной дозы за одну инфузию, ВВИГ можно вводить разделенными дозами в течение двух дней (по 1 г/кг).
Глюкокортикоидная терапия. Первоначально проводится внутривенно метилпреднизолоном в дозе от 1 до 2 мг/кг/сут в 2 приема. Пульсовая доза метилпреднизолона от 10 до 30 мг/кг/сут в течение 1–3 дней.
Антибактериальная терапия. Назначаются антибиотики широкого спектра действия (цефалоспорины 3-го поколения моно или в сочетании с ванкомицином или линезолидом), карбапенемы.
Антитромботическая терапия. Большинству пациентов (с тяжелой дисфункцией левого желудочка или дилатацией коронарных артерий) к терапии добавляется аспирин в низких дозах (от 3 до 5 мг/кг в день). Исключение составляют пациенты с противопоказаниями (количество тромбоцитов менее 100 000/мкл или активное кровотечение). Альтернатива — низкомолекулярные гепарины: клексан, лечебная доза 1 мг/кг 2 раза в день подкожно; фрагмин, начальная доза 130 Ед/кг/сут, поддерживающая доза 100 Ед/кг/сут подкожно; фраксипарин, 86 анти-ХА МЕ/кг 2 раза в день подкожно.
Синдромальная терапия. Коррекция электролитных нарушений, гипоальбуминемии, гастропротекция, антипиретическая терапия, диуретики и др.
Оксана Романова:
Комбинированная терапия «внутривенный иммуноглобулин плюс глюкокортикостероид» показала высокую эффективность в лечении MIS-C. У трех детей мы применяли монотерапию ВВИГ. После выхода рекомендаций ВОЗ двух детей лечили только кортикостероидами, но они вышли на коронарит, и мы вернулись к ВВИГ. 30 детям потребовалась терапия АГ, шока, 23 ребенка нуждались в кардиотонической поддержке, 10 — в коррекции гипоальбуминемии.
При антибактериальной терапии 50 детям назначался 1 препарат, 23 — два препарата, не назначались антибиотики трем детям. Антитромботическую терапию аспирином получили 48 детей. НМГ — 5. После адекватной терапии к 7-му дню лечения практически все клинические проявления болезни начинали угасать. Это подтверждалось и динамикой лабораторных показателей: уходили лейкоцитоз и лимфоцитопения, нормализовались число тромбоцитов, уровень гемоглобина, снижались СОЭ, С-реактивный белок, прокальцитонин, D-димеры, фибриноген А.
