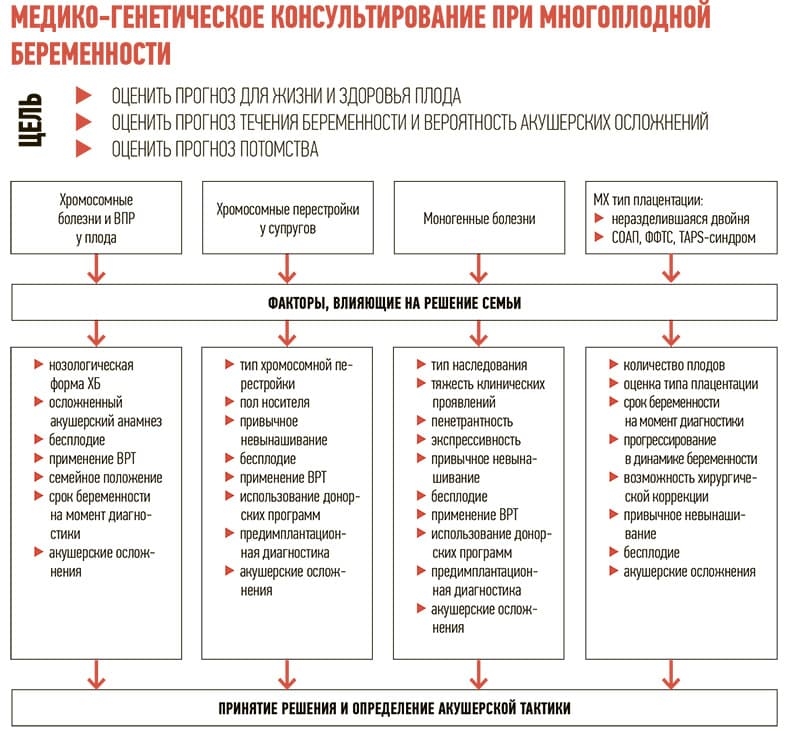
О нюансах выбора правильной репродуктивной тактики и плана ведения многоплодной беременности рассказала заведующая лабораторией медицинской генетики и мониторинга врожденных пороков развития РНПЦ «Мать и дитя», главный внештатный специалист по медицинской генетике Минздрава, профессор кафедры репродуктивного здоровья и медицинской генетики БелМАПО, доктор мед. наук Оксана Прибушеня.
 В настоящее время количество многоплодных беременностей увеличивается, это связано с возрастом женщин, применением вспомогательных репродуктивных технологий.
В настоящее время количество многоплодных беременностей увеличивается, это связано с возрастом женщин, применением вспомогательных репродуктивных технологий.
Нагрузка на здравоохранение при ведении беременности с двумя и более плодами резко возрастает.
Для оценки прогноза беременности и потомства и генетику, и акушеру-гинекологу необходимо разбираться в зиготности и хориальности. Известно, что дизиготные двойни всегда дихориальные, диамниотические, а монозиготные бывают разные (см. рисунок):
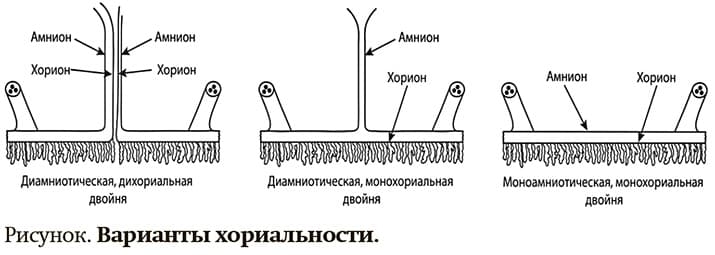
- могозиготные двойни, которые поделились очень рано, в первые 3 дня (это примерно треть всех двоен), будут иметь 2 плаценты, 2 мешка; они дихориальные, диамниотические;
- монохориальные, диамниотические (70–75 %) — деление происходит на 4–8-й день;
- монохориальные, моноамниотические (1–2 %) — 8–14-й день;
- неразделившаяся двойня — после 14-го дня.
Сложные диагностические ситуации при монозиготном многоплодии могут касаться дискордантности по хромосомным или моногенным заболеваниям (хотя в монозиготной двойне близнецы должны иметь одинаковый хромосомный статус). Также предполагается, что в подавляющем большинстве случаев при монозиготной двойне близнецы не будут совпадать по мультифакториальным заболеваниям: один будет, к примеру, иметь порок сердца, а второй будет здоров.
Сюда же следует отнести и тройни с монохориальным типом плацентации: фето-фетальным трансфузионным синдромом (ФФТС) и синдромом обратной артериальной перфузии (СОАП).
Клинический случай № 2
Монозиготная монохориальная диамниотическая двойня, дискордантная по синдрому Дауна.
Женщина 24 года, первая беременность (желанная), анамнез не отягощен. КТР первого плода 65,8 мм, ТВП (NT) 4,6 мм, КТР второго плода 63,5 мм, ТВП 1,1 мм. Пациентке выставлены риски по хромосомным заболеваниям, риск по ФФТС оценивается в 15–20 %.
17 недель. Диагностируется ФФТС 1-й степени. Пациентка отправлена для консультации по поводу фетоскопической лазерной коагуляции анастомозов.
Контрольное УЗИ через неделю. Задние рога боковых желудочков у плода-реципиента 5,5 мм, у донора 11 мм. Последнему выставляется диагноз «вентрикуломегалия», что не очень характерно для ФФТС.
24 недели 4 дня. Двойня МХДА, вентрикуломегалия у плода-донора сохранялась (задние рога боковых желудочков 10,5 мм). Установлена незначительная гипертрофия правого желудочка сердца у реципиента, что расценено как остаточное проявление ФФТС.
Плод-донор отстает, у плода-реципиента признаки перегрузки сердца. От прерывания беременности пациентка неоднократно отказывалась.
Беременность завершилась родами в 33 недели новорожденными мальчиками массой 1 789 и 2 080 г. Один из новорожденных (с меньшей массой, донор) имел фенотипические признаки синдрома Дауна (СД). У этого ребенка с клиническими проявлениями СД установлен мозаицизм с 20 % аномального клона: 47,XY,+21[12]/46, XY[88].
Второй мальчик не имеет клинических проявлений СД, тем не менее в лимфоцитах периферической крови у него также обнаружен клон клеток +21, примерно такой же по составу: 47,XY,+21[14]/46, XY[86].
Гипотеза 1: деление мозаичной анеуплоидной зиготы и рождение двух детей с истинным мозаичным вариантом СД.
Гипотеза 2: зигота была эуплоидной, деление произошло с 3-х по 8-е сутки, и в последующем в одном из разделившихся эмбрионов возник клон клеток с трисомным кариотипом в результате нерасхождения хромосом.
В подтверждение гипотезы необходимо было взять клетки из ткани другого происхождения — буккальный эпителий. У плода с клиническими проявлениями СД в 78 % интерфазных ядер установлена трисомия 21. У второго плода (реципиента) трисомия 21 не обнаружена.
Вывод: единственная зигота действительно изначально была эуплоидной. В последующем в одном из разделившихся эмбрионов возник клон клеток с трисомным кариотипом по 21-й хромосоме (плод-донор). Плод-реципиент в результате ФФТС стал близнецовой химерой. Ожидается, что через 12–14 месяцев в крови ребенка-реципиента клон трисомных клеток не будет определяться.
Клинический случай № 1
Пациентка 40 лет была направлена на консультацию в РНПЦ «Мать и дитя» для проведения комбинированного скрининга 1-го триместра. Дихориальная диамниотическая двойня, генерализованная водянка одного из плодов.
В ходе УЗ-осмотра четко определялись два хориона, расположенные раздельно по передней и по задней стенке матки. Лямбда-признак положительный. Копчико-теменной размер (КТР) первого плода 61,4 мм, толщина воротникового пространства (ТВП, NT) 7,9 мм; КТР второго плода 58,0 мм, ТВП 0,8 мм, гигрома шеи.
Поскольку пациентка относится к старшей возрастной группе и имеет повышенный риск по дизиготной двойне, то предположили, что двойня дизиготная, один из плодов имеет хромосомное заболевание, второй плод здоров. Пациентке предложено провести биопсию ворсин хориона, установить хромосомный диагноз, выработать тактику ведения и, возможно, пройти процедуру селективной редукции. Или сразу выполнить селективную редукцию, чтобы уменьшить акушерскую интервенцию, и затем провести кариотипирование.
Женщина выбрала второй вариант. По кариотипированию амниотических вод у плода установлен кариотип +18 хромосома, синдром Эдвардса. Проведено генетическое консультирование в контексте версии о том, что это дизиготная двойня. Пациентке в связи с возрастом предложен амниоцентез второго плода, однако она отказалась.
На УЗИ в 20 недель у развивающегося плода установлена киста сосудистого сплетения и специфическое расположение (типичное для синдрома Эдвардса) пальцев рук, когда второй палец перекрывает третий и согнут в первом фаланговом суставе.
На повторном консультировании женщине настоятельно рекомендовано проведение амниоцентеза. Процедура выполнялась тщательно тем же врачом, который перед этим проводил селективную редукцию плода. Пункция забора амниоцитов осуществлялась максимально далеко от амниотического мешка редуцированного плода, который хорошо визуализировался.
При молекулярно-генетическом исследовании методом КФ-ПЦР у плода выявлено количественное изменение 18-й хромосомы (вероятно, мозаичная форма синдрома Эдвардса). Пол плода — мужской. 47,XY,+18[34]/46, XY[66].
Гипотеза 1: несмотря на тщательность проведения амниоцентеза, произошла контаминация образца клетками первого плода.
Гипотеза 2: плод является близнецовой химерой.
Гипотеза 3: зигота была анеуплоидной по 18-й хромосоме, деление произошло рано, в течение первых 3-х суток, и в последующем в одном из разделившихся эмбрионов возник клон клеток с нормальным кариотипом в результате анафазного отставания (компенсаторный механизм).
По итогам медико-генетического консультирования семья приняла решение о прерывании беременности, которое проведено на сроке 22 недели.
В результате молекулярно-генетического исследования по всем локусам установлен одинаковый генотип для образцов обоих плодов, что подтверждает их монозиготное происхождение.
Полномасштабное исследование биологического материала на наличие различных клонов клеток и сопоставление количества нормальных и аномальных клеток позволило сделать вывод, что первоначально зигота была анеуплоидной по 18-й хромосоме. За счет раннего деления сформировалась дихориальная диамниотическая монозиготная двойня. В последующем в одном из разделившихся эмбрионов возник клон клеток с нормальным кариотипом в результате анафазного отставания.
Оксана Прибушеня:
В практике акушеры-гинекологи и генетики часто сталкиваются с необходимостью выстраивать прогноз ведения беременности и прогноз потомства у женщин с моногенными заболеваниями. Мы предполагаем, что при монохориальной двойне при наличии моногенной патологии в семье оба плода будут иметь эту патологию. В большинстве случаев так и происходит, но не всегда.
С другой стороны, если в семье есть моногенные патологии, то и при дизиготной двойне, учитывая очень высокие риски, и при доминантном наследовании, и при рецессивном оба плода также могут страдать тем или иным заболеванием. Особенно бдительными нужно быть акушерам-гинекологам в репродуктивной практике.
Следующие клинические наблюдения можно назвать работой над ошибками, когда акушеры- гинекологи не полностью осо- знавали генетическую патологию и тактика ведения беременности была не совсем верной.
Клинический случай № 3
Молодая семья, женщина страдает первичным бесплодием. Были две неуспешные попытки ЭКО. Затем при следующей попытке выполнен перенос двух эмбрионов. У матери пациентки неврологическое заболевание (пациентка сообщила акушеру-гинекологу, что мать болеет СМА 3-го типа).
Нужно понимать, что мутации с тяжелым или легким проявлением в семье одинаковы. Скрининг в 1-м триместре особенностей не выявил, установлена ДХДА двойня, проведена консультация генетика. В ходе этой консультации снова оглашается диагноз матери пациентки, и врач-генетик назначает исследование ДНК супругов, которое показывает, что они оба являются гетерозиготными носителями делеции 7 и 8 экзонов гена SMN1.
Таким образом, плоды этой женщины имеют высокий риск по СМА — 25 %. На сроке 17 недель ей предлагается беременность прервать, получен отказ. Соглашается на амниоцентез в 18 недель. У одного плода установлено гомозиготное носительство делеции 7 экзона гена SMN1. В последующем выполняется процедура селективной редукции с использованием KCl (плацента обоих плодов расположена по передней стенке, и провести редукцию другим хирургическим методом не представлялось возможным).
Беременность завершилась рождением здорового ребенка.
Клинический случай № 4
ДХДА ДЗ двойня с агенезией почек (АR). Пациентка направлена на консультацию с 3-й беременностью после ЭКО. Первая беременность самопроизвольно завершилась родами. Ребенок с тяжелым аутизмом, причина не установлена.
Вторая беременность наступила в результате ЭКО и прервана в 19 недель в связи с выраженным маловодием. В патолого-анатомическом заключении, со слов женщины, — агенезия почек.
Третья беременность: в результате проведения криопротокола — дихориальная диамниотическая двойня. В 12 недель — двойня ДХДА, ретрохориальная гематома. Поскольку у женщины был собран подробный анамнез, рекомендованы повторный осмотр ребенка и повторная консультация в 17 недель.
17 недель. У одного плода резко выраженное маловодие, у второго нормальные воды. Однако у обоих плодов не визуализируется мочевой пузырь, поэтому высказано предположение об агенезии почек у обоих.
Почему у одного плода резко выраженное маловодие, а у второго воды нормальные? При визуализации плаценты обнаружены признаки хориоангиомы. Осложнением хориоангиомы является многоводие, поэтому высказано предположение, что хориоангиома компенсировала ожидаемое маловодие у плода с агенезией почек на каком-то этапе.
Беременность прервана. При патолого-анатомическом исследовании — изолированная агенезия почек. Учитывая 3 случая у женщины в ходе всех ее беременностей, предположили, что это аутосомно-рецессивный вариант наследования. Рекомендовано сделать геномное секвенирование с попыткой поиска мутации.
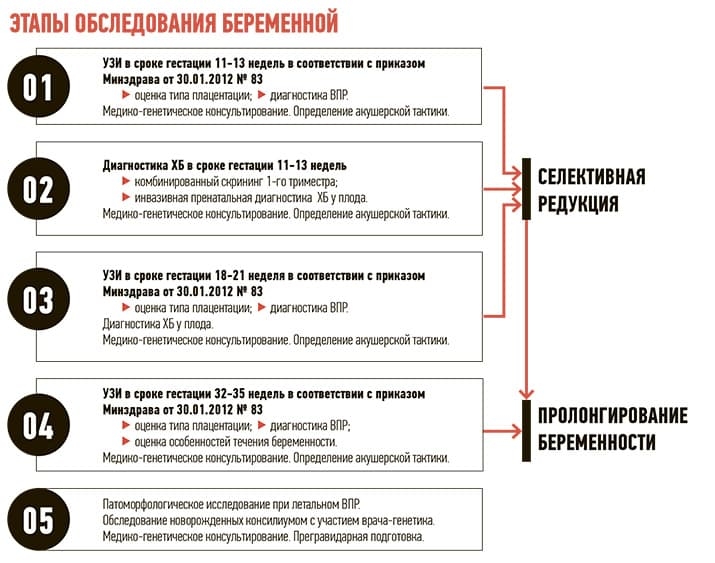
Еще одна достаточно частая генетическая составляющая акушерской практики — монохориальные трансфузии
Синдром обратной артериальной перфузии (СОАП) близнецов встречается с частотой 1:35 000 рождений. Среди МХ-двоен частота СОАП 1:100, среди МХ-троен 1:30.
Акушерские осложнения СОАП:
- резко выраженное много- водие,
- преждевременный разрыв плодных оболочек,
- преждевременные роды,
- антенатальная гибель плода-«помпы»,
- перинатальная смертность для здорового плода составляет 35–55 %.
Чаще всего у плода-«помпы» пуповина состоит из 3 сосудов, а у плода-акардиуса из 2 сосудов. Место впадения у них одинаковое: все 5 сосудов могут впадать в одно место либо пуповина плода-акардиуса может впадать в пуповину плода-«помпы».
Особую сложность вызывают случаи диагностики подобного состояния при тройнях.
Чтобы спрогнозировать ведение беременности, нужно понимать, что при монохориальной плацентации 20 % беременностей закончатся неблагополучно вследствие совокупности вышеупомянутых пороков развития, а при дихориальной двойне этот показатель достигает 7,7 %.