Лимфатические мальформации представляют собой врожденные сосудистые пороки развития, связанные с нарушением формирования лимфатической системы в эмбриональном периоде. Эти аномалии не являются злокачественными опухолевыми процессами и классифицируются согласно Международной классификации сосудистых аномалий (ISSVA) как простые сосудистые мальформации.
 Иван АвгустиновичСовременное лечение основывается на мультидисциплинарном подходе, включающем медикаментозную терапию, интервенционные процедуры и хирургическое вмешательство. Выбор метода зависит от морфологии поражения, клинической симптоматики, возраста пациента и распространенности процесса.
Иван АвгустиновичСовременное лечение основывается на мультидисциплинарном подходе, включающем медикаментозную терапию, интервенционные процедуры и хирургическое вмешательство. Выбор метода зависит от морфологии поражения, клинической симптоматики, возраста пациента и распространенности процесса.
Классификация и патогенез
Лимфатические мальформации (ЛМ) могут локализоваться в любой анатомической области, содержащей лимфатические сосуды. Они подразделяются на макрокистозные, микрокистозные, смешанные формы (см. рис. 1), а также генерализованные лимфатические аномалии, канальный тип, капошиформный лимфангиоматоз и формы, связанные с болезнью Горхема — Стаута. Основной патогенетический механизм связан с нарушением лимфангиогенеза вследствие мутаций генов, регулирующих развитие сосудистой системы. Особенно значима роль мутаций гена PIK3CA, участвующего в PI3K/AKT/mTOR сигнальном каскаде, а также VEGFR3, FOXC2, CCBE1 и других.
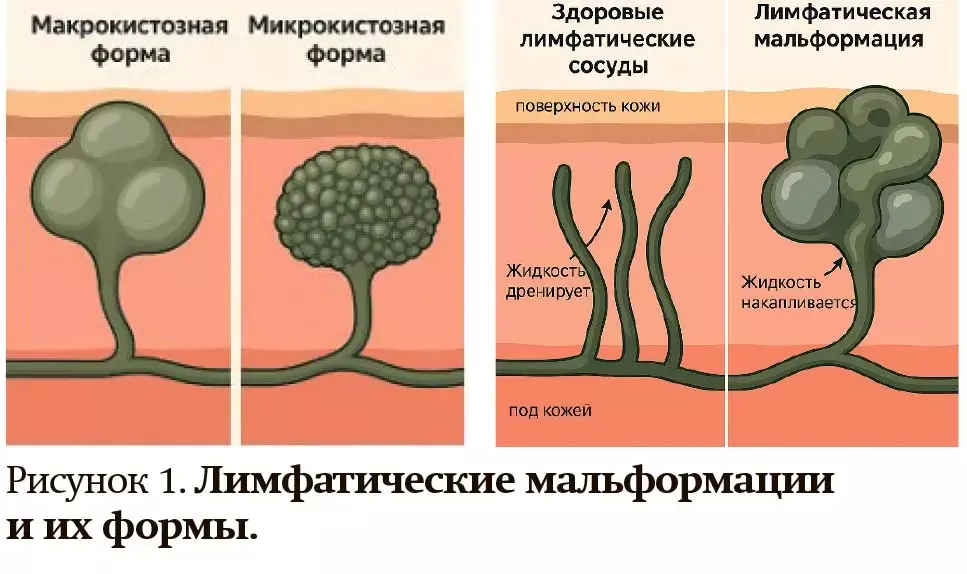
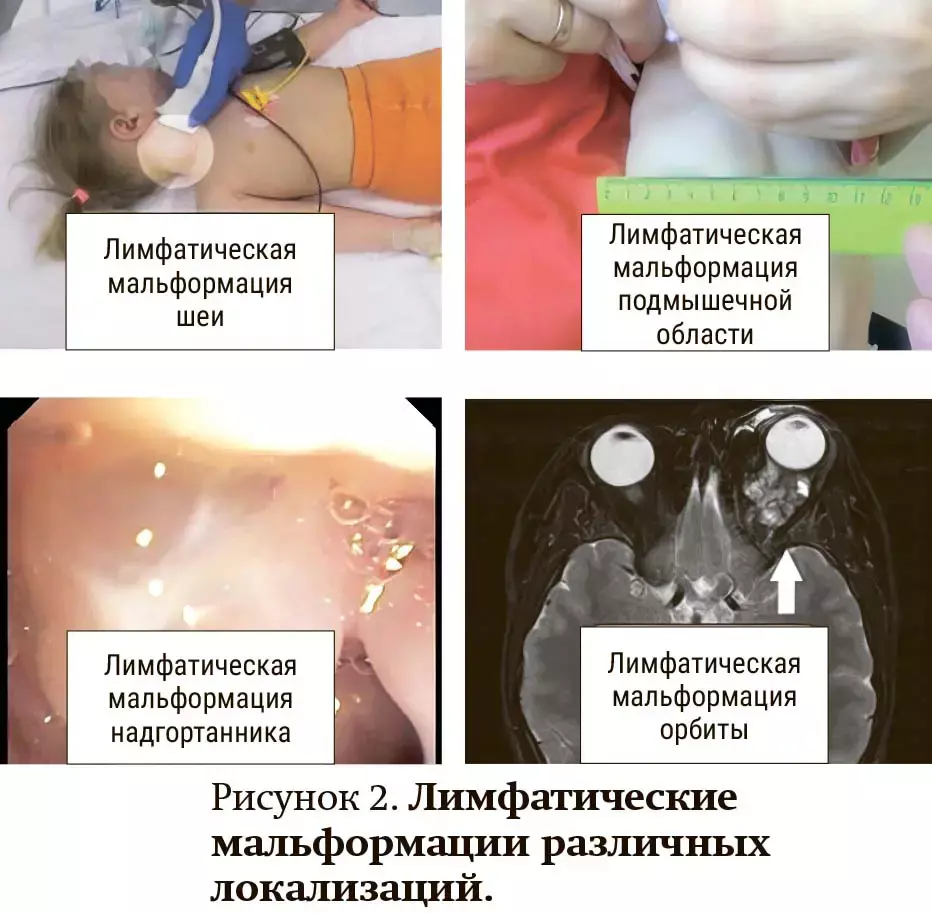
Наиболее частые локализации лимфатических мальформаций (см. рис. 2):
- голова и шея (подчелюстная, околоушная и шейная области) — 50–75 %;
- туловище (грудная клетка, спина, живот) — около 27 %;
- конечности (чаще нижние) — около 24 %;
- язык и ротовая полость — часто при микрокистозной форме.
Описаны редкие локализации в средостении, мошонке и оболочках яичка, казуистически редкие случаи в матке, поджелудочной железе, сердце.
Исторические аспекты диагностики и лечения
Подкожные и глубоколежащие образования лимфатического характера в прошлом интерпретировались как опухоли. В анатомической номенклатуре использовались термины «лимфангиома», «гигрома», «водяная опухоль», а методами лечения были прижигание, вскрытие, кровопускание, заполнение полости мальформаций карболовой кислотой. В 1982 году впервые было предложено разделить сосудистые аномалии на опухоли и мальформации, что стало основой для последующего создания ISSVA-классификации.
Основным методом лечения до середины 20-го века являлась хирургия. Радикальное иссечение патологических тканей практиковалось даже при локализации мальформации в области шеи, лица, средостения и иных анатомически сложных зонах. Операции часто сопровождались кровотечением, повреждением нервов, лимфостазом и рецидивами, в отдельных случаях отмечалась спонтанная регрессия макрокистозных мальформаций, предположительно за счет клапанного механизма внутри кист.
В поиске альтернатив хирургическому лечению начали применяться склерозирующие вещества, способные вызывать асептическое воспаление и фиброз внутри кистозных полостей. Одним из наиболее доступных являлся этанол, который вводился в кистозные образования. Несмотря на эффективность, такое лечение сопровождалось выраженной болью, некрозом тканей, риском системной токсичности.
В 1960–1970-х годах в склерозирующей терапии использовались препараты с иммуномодулирующими, цитостатическими свойствами. Например, пицибанил (ОК-432) показал высокую эффективность при макрокистозных формах, особенно у детей, продолжает применяться во многих странах мира. Блеомицин также продолжают применять в лечении низкопоточных мальформаций. В 1990-х в США для склерозирования лимфатических мальформаций был адаптирован антибиотик широкого спектра группы тетрациклинов — доксициклин. Под контролем ультразвука препарат вводится в кистозные полости, вызывая асептическое воспаление и последующий фиброз. Особенно эффективным доксициклин оказался при макрокистозных формах, а также в лечении костных аневризмальных кист.
Однако склерозанты, эффективные при макрокистозных формах, плохо работают при диффузных, глубоких и висцеральных поражениях. Хирургическое лечение в таких случаях тоже имеет свои недостатки, особенно при генерализованных формах, — рецидивы, деформации, повреждение жизненных органов.
Системная фармакотерапия
В начале 2010-х годов были выявлены соматические мутации гена PIK3CA, активирующие путь PI3K/AKT/mTOR, который регулирует рост лимфатических сосудов. Это позволило рассматривать ЛМ как молекулярно-обусловленные заболевания, а не просто анатомические пороки. Появился термин PROS (PIK3CA-Related Overgrowth Spectrum), объединяющий CLOVES, синдром Протея и другие формы сосудистых мальформаций.
Результатом накопленного клинического опыта, генетических открытий и ограничений традиционных методов лечения лимфатических мальформаций стал переход к системной фармакотерапии. Один из первых препаратов — силденафил (ингибитор фосфодиэстеразы типа 5) — изначально был разработан для лечения стенокардии и легочной гипертензии. При введении его детям с врожденными пороками сердца был отмечен еще один эффект: улучшение лимфодренажа и снижение продукции лимфы, что стало основой для экспериментального off-label применения при генерализованных лимфатических мальформациях. Сиролимус (ингибитор сигнального пути mTOR) изначально использовался в трансплантологии, с 2010 года применяется при рефрактерных сосудистых мальформациях, включая лимфатические. Алпелисиб (селективный ингибитор PI3K-α) разрабатывался для таргетной терапии в онкологии. В 2022 году одобрен FDA для лечения PROS-синдромов у детей старше двух лет и взрослых.
Современные алгоритмы ведения пациентов
В настоящее время в международной практике лечения лимфатических мальформаций у детей применяется комплексный мультидисциплинарный подход, включающий участие специалистов в области детской хирургии, интервенционной радиологии, онкологии и т. д.
Лимфатические мальформации представляют собой доброкачественные сосудистые аномалии, не обладающие признаками малигнизации. В связи с этим активное лечение не является обязательным во всех случаях. При наличии малых по размеру или клинически бессимптомных очагов допустима динамическая тактика наблюдения, особенно при отсутствии функциональных или косметических нарушений.
Склеротерапия является предпочтительным методом при макрокистозных формах (по данным мультицентровых исследований, в 92,9 % случаев достигается полный регресс) и может быть частью комбинированной терапии при более сложных формах. Микрокистозные менее чувствительны: эффективность монотерапии блеомицином составляет около 35,1 %, однако комбинированные подходы (например, с хирургией) повышают результативность до 70,3 %.
Преимущества склеротерапии: низкая инвазивность, возможность многократного применения, благоприятный профиль безопасности, особенно при ультразвуковом или флюороскопическом контроле. Основные ограничения: сниженная эффективность при микрокистозных и смешанных формах, необходимость повторных процедур для достижения стойкого эффекта.
Хирургическое лечение лимфатических мальформаций сохраняет клиническую значимость, особенно в случаях неэффективности консервативной терапии или при наличии жизнеугрожающих состояний. Но данный метод характеризуется рядом ограничений, обусловленных его высокой инвазивностью и технической сложностью. Хирургическое вмешательство требует проведения общей анестезии, наличия полноценной операционной, условий для послеоперационного мониторинга в отделении интенсивной терапии, а также участия мультидисциплинарной команды специалистов. В отличие от склеротерапии, которая может выполняться в амбулаторных условиях, хирургия сопряжена с повышенным риском интра- и послеоперационных осложнений, включая массивную кровопотерю, лимфорею и ятрогенное повреждение нервных структур. Может приводить к неблагоприятным косметическим последствиям, таким как формирование послеоперационных рубцов и деформаций, особенно при вмешательствах в области лица и шеи.
Хирургическое лечение уступает по эффективности склеротерапии: данные из ретроспективных исследований и клинических обзоров подтверждают, что рецидивы после хирургического лечения сосудистых мальформаций (особенно венозных и лимфатических) могут достигать 40–60 %.
Показания к хирургическому вмешательству:
- наличие крупных или прогрессирующих мальформаций, вызывающих компрессию жизненно важных структур (дыхательных путей, сосудов, нервов);
- рецидивирующие инфекции или воспаления в области мальформации;
- кровотечения, не поддающиеся консервативному контролю;
- неэффективность или невозможность проведения склеротерапии;
- выраженные косметические или функциональные дефекты, влияющие на качество жизни пациента.
Медикаментозное лечение сосудистых мальформаций рассматривается как самостоятельный или вспомогательный метод в следующих случаях:
1. Обширные или множественные поражения. Наличие диффузных или мультифокальных мальформаций, особенно в рамках сосудистых синдромов (например, синдром Клиппеля — Треноне), когда локальные методы (склеротерапия, хирургия) технически невозможны или недостаточно эффективны.
2. Инфильтративный тип роста. Мальформации, распространяющиеся на глубокие анатомические структуры (мышцы, фасции, органы), при которых радикальное удаление сопряжено с высоким риском функциональных нарушений.
3. Рецидивирующее течение. Повторное прогрессирование мальформации после хирургического или склеротерапевтического вмешательства, особенно при наличии воспалительных компонентов или лимфореи.
4. Симптоматическое ведение. Контроль хронической боли, отека, воспаления, лимфангита, а также профилактика вторичных инфекций. Особенно актуально при лимфатических мальформациях с выраженным экссудативным компонентом.
5. Предоперационная подготовка. Снижение объема поражения перед планируемым хирургическим вмешательством или склеротерапией с целью минимизации интраоперационных рисков.
6. Наличие противопоказаний к инвазивному лечению. Пациенты с тяжелой сопутствующей патологией, невозможностью проведения наркоза либо отказом от хирургического вмешательства.
7. Таргетная терапия при специфических формах. Применение ингибиторов mTOR (например сиролимуса) показало эффективность при сложных венозных и лимфатических мальформациях, особенно у детей. Препарат способствует снижению объема поражения, уменьшению воспаления и улучшению качества жизни.
Преимущества медикаментозной терапии: высокая клиническая эффективность, в т. ч. при генерализованных и рефрактерных формах; подавление лимфангиогенеза через ингибирование mTOR-пути; хорошая переносимость при соблюдении дозировочного режима и мониторинга. Недостатки: иммуносупрессивное действие, повышение риска инфекций; побочные эффекты (стоматит, гиперлипидемия, гематологические нарушения); необходимость регулярного лабораторного контроля (уровень препарата, функции печени, липидный профиль).
Эффективность медикаментозной терапии подтверждена в многоцентровых исследованиях и клинических рекомендациях. У 80–90 % пациентов наблюдается уменьшение симптомов и стабилизация роста мальформации. Частичная регрессия достигается в течение 6–12 месяцев терапии (уменьшение размеров на ~50 %).
Наиболее устойчивые результаты достигаются при комбинированном подходе, сочетающем фармакологическую модуляцию, локальное воздействие и хирургическую коррекцию. Такой алгоритм позволяет индивидуализировать терапию, минимизировать риски и повысить качество жизни пациентов.
Опыт РНПЦ ДОГИ в лечении лимфатических мальформаций
До 2010 года в Республике Беларусь лечение лимфатических мальформаций преимущественно основывалось на хирургических вмешательствах и склеротерапии с применением этилового спирта в качестве склерозирующего агента. Эти методы, несмотря на свою эффективность, были ограничены в применении при диффузных и генерализованных формах, а также сопровождались риском рецидива и развитием осложнений. В это же время в РНПЦ детской онкологии, гематологии и иммунологии был накоплен значительный опыт медикаментозной терапии различных сосудистых образований с использованием пропранолола, глюкокортикостероидов и α-интерферонов. Центр также демонстрировал успешные подходы к лечению сосудистых образований, осложненных синдромом Казабаха — Мерритт.
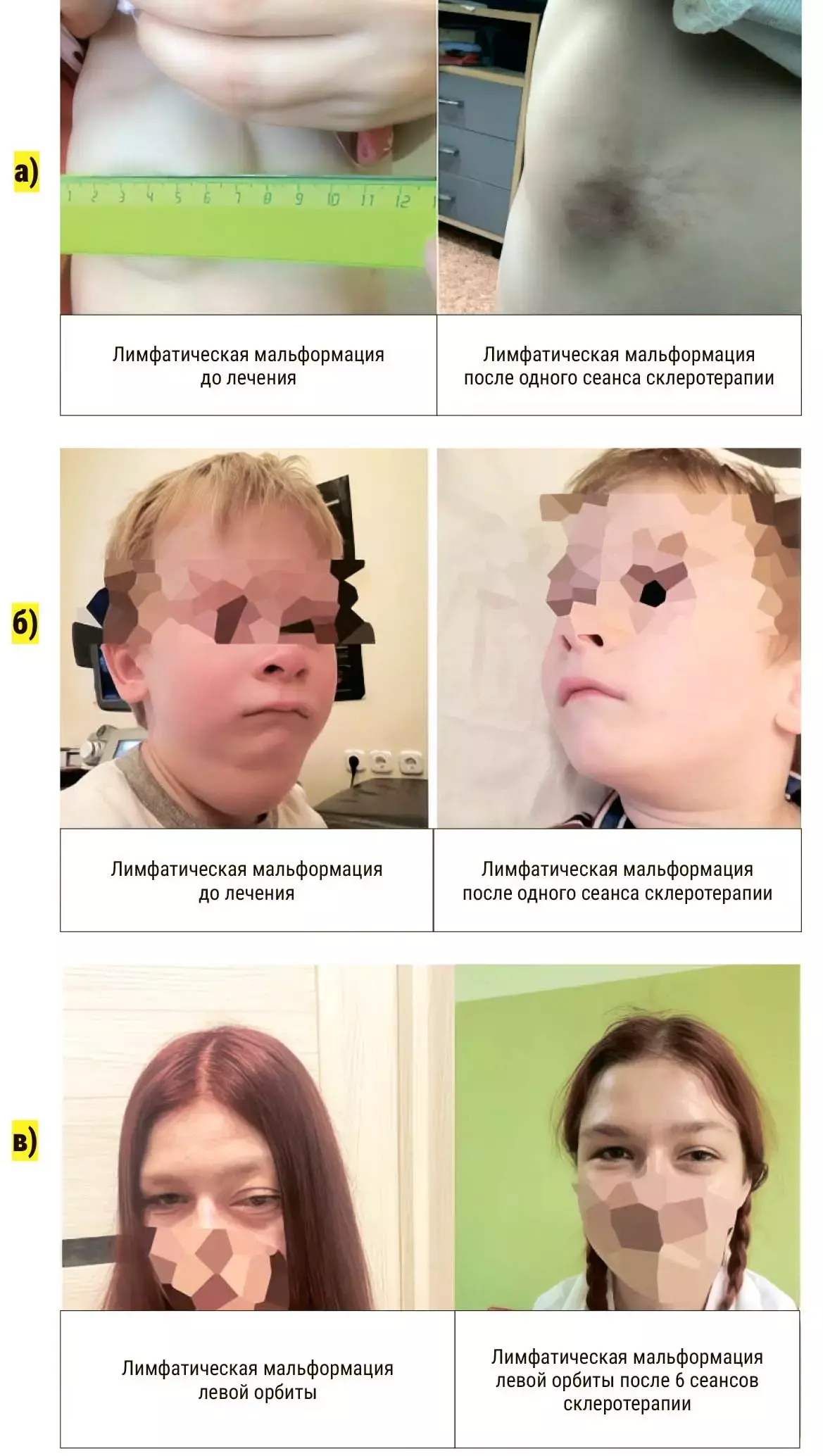 Следующим этапом стало внедрение склеротерапии препаратом пицибанил (OK-432). Клиническое применение показало его высокую эффективность и удовлетворительный профиль безопасности, особенно при макрокистозных формах. Помимо склеротерапии в клиническую практику был внедрен медикаментозный подход с использованием силденафила и ингибиторов mTOR (сиролимус, эверолимус). У всех пациентов отмечалось улучшение общего состояния, купирование болевого синдрома (при его наличии), прекращение экссудации, а также уменьшение размеров мальформации.
Следующим этапом стало внедрение склеротерапии препаратом пицибанил (OK-432). Клиническое применение показало его высокую эффективность и удовлетворительный профиль безопасности, особенно при макрокистозных формах. Помимо склеротерапии в клиническую практику был внедрен медикаментозный подход с использованием силденафила и ингибиторов mTOR (сиролимус, эверолимус). У всех пациентов отмечалось улучшение общего состояния, купирование болевого синдрома (при его наличии), прекращение экссудации, а также уменьшение размеров мальформации.
С целью расширения арсенала склерозирующих средств на базе РНПЦ ДОГИ была освоена методика склеротерапии с применением доксициклина и блеомицина. Указанные препараты демонстрируют благоприятный профиль эффективности и безопасности. По результатам ретроспективного анализа результатов лечения детей с лимфатическими мальформациями с использованием доксициклина и блеомицина совокупная клиническая эффективность терапии составила 96,12 % (см. рис. 3).
Параллельно центром была инициирована работа по упорядочиванию маршрутизации пациентов с лимфатическими мальформациями между учреждениями здравоохранения Беларуси. Указанная инициатива определена в изменениях и дополнениях к приказу Минздрава от 12.06.2015 № 635 об утверждении Инструкции о порядке оказания медицинской помощи детям с лимфангиомами.
Таким образом, эволюция подходов к лечению лимфатических мальформаций в Республике Беларусь отражает переход от инвазивных и ограниченно эффективных к более безопасным и клинически обоснованным стратегиям, основанным на медикаментозной терапии и современной склеротерапии.
