При выполнении патогистологического исследования при диагностике заболеваний кожи, мягких тканей, слизистой оболочки полости рта и аногенитальной зоны нередко возникают вопросы: что это такое? кто и как должен выполнить забор биопсийного материала? как правильно фиксировать и маркировать этот материал, оформить направление? Но обо всем по-порядку.
Что такое патогистологическое исследование?
 Патогистологическое исследование (прижизненное патологоанатомическое исследование, биопсия) — золотой стандарт в диагностике большинства опухолевых, предопухолевых и неопухолевых заболеваний.
Патогистологическое исследование (прижизненное патологоанатомическое исследование, биопсия) — золотой стандарт в диагностике большинства опухолевых, предопухолевых и неопухолевых заболеваний.
Биопсия позволяет ответить на целый ряд ключевых вопросов, в частности:
- установить окончательный диагноз;
- провести дифференциальную диагностику различных нозологических форм в сложных клинических наблюдениях;
- определить прогноз/стадию/глубину патологического процесса в случаях злокачественных новообразований или предопухолевых состояний;
- обосновать назначение специфической терапии конкретному пациенту (персонифицированный подход в лечении);
- оценить эффективность проведенного лечения;
- улучшить понимание механизмов патогенеза различных заболеваний при проведении научных исследований.
Биопсия — диагностический метод получения адекватного, репрезентативного биологического материала для последующего патогистологического исследования. Технические ошибки на различных его этапах могут привести к трудностям в интерпретации патогистологических изменений в биоптате.
Общие показания для выполнения патогистологического исследования, вне зависимости от анатомо-топографической локализации патологического процесса, стереотипны и могут быть разделены на несколько групп.
Первая группа — подозрение на злокачественность. Клинически подозрительными являются следующие признаки патологического процесса: быстрый темп роста патологического очага; его контактная кровоточивость при минимальном воздействии; уплотнение патологического образования (сам очаг и ткани вокруг него плотные при пальпации); фиксация патологического очага, когда образование тесно спаяно с окружающими тканями; эритроплакия (патологический очаг имеет стойкий, персистирующий красный/красноватый цвет); изъязвление патологического образования (очаг поражения имеет фокусы изъязвления либо представлен непосредственно язвой); длительность патологического процесса, а именно его персистирование более 2 недель, не поддающееся местной терапии.
Вторая группа — патологические процессы, клинически проявляющиеся в виде лейкоплакии. Термин впервые применен в 1861 году Карлом Фрейхером, который использовал его для описания белых очагов в области слизистой мочевыводящих путей, а затем Эрнестом Швиммером в 1877-м для описания белого пятна слизистой оболочки полости рта.
В 1961 году многие исследования показали, что лейкоплакия может возникать на слизистых оболочках других локализаций: прямой кишки, влагалища, матки, вульвы, придаточных пазух носа, желчного пузыря, пищевода, барабанных перепонок, глотки и гортани.
Определение термина «лейкоплакия» подвергалось неоднократным изменениям, в настоящее время наиболее четким является принятое ВОЗ в 2005 году определение для лейкоплакии слизистой оболочки полости рта — «белые бляшки сомнительного риска, исключающие (другие) известные заболевания или расстройства, которые не несут повышенного риска развития рака». Морфологическим субстратом лейкоплакии является персистирующий гиперкератоз многослойного плоского ороговевающего эпителия или патологическое ороговение неороговевающего эпителия слизистых оболочек.
По сути лейкоплакия представляет собой описательный термин, клинически означающий наличие белого пятна/бляшки на слизистых оболочках различных локализаций, природа которого может быть абсолютно разной, включая воспалительные заболевания, реактивные и предопухолевые процессы, а также новообразования.
Таким образом, именно патолог может определить конкретную причину нарушенного ороговения слизистой. Клинический диагноз «лейкоплакия» правомочен, в отличие от патогистологического заключения, в котором данный диагноз не может быть использован в качестве окончательного.
Третья группа представлена клинически доброкачественными или реактивными процессами, вызывающими функциональные нарушения. В данном случае биопсия выполняется для верификации клинического диагноза и с целью хирургического лечения.
Четвертая группа показаний включает любые воспалительные процессы, которые не отвечают на местное лечение в течение 10–14 дней. К данной группе следует отнести также все иммунообусловленные заболевания (плоский лишай, красная волчанка, вульгарная пузырчатка, буллезный пемфигоид и др.).
Пятая группа — это появление новых или увеличение в размерах имеющихся пигментных образований.
Шестая группа — клинически и рентгенографически неясные костные образования.
Седьмая группа — любые патологические очаги неясной этиологии, персистирующие более 2 недель.
Восьмая группа — злокачественные новообразования.
Кто должен выполнять забор материала?
В Беларуси, как и во всем мире, данная манипуляция выполняется специалистом хирургического профиля, в частности онкологом, акушером-гинекологом, урологом, стоматологом-хирургом, однако на практике зачастую биопсийный материал забирается хирургом общего профиля. И здесь есть как свои плюсы, так и минусы. Остановлюсь на минусах, поскольку они мало где обсуждаются.
Публикации в зарубежной литературе демонстрируют, что наиболее информативным является материал, взятый профильным специалистом (так же как и место биопсии, выбранное им, — наиболее оптимальное и репрезентативное для дальнейшей интерпретации морфологических изменений). Этому есть простое объяснение: узкий специалист имеет специализированные знания, умения и опыт, касающиеся профиля патологий, в отличие от общих хирургов, которые нередко выполняют биопсию без учета особенностей того или иного патологического процесса (в первую очередь когда речь идет о заболеваниях воспалительного генеза).
Все это указывает на необходимость тесного междисциплинарного взаимодействия между профильными специалистами с общими хирургами и патологоанатомами, что позволит решать вопросы с выбором оптимального места забора материала. Кроме того, данные аспекты должны быть четко определены клиническими протоколами для каждой конкретной нозологии.
Диагностическое значение имеют только правильно выполненные репрезентативные биопсии, с достаточным количеством материала для патогистологического исследования и исчерпывающими клиническими данными для морфолога.
Как правильно выполнить исследование?
Процесс патогистологического исследования состоит из ряда последовательных этапов, каждый из которых имеет важное значение и особенности выполнения. Основные этапы включают:
- выбор оптимального вида/техники биопсии;
- маркировка, транспортировка и документальное сопровождение направляемого на патогистологическое исследование материала;
- лабораторный этап обработки забранного материала и изготовление гистологических препаратов;
- патогистологическое исследование материала с учетом клинических данных;
- установление клинико-морфологического диагноза.
Существует много различных видов (техник) получения биопсийного материала, каждый из которых имеет свои особенности исходя из предполагаемого диагноза, предпочтения в зависимости от анатомо-топографической локализации патологического процесса, а также свои достоинства и недостатки. Остановлюсь на наиболее широко используемых техниках.
Выбор вида (техники) биопсии для получения репрезентативного материала определяется многими факторами, например, характером клинических проявлений: «цветные» (белые/красные) патологические очаги требуют достаточной глубины биоптата; при полиморфной картине необходимы множественные биопсии из разных очагов.
При выполнении биопсии всегда следует строго соблюдать следующие обязательные условия:
- взятие материала до начала местной и/или системной терапии либо на фоне ее отмены в течение 2–4 недель;
- минимизация косметических и функциональных дефектов;
- минимизация артифициальных изменений биопсийного материала — механическое сдавление, электрокаутеризационные повреждения и др.
Вне зависимости от выбора техники биопсии имеет значение правильное выполнение анестезии.
Категорически запрещено проводить анестезию непосредственно в очаг поражения! Это часто приводит к таким артифициальным изменениям в материале, как кровоизлияния или вакуолизация клеток, что значительно затрудняет интерпретацию гистологической картины. Рекомендовано использовать следующую тактику: под неизмененную ткань на расстоянии 3–5 мм до элемента поражения на глубину 2–3 мм проводится инфильтрационная анестезия вдоль патологического очага либо выполняется 4-точечная анестезия вокруг биопсируемого объекта с последующим его иссечением.
Эксцизионная (тотальная) биопсия — полное удаление очага поражения с захватом окружающей интактной ткани, при этом эксцизия в пределах здоровых тканей не должна приводить к различным увечьям. Отступ от очага поражения определяется его предполагаемым характером и составляет от 2 до 10 мм (в среднем 3–5 мм). Биоптат имеет форму эллипса с углами между разрезами 30°, в центре которого находится патологический очаг (см. рис. 1).
Рисунок 1. Эксцизионная биопсия.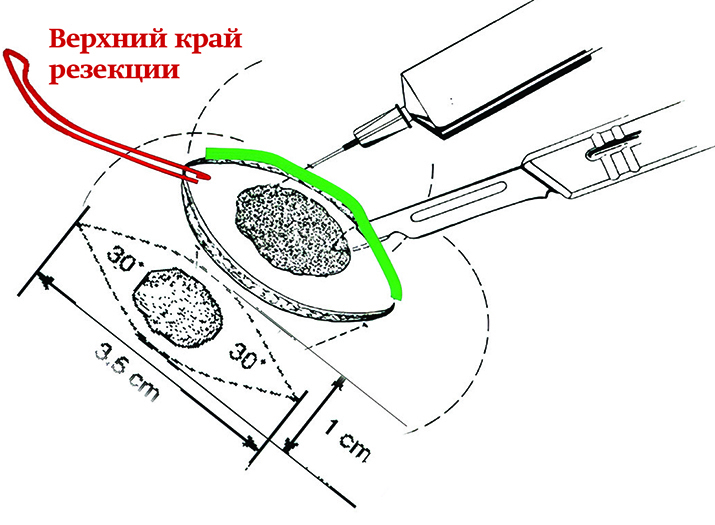 Хирург всегда должен выполнять анатомо-топографическую ориентацию и маркировку эксцизионного биоптата, например, прошивать нитью либо окрашивать специализированными (несмываемыми при фиксации в формалине) красками какой-либо край резекции и данную информацию фиксировать в направлении на патогистологическое исследование.
Хирург всегда должен выполнять анатомо-топографическую ориентацию и маркировку эксцизионного биоптата, например, прошивать нитью либо окрашивать специализированными (несмываемыми при фиксации в формалине) красками какой-либо край резекции и данную информацию фиксировать в направлении на патогистологическое исследование.
Маркировка материала позволяет более точно и детально определить характер роста и распространения патологического процесса по отношению к конкретным анатомо-топографическим зонам и, особенно в случаях злокачественного новообразования, более предметно определить тактику дальнейшего лечения пациента. Данная техника носит не только диагностический, но и лечебный характер.
Инцизионная (неполная) биопсия — иссечение части/фрагмента патологического очага через его центр с захватом прилежащей интактной ткани. Биоптат также имеет форму эллипса с углами между разрезами 30°, соотношение длины биоптата к его ширине равно 3:1, при этом 2/3 биоптата составляет патологический очаг, а 1/3 — здоровая ткань (см. рис. 2).
Рисунок 2. Инцизионная биопсия.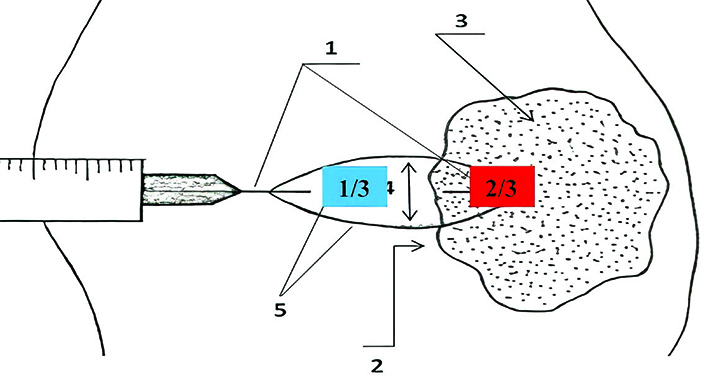 Хирург должен маркировать зону интактной части инцизионного биоптата вышеописанным образом.
Хирург должен маркировать зону интактной части инцизионного биоптата вышеописанным образом.
К преимуществам данной техники можно отнести возможность выполнения множественных биопсий, когда патологический процесс имеет распространенный характер с вовлечением различных областей либо когда имеются очаги с разной макроскопической картиной, а также позволяет получить глубокие и «узкие» биоптаты.
Панч-биопсия — взятие биопсийного материала специальным одноразовым панчем (есть разного диаметра — от 2 до 10 мм) и получение диска ткани, глубина которого может регулироваться с последующим его отсечением от подлежащих тканей ножницами.
Это исключает использование щипцов и минимизирует артифициальные повреждения материала от механического сдавления. Данная техника рекомендуется для биопсий кожи, слизистых оболочек полости рта и аногенитальной зоны, в первую очередь при воспалительных заболеваниях (см. рис. 3).
Рисунок 3. Панч-биопсия. К преимуществам данного вида получения биопсийного материала следует отнести простоту техники, возможность не накладывать швы при небольших биоптатах и выполнение множественных биопсий. Однако панч-биопсии не рекомендуется выполнять в интенсивно васкуляризированных и иннервированных зонах. Так же сложно выполнить их в местах, где слизистая слишком подвижна (например, мягкое небо, дно полости рта).
К преимуществам данного вида получения биопсийного материала следует отнести простоту техники, возможность не накладывать швы при небольших биоптатах и выполнение множественных биопсий. Однако панч-биопсии не рекомендуется выполнять в интенсивно васкуляризированных и иннервированных зонах. Так же сложно выполнить их в местах, где слизистая слишком подвижна (например, мягкое небо, дно полости рта).
Наименее приемлемая техника получения биопсийного материала — петлевая (электрохирургическая) биопсия, которая широко используется у нас в стране, например, при биопсиях вульвы. Полученный таким образом материал, как правило, очень мелкий и с выраженными электрокоагуляторными артифициальными изменениями, что делает биоптат абсолютно нерепрезентативным и неинформативным.
Альтернативой в подобных случаях является шовная (stitch-) биопсия — по сути это модификация бритвенной (shave-) биопсии, когда рассасывающейся нитью 3/0 или 4/0 прошивается место под очагом поражения, участок натягивается и отсекается ножницами под наложенным швом, что значительно минимизирует механическое сдавление материала щипцами и исключает электрокоагуляторные повреждения.
Важные нюансы
В случаях, когда патологический очаг представлен буллезным элементом, необходимо забирать пузырь целиком, если он мелкий, или на границе с интактной тканью, если он крупный. При этом поздно взятая биопсия из буллезных очагов может иметь эрозии или изъязвления, репаративные изменения, выраженное вторичное воспаление и колонизацию бактерий, что существенно затрудняет интерпретацию морфологических изменений процесса. Кроме того, лечение ГКС на момент взятия биопсии неизбежно ведет к лечебному патоморфозу гистологической картины.
При наличии эрозивно-язвенных поражений категорически запрещается брать материал из некротизированных участков, которые абсолютно неинформативны в плане определения нозологии патологического процесса. Необходимо выполнять биопсию строго на границе со здоровой тканью.
При пестрой (разнообразной) клинической картине патологического процесса должны выполняться множественные биопсии из разных очагов поражения с их четкой маркировкой и фиксированием данной информации в направлении на патогистологическое исследование. Только при выполнении данного условия патолог сможет оценить гистологические признаки в каждом очаге поражения и установить окончательный диагноз.
Как правильно фиксировать биопсийный материал?
Универсальный базовый метод фиксации, который стандартно используется в рутинной практике, — это 10 % раствор забуференного нейтрального формалина. Категорически запрещено использовать любые другие жидкости, которые имеются, например, в процедурных кабинетах, где выполняется забор материала (медицинский спирт, физраствор и др.). Важно соблюдать объем формалина к объему объекта.
Соотношение биоптат/формалин составляет 1:10–20. Фиксация осуществляется при комнатной температуре. Время фиксации также имеет существенное значение: оптимальное составляет 24 часа, допустимое — 48 часов.
Биопсийный материал должен погружаться в формалин в специализированные пластиковые емкости (контейнеры) с широким горлышком и плотно закрывающейся крышкой (см. рис. 4). Категорически запрещается использовать подручные емкости (стеклянные бутылочки от лекарственных препаратов с узким горлышком и др.).
Объяснение простое: фиксированный в формалине материал значительно уплотняется, и в последующем патологу очень сложно извлечь его из такой емкости, не повредив объект, приходится разбивать стекло. Что еще важно знать о фиксации? Фиксированный материал уменьшается в объеме, в среднем до 30–50 % от исходного, что влияет на размер биоптата при патогистологическом исследовании.
Что еще важно знать о фиксации? Фиксированный материал уменьшается в объеме, в среднем до 30–50 % от исходного, что влияет на размер биоптата при патогистологическом исследовании.
Нежелательно при мелких биоптатах и недостаточном количестве формалина заворачивать их в марлю, т. к. это приводит к механическому повреждению материала. Кроме того, мелкие биоптаты подвергаются пространственной деформации и скручиванию, что также затрудняет интерпретацию морфологических изменений.
Как маркируется биопсийный материал?
Немаловажным этапом патогистологического исследования является его правильная маркировка. Категорически нельзя помещать в одну емкость множественные биопсии одного пациента, выполненные из разных очагов и/или разных анатомических областей. В подобных случаях используются отдельные емкости для каждого биоптата, их характеристики (место забора, размеры и др.) строго фиксируются в направлении на патогистологическое исследование.
Категорически нельзя делить и направлять биопсийный материал одного пациента в разные патогистологические лаборатории либо в одну патогистологическую лабораторию, но в разное время.
Контейнеры с материалом должны быть четко маркированы нестираемым маркером и содержать всю необходимую информацию для его последующей регистрации и гистологической обработки (ФИО, возраст, № исследования).
Как оформить направление на патогистологическое исследование?
Один пациент — одно направление на патогистологическое исследование, вне зависимости от количества забранных объектов.
Обращаю внимание, что все графы, имеющиеся в бланке направления, должны быть строго заполнены. Направление должно содержать исчерпывающее количество клинической информации, которая важна патологу для установления окончательного диагноза. Приведу несколько примеров для обоснования важности этого этапа.
Так, возраст пациента может играть ключевую роль в принятии решения в пользу того или иного диагноза. При некоторых меланоцитарных образованиях со схожей морфологией у пациента в 5 месяцев жизни и 50 лет диагноз будет абсолютно разный: пигментный невус и меланома соответственно.
Место взятия биопсии — нередко мы сталкиваемся с кратким указанием, например, «кожа» или «слизистая», однако имеет значение конкретная анатомо-топографическая область. Патолог сравнивает выявленные изменения с нормой именно в этой зоне, а определить орган/ткань патологу не составляет труда. Кроме того, есть разница в гистологическом строении органа из различных анатомо-топографических областей, и, не зная конкретного места взятия материала, невозможно полноценно оценить характер выявленных патологических изменений.
Указание техники биопсии — как обсуждалось выше, эксцизионная и инцизионная биопсии имеют форму эллипса. Однако при изготовлении гистологических препаратов эксцизионная биопсия режется поперек с множественными серийными срезами для оценки в том числе краев резекции, глубины поражения, состояния интактной ткани. В свою очередь инцизионная биопсия режется вдоль, в первую очередь для возможности сравнения патологического очага с интактной тканью (см. рис. 5).
Рисунок 5. Эксцизионная биопсия 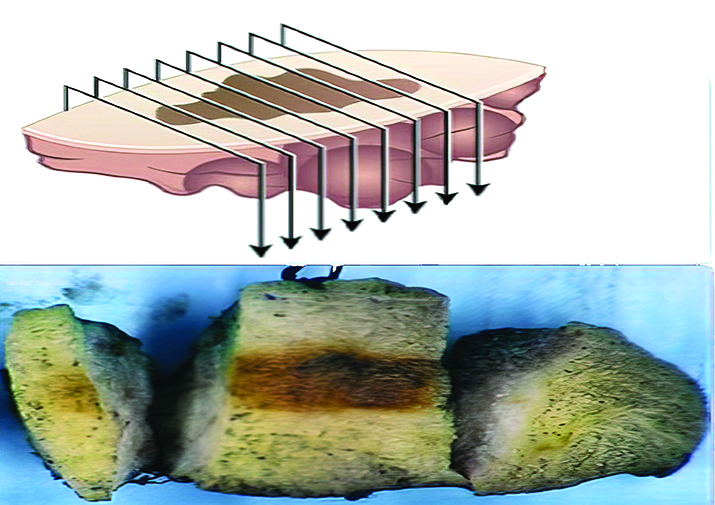 Инцизионная биопсия.
Инцизионная биопсия.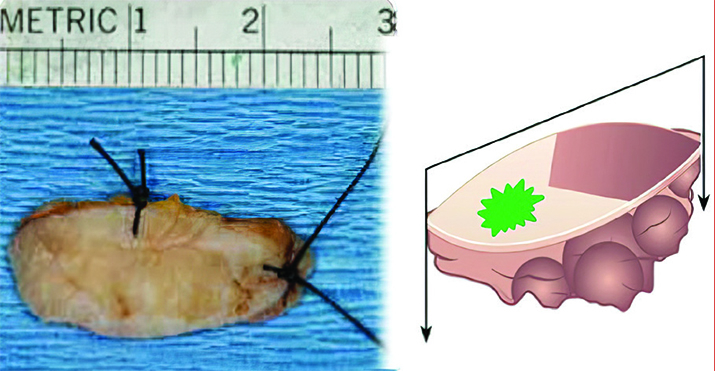 Таким образом, при неправильно выполненной маркировке присланного материала и без указания в направлении техники биопсии высока вероятность неправильной вырезки материала и, как следствие, трудностей в интерпретации морфологических изменений.
Таким образом, при неправильно выполненной маркировке присланного материала и без указания в направлении техники биопсии высока вероятность неправильной вырезки материала и, как следствие, трудностей в интерпретации морфологических изменений.
Макроскопическое описание очага поражения должно быть кратким и соответствовать общепринятой терминологии — пятно, папула, язва, объемное образование и т. д.; характер симптомов поражения — зуд, боль и т. д.; размер очага поражения (после фиксации размер уменьшается); цвет — гипер-/гипопигментирован, белый, красный и т. д.; консистенция — плотная, мягкая и т. д.; локализация — с использованием общепринятых анатомо-топографических терминов; состояние окружающих тканей; распространенность — какие другие анатомические области вовлечены.
Не менее важной является информация о проведенном/проводимом лечении — лечебный патоморфоз гистологической картины или ее стертость вследствие терапии должны учитываться патологом при интерпретации морфологических изменений. Также в направлении должен быть указан предполагаемый клинический диагноз с учетом МКБ действующего пересмотра.
Периодически в своей практике мы встречаем такие диагнозы, как «заболевание вульвы», «хронический дерматит» и т. д., что, конечно же, недопустимо. Кроме того, при наличии клинически дифференциальных диагнозов все они также должны быть указаны. При ряде патологических процессов оптимально представлять патологу фото патологического процесса, а также данные дополнительных лабораторных и/или инструментальных методов исследования.
На практике, к сожалению, в направлении часто отсутствует краткая информация об анамнезе и клинических проявлениях заболевания, а также о проводимом лечении.
Заключение патогистологического исследования также должно соответствовать определенным требованиям и включать:
- детальное микроскопическое описание патогистологической картины с учетом общепринятой терминологии;
- патогистологическое заключение — нозологический диагноз с учетом современных классификаций (допустимо описательное патогистологическое заключение в случаях, когда по объективным и обоснованным причинам установление нозологического диагноза на момент исследования невозможно);
- комментарии к патогистологическому заключению, подразумевающие под собой возможные дифференциальные диагнозы и/или дальнейшие рекомендации по тактике последующих патогистологических исследований (например, повторная биопсия и пр.).