Надпочечниковая недостаточность (НН) — редкая патология, которая регистрируется у 4–10 человек на 100 тысяч населения. Многообразие причин заболевания усложняет его диагностику, что имеет принципиальное значение в клинической практике. Даже олигосимптомные формы надпочечниковой недостаточности могут стать причиной надпочечникового криза и летального исхода, а широкое использование глюкокортикоидов является потенциальным триггером вторичной надпочечниковой недостаточности.
«Бронзовая болезнь»
 Татьяна МохортВ 1849 году британский терапевт Томас Аддисон впервые описал «бронзовую болезнь» — надпочечниковую недостаточность, характерным симптомом которой является изменение пигментации кожи, нередко приобретающей бронзовый или коричневый оттенок. В то время возможности лечить ее врачи не имели. Только в 1934 году швейцарский химик Тадеуш Райхштейн, переработав более тонны говяжьих надпочечников, выделил 25 г активного компонента, из которого получилось 7 г активного вещества — стероида, оказывающего влияние на водно-солевой баланс и обмен углеводов.
Татьяна МохортВ 1849 году британский терапевт Томас Аддисон впервые описал «бронзовую болезнь» — надпочечниковую недостаточность, характерным симптомом которой является изменение пигментации кожи, нередко приобретающей бронзовый или коричневый оттенок. В то время возможности лечить ее врачи не имели. Только в 1934 году швейцарский химик Тадеуш Райхштейн, переработав более тонны говяжьих надпочечников, выделил 25 г активного компонента, из которого получилось 7 г активного вещества — стероида, оказывающего влияние на водно-солевой баланс и обмен углеводов.
А тремя годами позже он синтезировал первый минералокортикоид — дезоксикортикостерон, который оказался полезным в лечении болезни Аддисона. Параллельно в 1935 году американский биохимик Эдуард Кендалл из коры надпочечников выделил кортикоиды (от лат. сortex — кора), влияющие на обмен углеводов и белков, и использовал их в эксперименте, повышая выносливость животных. Метод Райхштейна не годился для массового промышленного производства, и Кендалл предложил новый метод синтеза кортикостерона и кортизона, что положило начало их клиническому использованию.
В 1948 году американский профессор Филипп Хенч начал лечение аутоиммунных заболеваний кортикоидами. С тех пор с помощью глюкокортикоидов лечат не только надпочечниковую недостаточность, но и более 40 других заболеваний. В 1950 году Райхштейн, Кендалл и Хенч были удостоены Нобелевской премии по физиологии и медицине за открытие и внедрение глюкокортикоидов.
Повышенные риски
В настоящее время около 1 % населения постоянно используют глюкокортикоиды (ГК) в качестве противовоспалительных или иммунодепрессивных средств в супрафизиологических дозах. При этом подавление оси «гипоталамус — гипофиз — надпочечники» — неизбежный эффект хронической экзогенной терапии глюкокортикоидами, а восстановление функции надпочечников у разных людей сильно варьируется. Широкое использование этих стероидных гормонов и последствия такой терапии подтолкнули Европейское общество эндокринологов к разработке рекомендаций по диагностике и ведению надпочечниковой недостаточности, индуцированной ГК.
Отмечено, что применение даже низких доз глюкокортикоидов (преднизолон 2,5–7,5 мг/день) увеличивает риск сердечно-сосудистых заболеваний, тяжелых инфекций, артериальной гипертензии, сахарного диабета, остеопороза и переломов.
Ожидается, что воздействие глюкокортикоидов при пероральном приеме, представляющее риск надпочечниковой недостаточности, по крайней мере превысит оба следующих пороговых значения:
- продолжительность терапии — 3–4 недели или более;
- доза ГК терапии — любая доза, превышающая суточную дозу гидрокортизона, эквивалентную 15–25 мг (4–6 мг преднизолона, 3–5 мг метилпреднизолона, 0,25–0,5 мг дексаметазона).
Кроме того, риск заболевания повышается с увеличением массы тела и возрастом. При этом любой путь введения ГК может быть связан с повышенным риском.
Симптомы заболевания
Клинические проявления надпочечниковой недостаточности включают общее недомогание, утомляемость, тошноту, снижение массы тела, боли в мышцах и суставах, нарушения сна, изменение настроения. Распространены внешние кушингоидные признаки, особенно на ранних стадиях снижения дозы глюкокортикоидов. Указанные симптомы неспецифичны и могут совпадать с симптомами заболевания, при котором назначают такие препараты, и появиться в любой момент снижения уровня ГК, обычно при уменьшении дозировки преднизолона менее 15 мг/день. Может присутствовать гипергликемия, но уровни электролитов обычно не изменяются.
Гормональное тестирование не рекомендуется, так как уровни АКТГ и кортизола супрессированы и обычно не обнаруживаются. У пациентов с надпочечниковой недостаточностью, вызванной ГС, исходные состояния могут отсутствовать, но при воздействии потенциальных триггеров могут развиться симптомы — от легких до надпочечникового криза и рецидива основного заболевания. Признаки и симптомы НН могут совпадать с симптомами синдрома отмены глюкокортикоидов, который возникает в результате прекращения быстрой отмены терапии у пациентов, у которых развилась толерантность к супрафизиологическим уровням ГК.
В случаях, когда пациенты принимают дозы ГК, близкие к физиологическим, НН и синдром отмены ГК невозможно различить с полной точностью. При интерпретации симптоматики следует учитывать потерю веса из-за разрешения ятрогенного синдрома Кушинга.

Надпочечниковый криз
Важность распознавания НН, обусловленной приемом ГК, заключается не столько в ухудшении общесоматического состояния и качества жизни, сколько в повышении риска надпочечникового криза при воздействии стресса любой этиологии. Состояние острой недостаточности коры надпочечников является крайне опасным, угрожающим жизни пациента. Пусковым механизмом криза могут стать инфекции, включая желудочно-кишечные, мочеполовые, респираторные и сепсис, острое заболевание (включая лихорадку), физические травмы, хирургическое вмешательство или другие процедуры, требующие общей, регионарной или местной анестезии, кишечные процедуры, требующие слабительных средств/клизмы, стоматологические процедуры, физические нагрузки, сильный стресс и боль.
Надпочечниковый криз проявляется шоком, непропорциональным тяжести триггера, устойчивым к инотропным препаратам и жидкостной терапии без использования ГК. Характерно развитие гипотензии и хотя бы одного из следующих состояний: тошнота или рвота, сильная усталость, гипертермия, нарушение сознания (в т. ч. летаргия, спутанность сознания, сонливость, коллапс, делирий, кома и судороги). Лабораторные признаки включают наличие гипонатриемии (обычно с повышенным содержанием натрия в моче), гиперкалиемии, признаки снижения объема (например, повышение уровня мочевины и креатинина), гипогликемию, лимфоцитоз и эозинофилию.
С целью предупреждения развития надпочечниковой недостаточности и криза рекомендуется увеличение дозы гидрокортизона в 2–3 раза (пациентам, не принимающим ГК, но с высоким риском НН, назначается 40 мг гидрокортизона внутрь) и обильное питье при незначительном стрессе.
Интенсивность мероприятий увеличивается при возрастании тяжести общего состояния пациента. В случае больших хирургических операций с общей анестезией, травм, родов, заболеваний, при которых необходимо проведение интенсивной терапии, вводится гидрокортизон 100 мг в/в, затем 200 мг /сутки в виде непрерывной инфузии (или 50 мг в/м либо в/в каждые 6 часов) и проводится инфузия 5 % раствора глюкозы или 0,2 % или 0,45 % раствора хлорида натрия.
Режимы снижения дозы
Для предупреждения развития НН и криза важно соблюдать постепенность при планировании отмены глюкокортикоидов (см. табл. 2), так как плавное снижение дозы сопровождается активацией оси «гипоталамус — гипофиз — надпочечники». Следует помнить, что при использовании супрафизиологических доз глюкокортикоидов нецелесообразно распределение лекарственных средств в течение суток в соответствии с циркадным ритмом их секреции, так как прием ГК во второй половине дня усугубляет супрессию оси «гипоталамус — гипофиз — надпочечники» и функции надпочечников.
Таблица 2. Рекомендуемые режимы снижения дозы в зависимости от дозы глюкокортикоидов.
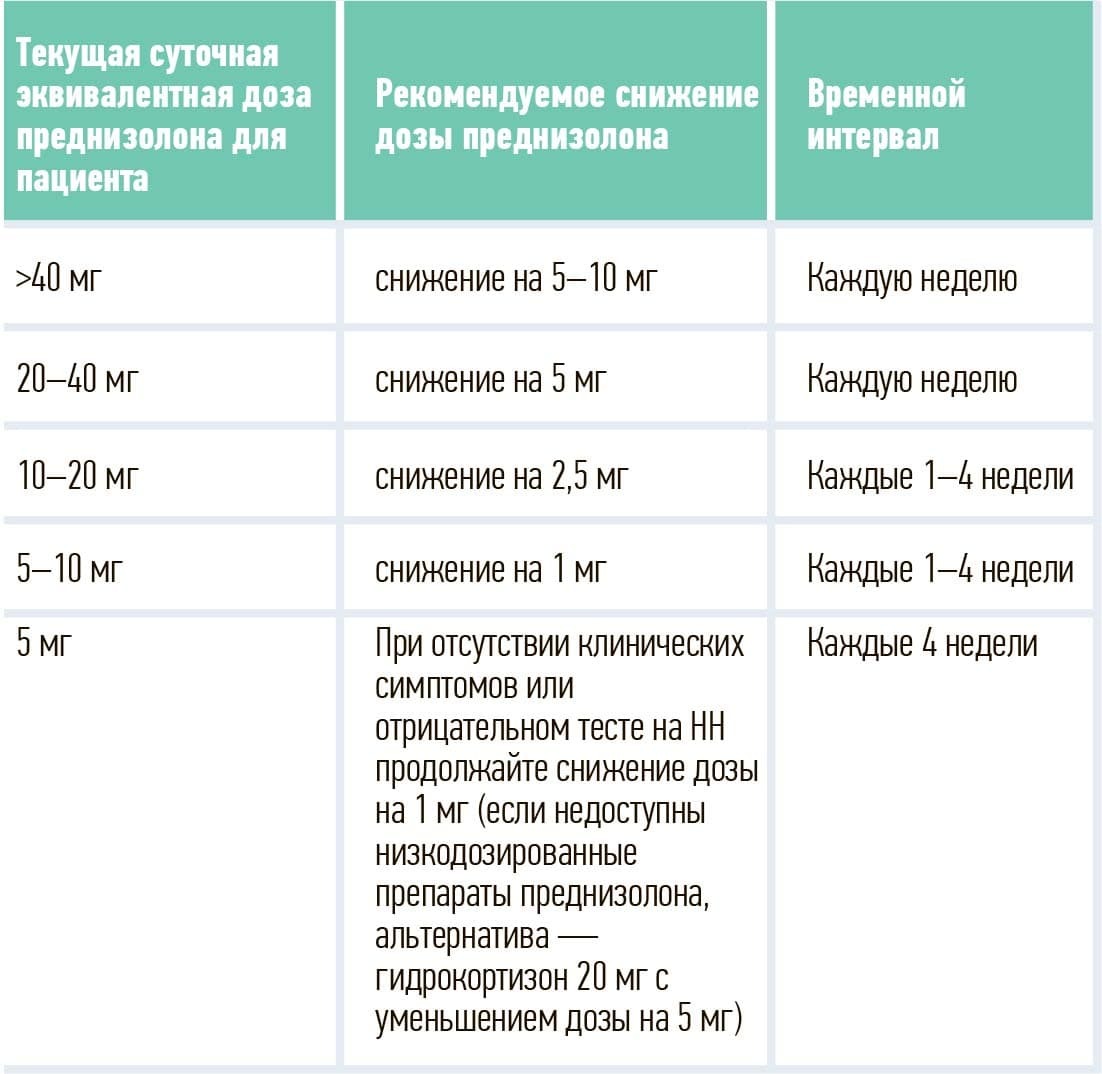
Дексаметазон, препарат из широко используемых ГК, имеет биологический период полураспада 36–72 часа, поэтому даже при приеме 1 раз в сутки оказывает угнетающее влияние на функцию надпочечников. Также высокий риск надпочечниковой недостаточности, превышающий 50 %, регистрируется при проведении внутрисуставных инъекций (факторы риска — повторные инъекции в течение короткого периода, длящегося менее 3 месяцев, и одновременные инъекции в несколько суставов).
При применении ингаляционных глюкокортикоидов риск развития заболевания зависит от используемых доз лекарственных средств и не превышает 8 %. При интраназальном и чрескожном поступлении ГК риск надпочечниковой недостаточности достигает 4 %.
Он увеличивается при длительном применении высокоэффективных препаратов на больших поверхностях, участках повышенной абсорбции (слизистая оболочка, веки, мошонка) или на воспаленной коже с нарушенной барьерной функцией при наложении окклюзионных повязок и одновременном применении других путей введения ГК.
Что следует знать
- Не рекомендуется снижать дозу ГК у пациентов, получающих краткосрочную терапию (менее 3–4 недель независимо от дозы). В этих случаях прием препарата можно прекратить без тестирования из-за низкой вероятности подавления оси «гипоталамус — гипофиз — надпочечники».
- Снижение дозы препарата у пациентов, получающих длительную терапию, следует предпринимать только в том случае, если основное заболевание, по поводу которого они были назначены, находится под контролем и ГК больше не требуются. В этих случаях дозу снижают до тех пор, пока не будет достигнут физиологический эквивалент суточной дозы (например, 4–6 мг преднизолона).
- Не рекомендуется проводить рутинное тестирование надпочечниковой недостаточности у пациентов, получающих супрафизиологические дозы ГК.
- В случае если пациенты получают ГК длительного действия (дексаметазон или бетаметазон), обоснован перевод на препарат более короткого действия (гидрокортизон или преднизолон).
- Пациентам, получающим физиологическую эквивалентную суточную дозу и стремящимся прекратить терапию глюкокортикоидами, следует продолжать постепенно снижать дозу, одновременно наблюдая за клиническими признаками и симптомами НН или исследовать кортизол утренней сыворотки крови.
- Утренний тест на кортизол сыворотки при необходимости может быть использован в качестве теста 1-го уровня для подтверждения восстановления гипоталамо-гипофизарно-надпочечниковой системы. О восстановлении оси «гипоталамус — гипофиз — надпочечники» свидетельствует уровень кортизола более 300 нмоль/л. При таких показателях прием препарата можно безопасно прекратить. При результате уровня кортизола 150–300 нмоль/л следует продолжить прием физиологической дозы ГК и повторить утренний контроль кортизола (обычно от нескольких недель до месяца). Уровень АКТГ сохраняется в пределах референсных значений или снижен. Если результат менее 150 нмоль/л — продолжить прием физиологической дозы и повторить утренний контроль кортизола через несколько месяцев.
- Пациентам, которые в настоящее время или недавно принимали глюкокортикоиды и не проходили биохимическое тестирование для исключения ГК-индуцированной надпочечниковой недостаточности, должна быть рекомендована страховочная доза препарата, когда они подвергаются стрессу.
Пульс-терапия
Следует обратить внимание на вопрос влияния пульс-терапии на функцию надпочечников. Эта методика обеспечивает более редкий прием препарата, снижение риска побочных эффектов, оказывает быстрый противовоспалительный эффект, хотя повышает риск венозного тромбоэмболизма и других побочных эффектов и, как считалось долгое время, нивелирует супрессию АКТГ. В настоящее время доказано, что введение ГК пульсами в кумулятивной дозе 4,5 г влияет на функцию надпочечников, вызывая более тяжелое нарушение секреции надпочечникового андрогена дегидроэпиандростеронсульфата, чем кортизола, но не вызывает вторичной НН, а дополнительная терапия пероральными ГК после пульс-терапии может вызвать вторичную НН. Назначение ГК продолжительностью 12 пульсов может привести к развитию недостаточности надпочечников, индуцированной ГК.
Важно! Наличие симптомов экзогенного синдрома Кушинга у пациентов, получающих в настоящее время или ранее лечение глюкокортикоидами, с высокой степенью вероятности предполагает наличие глюкокортикоид-индуцированной надпочечниковой недостаточности.
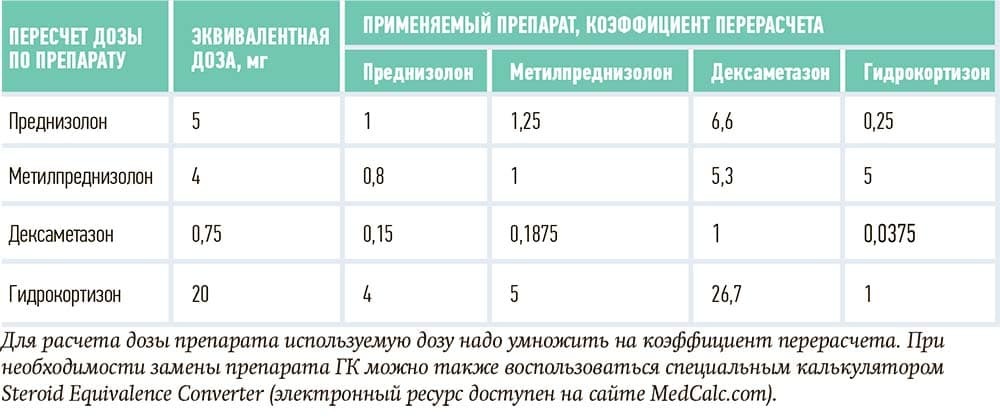
Таблица 3. Коэффициенты перерасчета доз ГК для перорального приема.
Риск переломов
Следует помнить, что ятрогенный гиперкортизолизм связан с повышением риска сердечно-сосудистых заболеваний, сердечной недостаточности, фибрилляции предсердий, депрессий, оппортунистических инфекций, остеопороза и смертности.
Доказана сильная корреляция между суточной либо кумулятивной дозой ГК и потерей минеральной плотности кости и, как следствие, риском переломов. Относительный риск указанных нарушений увеличивается даже при дозах всего 2,5 мг/сутки преднизолона и зависит от длительности терапии.
При приеме ГК всем пациентам актуально оптимизировать образ жизни: физическая активность, адекватное потребление пищевого кальция и белка, поддержание целевого уровня 25(OH)D.
Параллельно как можно скорее после начала лечения ГК в дозе 2,5 мг/день более 3 месяцев необходимо провести скрининг риска переломов у пациентов в возрасте от 40 лет с помощью FRAX и определения минеральной плотности кости с использованием двухэнергетической рентгеновской абсорбциометрии (DEXA) с оценкой перелома позвонка или рентгеном позвоночника. Обязательная оценка минеральной плотности кости с тестированием оценки перелома позвонка или рентгеном позвоночника рекомендуется пациентам моложе 40 лет, поскольку FRAX не проверен в этой популяции.
Для взрослых, длительно продолжающих терапию ГК в дозе от 2,5 мг/день до 7,5 мг/день и имеющих низкий или умеренный риск переломов (без терапии остеопороза), настоятельно рекомендуется проводить повторную оценку риска переломов каждые 1–2 года. При определении высокого риска переломов по шкале FRAX нужно рассмотреть корректирующие мероприятия, включающие использование бисфосфонатов в качестве препаратов первой линии для пациентов с умеренным или высоким риском переломов, золедроната (в/в), терипаратида или деносумаба — в качестве второй линии для пациентов с высоким риском переломов, не переносящих пероральные бисфосфонаты. После прекращения приема ГК риск переломов снижается, но может быть лишь частично обратимым.
Приведенные факты свидетельствуют о необходимости вдумчивого отношения врачей к назначению глюкокортикоидов, научно обоснованного подхода к снижению доз препарата и их отмены, внимательного отношения к пациенту, в анамнезе которого есть указания на использование ГК при лечении интеркуррентных заболеваний.
