Инфицирование вирусом SARS-CoV-2 при неблагоприятном течении болезни с развитием цитокинового шторма морфологически манифестируется выраженным парезом сосудов микроциркуляторного русла, стазами, артериальной гиперемией с расширением мелких артерий и отеком в различных органах и тканях организма. Проведен анализ аутопсийного материала с целью изучения морфологических изменений в головном мозге.
Изменение ядерного хроматина пораженных клеток
 Опыт работы с различными вирусными инфекциями позволил нам определить характерные изменения ядерного хроматина пораженных клеток. Так, на начальном этапе отмечается увеличение ядра с конденсацией хроматина.
Опыт работы с различными вирусными инфекциями позволил нам определить характерные изменения ядерного хроматина пораженных клеток. Так, на начальном этапе отмечается увеличение ядра с конденсацией хроматина.
В последующем начинается локальный лизис хроматина и формируется небольшая внутриядерная вакуоль, содержащая мелкие гиперхромные включения. Остатки хроматина при этом откладываются по внутреннему листку ядерной мембраны. Этот процесс гибели хроматина в ядре прогрессирует и приводит к нуклеоцитолизу всей клетки. Все эти изменения хорошо видны при окраске гематоксилином и эозином, т. е. базовым простым методом.
Данные поражения особенно четко прослеживаются в легких: бронхиальном эпителии, альвеолоцитах, стромальных клетках и прежде всего в эндотелии, гладкомышечных и адвентициальных клетках сосудов мелкого и среднего калибра. Также в стенках сосудов имеет место фибриноидный некроз, плазморрагия и периваскулярные массивные геморрагии в окружающие пространства с выходом большого количества фибрина.
Тропизм SARS-CoV-2 к нейроэктодермальной ткани
Дальнейшее распространение вируса в организме протекает гематогенным путем с генерализованным поражением сосудистого русла. Считаю, что имеет место тропизм вируса как к эпидермальным, так и к мезенхимальным тканям. В мировой литературе имеются указания на значительный тропизм к нейроэктодермальной ткани. Возможно, этим и объясняется цитокиновый шторм как результат воздействия на нейрорецепторные периваскулярные клетки APUD-system.
Нейротропизм вируса, по данным мировой литературы, также подтверждается возможностью периневрального пути попадания в центральную нервную систему (ЦНС) по ходу нервных волокон. Дискуссируется вопрос о роли глии в поражении паренхимы ЦНС.
Макроскопическое исследование головного мозга
На протяжении всей пандемии SARS-CoV-2 проводился анализ патоморфологической картины аутопсийного материала Городского клинического патологоанатомического бюро Минска. Исследовались все внутренние органы, но повышенное внимание уделялось поражению ЦНС, особенно в случаях с неврологической симптоматикой. Мы располагаем 52 наблюдениями умерших в возрасте от 31 года до 78 лет (медиана 56 лет).
Макроскопически: головной мозг с увеличенной массой на 50–150 г, мягкие мозговые оболочки отечны, полнокровны, в ряде случаев с мелкими и крупными геморрагиями. Сосуды основания мозга в 34 наблюдениях с признаками атеросклеротического поражения. Обширные кровоизлияния определялись в 18 случаях. Это были пациенты моложе 54 лет. В 3 наблюдениях имели место признаки гнойного лептоменингита, в 8 — крупные очаги энцефаломаляции с множественными мелкими геморрагиями, остальные наблюдения характеризовались множественными мелкими геморрагиями различных размеров.
Таким образом, при макроскопическом исследовании доминирующим признаком являются множественные геморрагии различных размеров.
В отдельных случаях для приготовления микропрепаратов использовался головной мозг целиком, т. е. вырезались кусочки из различных отделов коры больших полушарий (поля № 10, 6, 4, 1, 39, 17, 22, 23), подкорковых ядер, гиппокампа, поперечные срезы моста и продолговатого мозга, мозжечка и даже спинного мозга с межпозвоночными ганглиями.
Гистологические срезы окрашивались гематоксилином и эозином, по методу Клювера — Барреры и MSB-методом на фибрин. Для этиологического доказательства мы использовали иммуногистохимический метод (ИГХ) с маркерами к белку нуклеокапсида (anti-SARS-CoV-2 nucleocapsid protein antibody, клон HL448 (ab281297)) и к S-гликопротеину SARS-CoV-2 (anti-SARS-CoV-2 spike glycoprotein antibody, ab272504). Данные методы использовались только в 4 случаях, в остальных применяли ПЦР с парафиновых срезов головного мозга, где была подтверждена этиология вирусного поражения.
Микроскопическое исследование мозговой ткани
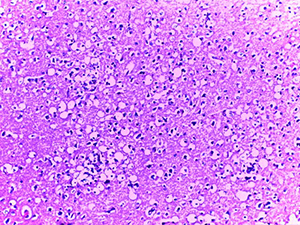
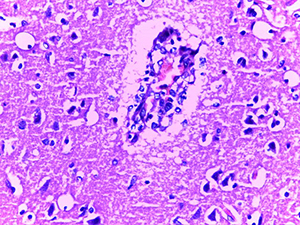 Микроскопическое исследование при окраске гематоксилином и эозином показало характерные изменения ядерного хроматина в эндотелиальных клетках сосудов микроциркуляторного русла (МЦР) головного мозга и в меньшей степени в периваскулярных астроцитах и ганглиозных клетках (см. рис. 1).
Микроскопическое исследование при окраске гематоксилином и эозином показало характерные изменения ядерного хроматина в эндотелиальных клетках сосудов микроциркуляторного русла (МЦР) головного мозга и в меньшей степени в периваскулярных астроцитах и ганглиозных клетках (см. рис. 1).
Так, имел место очаговый лизис хроматина с формированием небольшой внутриядерной вакуоли и распылением остатков хроматина ближе к внутреннему листку ядерной мембраны.
В ряде случаев описанная вакуоль содержала гиперхромную базофильную частицу по типу внутриядерного включения. Отмечалась тенденция к увеличению размеров данных вакуолей, которые в последующем занимали большую часть ядра и в конечном итоге приводили к полному нуклеолизу. Контуры клеток в виде остатков цитоплазмы сохранялись какое-то время.
Данные изменения ядерного хроматина имели место в сосудах МЦР всех отделов головного мозга, но более заметными были в коре больших полушарий и сером веществе подкорковых ядер.
Наряду с поражением ядерного хроматина клеток сосудов отмечались фибриноидное набухание и фибриноидный некроз базальной мембраны и всей стенки сосудов. Наблюдалась четкая деструкция самой стенки, что сопровождалось периваскулярными геморрагиями.
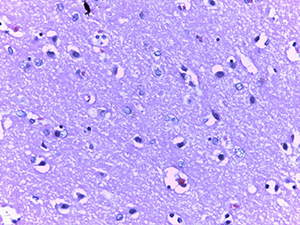 Вокруг таких сосудов формировались воспалительные инфильтраты, представленные лимфоцитами, сегментоядерными лейкоцитами и обилием белков плазмы.
Вокруг таких сосудов формировались воспалительные инфильтраты, представленные лимфоцитами, сегментоядерными лейкоцитами и обилием белков плазмы.
Сосуды МЦР нередко содержали свежие тромбы при окраске MSB, что сопровождалось мелкими периваскулярными геморрагическими некрозами нервной ткани.
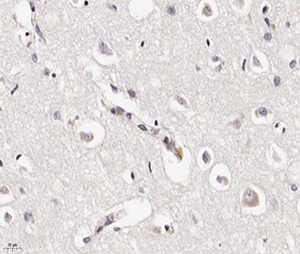
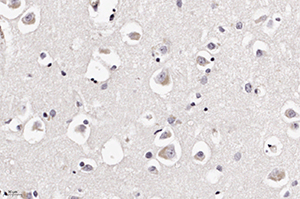
В периваскулярных астроцитах и ганглиозных клетках определялись аналогичные внутриядерные вакуоли с базофильными включениями (см. рис 2 и рис. 3).
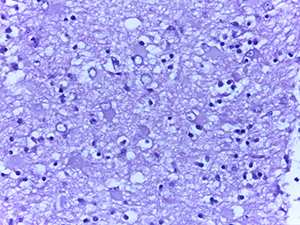 В то же время в ганглиозных клетках коры больших полушарий преобладали ишемические изменения (по Шпильмейеру) без характерной ядерной патологии.
В то же время в ганглиозных клетках коры больших полушарий преобладали ишемические изменения (по Шпильмейеру) без характерной ядерной патологии.
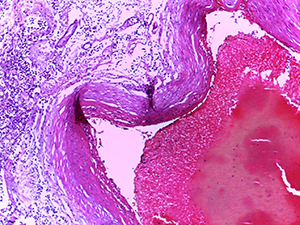
Нередко в веществе мозга определялись мелкие сливающиеся ишемические очаги энцефаломаляции (см. рис. 4).
Во всех наблюдениях обращали на себя внимание множественные очаги выраженного отека и набухания в коре и субкортикальном белом веществе.
 В трех наблюдениях на основании МРТ-исследования при жизни пациентов выставлялся диагноз лейкоэнцефалита. При этом морфологически были обнаружены множественные периваскулярные и перивентрикулярные очерченные очаги выраженного отека и набухания мозга с признаками нуклеолиза глиальных клеток, что напоминало не до конца сформированный очаг колликвационного некроза в белом веществе.
В трех наблюдениях на основании МРТ-исследования при жизни пациентов выставлялся диагноз лейкоэнцефалита. При этом морфологически были обнаружены множественные периваскулярные и перивентрикулярные очерченные очаги выраженного отека и набухания мозга с признаками нуклеолиза глиальных клеток, что напоминало не до конца сформированный очаг колликвационного некроза в белом веществе.
Данная картина дополнялась набуханием миелина и его зернистым распадом и напоминала картину рассеянного склероза, но без глиальной и лимфоцитарной пролиферации.
В двух случаях в коре больших полушарий, а в одном случае в коре мозжечка имели место ламинарные некрозы, топографически связанные с поражением мелких сосудов. Данные изменения напоминали нам таковые при остром герпетическом энцефалите, при котором также имеет место поражение мелких сосудов с тромбозом.
Крупноочаговые ишемические изменения
 Помимо поражения сосудов МЦР имели место и четко очерченные крупноочаговые ишемические изменения в ткани мозга вследствие тромбоза крупных мозговых артерий, что отмечалось у 8 пациентов с выраженным атеросклерозом сосудов головного мозга.
Помимо поражения сосудов МЦР имели место и четко очерченные крупноочаговые ишемические изменения в ткани мозга вследствие тромбоза крупных мозговых артерий, что отмечалось у 8 пациентов с выраженным атеросклерозом сосудов головного мозга.
При ИГХ обнаружено наличие антигена вируса в клетках нейронов и астроцитов (см. рис. 5 и рис. 6). В то же время реакция к S-гликопротеину вируса SARS-CoV-2 поверхностных рецепторов была отрицательной.
 Также в нашей практике встречались случаи полирадикулоневрита (2 наблюдения), где отмечено преимущественное поражение периферических нервов с набуханием и распадом миелиновых оболочек, которое сопровождалось круглоклеточной воспалительной инфильтрацией периневральных оболочек.
Также в нашей практике встречались случаи полирадикулоневрита (2 наблюдения), где отмечено преимущественное поражение периферических нервов с набуханием и распадом миелиновых оболочек, которое сопровождалось круглоклеточной воспалительной инфильтрацией периневральных оболочек.
Заключение
Таким образом, морфологическая картина изменений головного мозга при COVID-19 складывается из весьма характерных поражений ядерного хроматина клеток сосудистой стенки и периваскулярных астроцитов, в меньшей степени ганглиозных клеток коры и подкорковых ядер, что подтверждается при ИГХ либо методом ПЦР с парафиновых срезов.
Характерные изменения эндотелиальных клеток сосудов МЦР, мышечных и адвентициальных клеток достаточно информативны при окраске гематоксилином и эозином, также MSB-методом в виде фибриноидного набухания и некроза базальной мембраны мелких сосудов, микротромбоза, периваскулярных геморрагий и воспалительных круглоклеточных инфильтратов.
 Поражение ткани головного мозга преимущественно носит ишемический характер и индуцируется изменениями кровеносных сосудов МЦР и мелких артерий. Наряду с этим у лиц с заметным церебральным атеросклерозом при данной инфекции возможны типичные крупноочаговые инфаркты мозга, связанные с тромбозом крупных сосудов (см. рис. 7). Несомненно, это является отражением нарушений общего гомеостаза свертывающей системы крови и общей гемодинамики при COVID-19.
Поражение ткани головного мозга преимущественно носит ишемический характер и индуцируется изменениями кровеносных сосудов МЦР и мелких артерий. Наряду с этим у лиц с заметным церебральным атеросклерозом при данной инфекции возможны типичные крупноочаговые инфаркты мозга, связанные с тромбозом крупных сосудов (см. рис. 7). Несомненно, это является отражением нарушений общего гомеостаза свертывающей системы крови и общей гемодинамики при COVID-19.
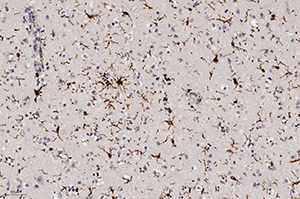 Окраска на микроглию при ИГХ (Iba-1) показала их активацию, что свидетельствовало об иммунном ответе ткани мозга на данную инфекцию, а также активацию периваскулярных астроцитов (ИГХ к КГФБ) (см. рис. 8).
Окраска на микроглию при ИГХ (Iba-1) показала их активацию, что свидетельствовало об иммунном ответе ткани мозга на данную инфекцию, а также активацию периваскулярных астроцитов (ИГХ к КГФБ) (см. рис. 8).
Следует также обратить внимание на такую форму поражения, как ламинарные некрозы, развитие которых обусловлено исключительно изменениями сосудов МЦР. Ламинарные некрозы коры мозжечка, коры больших полушарий, мелкофокусные некрозы любой локализации, включения в ядрах эндотелиальных клеток и астроцитов напоминают поражения при острых герпетических энцефалитах.
Однако морфологическая структура включений при герпетической инфекции имеет другую картину и может быть дифференцирована на гематоксилине и эозине. Это позволяет даже на светооптическом уровне проводить дифференциальную этиологическую диагностику.
Обращает на себя внимание развитие выраженного локального отека нервной ткани субкортикальных и перивентрикулярных отделов головного мозга. Данные очаги анатомически связаны с венулами головного мозга. Очевидно, этот факт следует учитывать при подборе терапии у таких пациентов. Наряду с поражением головного мозга возможны и полирадикулоневриты с процессами демиелинизации.
Выводы
Поражения вещества головного мозга преимущественно носят ишемический характер и индуцируются изменениями кровеносных сосудов МЦР.
У лиц с заметным церебральным атеросклерозом возможны типичные крупноочаговые инфаркты мозга, связанные с тромбозом крупных сосудов. Несомненно, это является отражением нарушений общего гомеостаза свертывающей системы крови и общей гемодинамики при COVID-19.
Морфологическая картина поражения головного мозга складывается из характерных поражений ядерного хроматина клеток сосудистой стенки, периваскулярных астроцитов, ганглиозных клеток коры и корковых ядер. Данные изменения достаточно информативны при окраске гематоксилином и эозином.
MSB-методом выявляются патологические изменения в виде фибриноидного набухания и некроза базальной мембраны мелких сосудов, микротромбоза, периваскулярных геморрагий и воспалительных круглоклеточных инфильтратов.
Многообразие поражений ЦНС при инфекции COVID-19 и ее морфогенеза требуют дальнейшего изучения.