Успехи в лечении онкологических заболеваний поспособствовали тому, что рак перестал быть приговором. Пациентов, прошедших лечение и находящихся в стойкой ремиссии, становится все больше. Они приходят на прием к врачу общей практики с терапевтическими проблемами, связанными как с токсическими последствиями лучевой и химиотерапии, так и другими, возникающими с возрастом у большинства людей. Например, повышение артериального давления, сахарный диабет, остеопороз.
 Отличается ли ведение пациентов с артериальной гипертензией и онкологией в анамнезе и тех, кто не столкнулся с онкологией? Как оценить кардиологические риски? Каких пациентов следует обязательно направить на консультации к узким специалистам — кардиологу, эндокринологу, диетологу? Своим опытом в ходе вебинара поделилась Варвара Веретюк, врач-терапевт, гастроэнтеролог, ассистент кафедры неотложной терапии с эндокринологией и профпатологией ФПКиППВ Новосибирского ГМУ.
Отличается ли ведение пациентов с артериальной гипертензией и онкологией в анамнезе и тех, кто не столкнулся с онкологией? Как оценить кардиологические риски? Каких пациентов следует обязательно направить на консультации к узким специалистам — кардиологу, эндокринологу, диетологу? Своим опытом в ходе вебинара поделилась Варвара Веретюк, врач-терапевт, гастроэнтеролог, ассистент кафедры неотложной терапии с эндокринологией и профпатологией ФПКиППВ Новосибирского ГМУ.
Оценка кардиотоксичности терапии рака
Один из вопросов, который приходится решать врачу общей практики в тесном взаимодействии с онкологом, — можно ли в принципе начинать химиотерапию или таргетную терапию рака конкретному пациенту? При серьезной сердечно-сосудистой, эндокринной и другой патологии иногда это проблематично, так как пациент не перенесет токсичное лечение. Также и в процессе терапии рака нередко возникает вопрос о возможности ее продолжения с учетом возникших высоких сердечно-сосудистых рисков.
Варвара Веретюк рассказала об этом на примере из своей практики.
Пациентка, 52 года, рост 168 см, вес 74 кг, ИМТ 26,2 кг/м2, АД 115/70, ЧСС 72/мин. Диагноз: рак левой молочной железы (люминальный тип В, HER2-позитивный, T2 NO MO).
Планируется: полихимио-терапия (доксорубицин/циклофосфамид, затем паклитаксел), таргетная терапия (трастузумаб HER2), секторальная резекция левой молочной железы, дистанционная лучевая терапия, эндокринотерапия (овариальная супрессия). Была направлена онкологом на консультацию к терапевту для решения вопроса о возможности начала противоопухолевой терапии.
Варвара Веретюк:
У многих терапевтов при взгляде на список онкологических препаратов возникает легкое чувство неуверенности, потому что их становится все больше, возрастающий объем информации сложно удержать в голове. Так и хочется сказать: идите к онкологу, он разберется, но нет, это наша работа — оценить сопутствующую патологию и факторы риска у таких пациентов.
Примечательно, что первыми вопросами, которые задала пациентка на консультации, были: «Какие у меня шансы?» и «Отрастут ли волосы после химии?». Однако мы понимаем, что в процессе лечения рака возникнет ряд других вопросов, которые надо рассмотреть еще до начала лечения.
Состояние здоровья пациентки до лечения рака: артериальная гипертензия, принимает телмисартан 40 мг; необструктивный атеросклероз БЦА, принимает аторвастатин 20 мг с достижением целевых уровней ниже 1,8.
С какими осложнениями лечения рака может столкнуться пациентка: кардиотоксичность, нарушение толерантности к глюкозе, симптомы овариальной супрессии. Также возможны гематологические (анемия, нейтропения), неврологические (нейропатия) проблемы, депрессия.
Главный вопрос онколога: можно ли начинать/продолжать терапию рака?
Вопросы терапевта, кардиолога: риски кардиотоксичности; стратегии снижения рисков; как часто наблюдать?
По мнению Варвары Веретюк, решать эти вопросы стало легче после того, как в 2022 году вышли рекомендации Европейского общества кардиологов (ESC), разработанные совместно с гематологической ассоциацией, обществом терапевтической радиологии и онкологии, а также Международным обществом кардиоонкологии.
В рекомендациях прописаны вопросы мониторинга, контроля и снижения кардиотоксичности.
Специалист подчеркнула, что теперь маршрутизировать пациентов проще, так как установлены четкие критерии по группам наблюдения в ходе терапии рака и в последующие годы. Так, согласно этим рекомендациям, кардиологическое наблюдение и медикаментозное лечение в 1-й год терапии рака потребуется пациентам:
- с высоким или очень высоким риском кардиотоксичности по калькулятору HFA-ICOS;
- получающим терапию рака с высоким риском долгосрочных сердечно-сосудистых осложнений (доксорубицин ≥250 мг/м2; лучевая терапия больше 15 Gy MHD (средняя доза облучения сердца));
- получающим совместно доксорубицин ≥100 мг/м2 и лучевую терапию 5–15 Gy MHD;
- с умеренными или тяжелыми реакциями кардиотоксичности в ходе лечения рака (дисфункция миокарда, связанная с терапией рака; ICI-миокардит; аритмии; тяжелая сосудистая токсичность (ОКС, инсульт, заболевание периферических артерий, венозная тромбоэмболия));
- с новыми симптомами со стороны сердечно-сосудистой системы или новыми бессимптомными отклонениями ЭхоКГ и/или сывороточных кардиомаркеров в завершение терапии.
Чек-лист оценки факторов кардиотоксичности на старте включает клиническую оценку (анамнез терапии рака, анамнез и факторы риска сердечно-сосудистых заболеваний, физикальный осмотр) и обследование (определение BNP/NP-proBNP, cTn, глюкоза натощак/HBA1c, СКФ, липидный профиль, ЭКГ, ЭхоКГ).
Для оценки кардиотоксичности применяется калькулятор HFA-ICOS
Варвара Веретюк:
Калькулятор на английском языке, но в браузере можно установить автоматический перевод. Первый раздел — планируемое лечение. Очень удобно то, что при наведении мышкой на группу препаратов появляется список препаратов этой группы. Например, у нашей пациентки на первом этапе планируется антрациклиновая терапия (доксорубицин), затем — терапия, направленная на рецепторы HER-2 (трастузумаб). Отмечаем это в калькуляторе.
Далее идет раздел предыдущего анамнеза по сердечно-сосудистым заболеваниям, сердечные биомаркеры (тропонин, BNP), возраст, сопутствующие заболевания (гипертония, сахарный диабет, хроническая болезнь почек), предшествующее кардиотоксическое лечение, факторы риска, связанные с образом жизни. О
тмечаем имеющиеся факторы, и калькулятор сразу выдает нам ответ. В частности, на старте химиотерапии уровень риска кардиотоксичности у нашей пациентки низкий. Также сразу предлагается алгоритм наблюдения. Можем посмотреть, что ждет ее на дальнейших этапах лечения, кардиотоксический риск возрастает до умеренного, предлагается уже другой алгоритм наблюдения.
Рекомендуемое наблюдение при умеренном кардиотоксическом риске включает: консультацию кардиолога, выполнение ЭКГ (исходно), определение тропонина сыворотки и BNP (исходно, каждые 3 месяца во время лечения и через 12 месяцев после завершения лечения), трансторакальную ЭхоКГ с оценкой деформации миокарда (исходно, каждые 3 месяца во время лечения, через 12 месяцев после завершения лечения).
Эндокринная терапия у пациентов с раком
Варвара Веретюк:
В лечении рака молочной железы у женщин и рака предстательной железы у мужчин применяется эндокринная терапия, что также связано с определенными рисками, в т. ч. сердечно-сосудистой системы. Так, ингибиторы ароматазы увеличивают риски дислипидемии, сахарного диабета, гипертонии, сердечной недостаточности, инфаркта миокарда.
Поэтому на период терапии ингибиторами ароматазы необходим мониторинг липидного профиля, а также контроль артериального давления. У пациентов, получающих лечение тамоксифеном, следует обязательно оценить тромботические риски, на ЭКГ обращать внимание на показатель QTc (при его удлинении возрастает риск нарушения сердечного ритма).
Специалист сообщила, что в упомянутых выше клинических рекомендациях ESC для всех пациентов, получающих эндокринную терапию рака, рекомендован расчет рисков по SCORE2/SCORE2-OP, однако они применимы лишь для пациентов старшего возраста.
«Валидизированной шкалы для оценки сердечно-сосудистых рисков у пациентов до 40 лет в России, к сожалению, нет. Такие шкалы есть в Великобритании, США, но так как население этих стран явно отличается от нашего по этническому, расовому составу, то пользоваться ими неэтично. Кроме того, по последним данным, применяемая в США шкала занижает риски».
Онкологический пациент с артериальной гипертензией
Варвара Веретюк отметила, что если до терапии рака пациент с артериальной гипертензией принимал гипотензивные препараты, то их прием рекомендовано продолжать с контролем за достижением целевых значений АД, ведением дневника АД. Если же АГ диагностирована впервые в ходе терапии рака, то препаратами первой линии являются ингибиторы АПФ (иАПФ) или блокаторы рецепторов ангиотензина (БРА, т. е. сартаны) для снижения риска кардиотоксичности.
Если на монотерапии не достигаются целевые цифры (а также онкологическим пациентам с умеренным и высоким сердечно-сосудистым риском при САД ≥160 мм рт. ст. и ДАД ≥100 мм рт. ст.), назначается комбинированная терапия: иАПФ/БРА + дигидропиридиновые блокаторы кальциевых каналов. Следует избегать назначения верапамила и дилтиазема по причине риска межлекарственных взаимодействий.
Согласно общему мнению российских экспертов по профилактике кардиоваскулярной токсичности, у пациентов с терапией рака вопрос о приостановке противоопухолевого лечения рассматривается только в случае стойкого повышения уровня САД ≥180 мм рт. ст. и ДАД ≥160 мм рт. ст.
Варвара Веретюк:
Но наша задача в таком случае скорректировать гипотензивную терапию, привести АД в порядок и взять под контроль. Начинать и возобновлять терапию рака можно уже при цифрах менее 160/100 мм рт. ст.
Возможности первичной профилактики кардиотоксичности весьма ограничены.
Варвара Веретюк:
У пациентов на химиотерапии или таргетной терапии с высоким и очень высоким риском кардиотоксичности можно рассмотреть назначение иАПФ/БРА и бета-блокаторов, рекомендованных при хронической сердечной недостаточности. У взрослых пациентов следует рассмотреть статины.
При лучевой терапии, к сожалению, нет препаратов, доказавших возможность первичной профилактики кардиотоксичности. Эксперты лишь акцентируют внимание на целенаправленной лучевой терапии, то есть ограничении зоны облучения сердца.
Известно, что лучевая терапия на область сердца ускоряет атеросклероз, прогрессирование уже имеющейся ишемической болезни сердца, поэтому требуется тщательный контроль факторов риска сердечно-сосудистых заболеваний, чтобы не запоздать с назначением статинов, когда они будут показаны.
Контроль углеводного обмена
Варвара Веретюк:
Терапия рака, в частности эндокринные способы терапии, ряд препаратов для химиотерапии могут увеличивать инсулинорезистентность, повышать риски развития нарушений толерантности к глюкозе, провоцировать развитие СД 2-го типа. А это в свою очередь увеличивает сердечно-сосудистые риски. Поэтому важным является мониторинг уровня глюкозы в крови.
К сожалению, нередко приходится встречать пациентов, которые месяцами ходят с изменениями в анализах, когда цифры гликемии превышают 6,5–7 мг/дл, а в рекомендациях у них только диетотерапия. Безусловно, рекомендации по питанию важны, но этого мало. Таких пациентов обязательно надо направлять на консультацию к эндокринологу.
При назначении сахароснижающих препаратов следует ориентироваться на разницу между фактическим и целевым уровнем гликированного гемоглобина (HbA1c). При разнице менее 1 % старт с монотерапии, если разница больше, то приветствуется комбинированная терапия.
Специалист также порекомендовала разъяснять и напоминать пациентам о пользе физической активности во время и после противоракового лечения.
«Исследования показали, что регулярная физическая активность, аэробные упражнения во время первичного лечения рака и после терапии связаны с лучшими результатами, сокращением риска рецидива и повышением общей выживаемости. Имеются в виду не только ходьба, прогулки. Следует ориентироваться на самочувствие, но помимо аэробных нагрузок полезными будут силовые упражнения, растяжка, йога, упражнения на равновесие. Лицам с лечением рака в анамнезе рекомендованы регулярные физические упражнения не менее 150 минут в неделю».
Остеопороз
Варвара Веретюк рассказала, что, согласно российским рекомендациям по лечению рака молочной железы, пациентам с гормонозависимым РМЖ, получающим длительно ингибиторы ароматазы, а также пациентам, которым проводится овариальная супрессия или у которых в результате противоопухолевого лечения наступила ранняя менопауза, рекомендован контроль минеральной плотности костей (рент-геноденситометрия) 1 раз в год. Значительно повышен риск остеопороза также у пациентов после терапии рака желудка и поджелудочной железы.
Оценка нутритивного статуса
Нередко пациенты, проходящие терапию рака различной локализации, направляются онкологом на консультацию к терапевту в связи со значительным снижением ИМТ и жалобами на тошноту, рвоту, диарею, слабость, утомляемость и др. Рассматривается вопрос возможности продолжения противоопухолевого лечения, коррекции нутритивного статуса.
Для оценки нутритивного статуса применяются критерии GLIM (Global Leadership Initiative on Malnutrition) (см. табл. 1) и калькулятор, построенный по этой шкале. В калькулятор вносится такая информация, как динамика веса за 6 месяцев, месяц и 2 недели; объем и качество рациона без подробностей; симптомы, которые мешают употреблять пищу; самооценка пациента по его физической активности за последний месяц; диагноз, данные физикального осмотра (масса и тонус мышц, жировая складка, отеки).

После внесения информации получают заключение о необходимости улучшения симптоматического лечения, вмешательства в рацион.
Варвара Веретюк:
Для оценки статуса питания онкологических пациентов GLIM считается лучшим калькулятором. Но я хотела бы вам также порекомендовать еще один полезный в повседневной практике инструмент — трехминутный скрининг статуса питания (см. табл. 2).
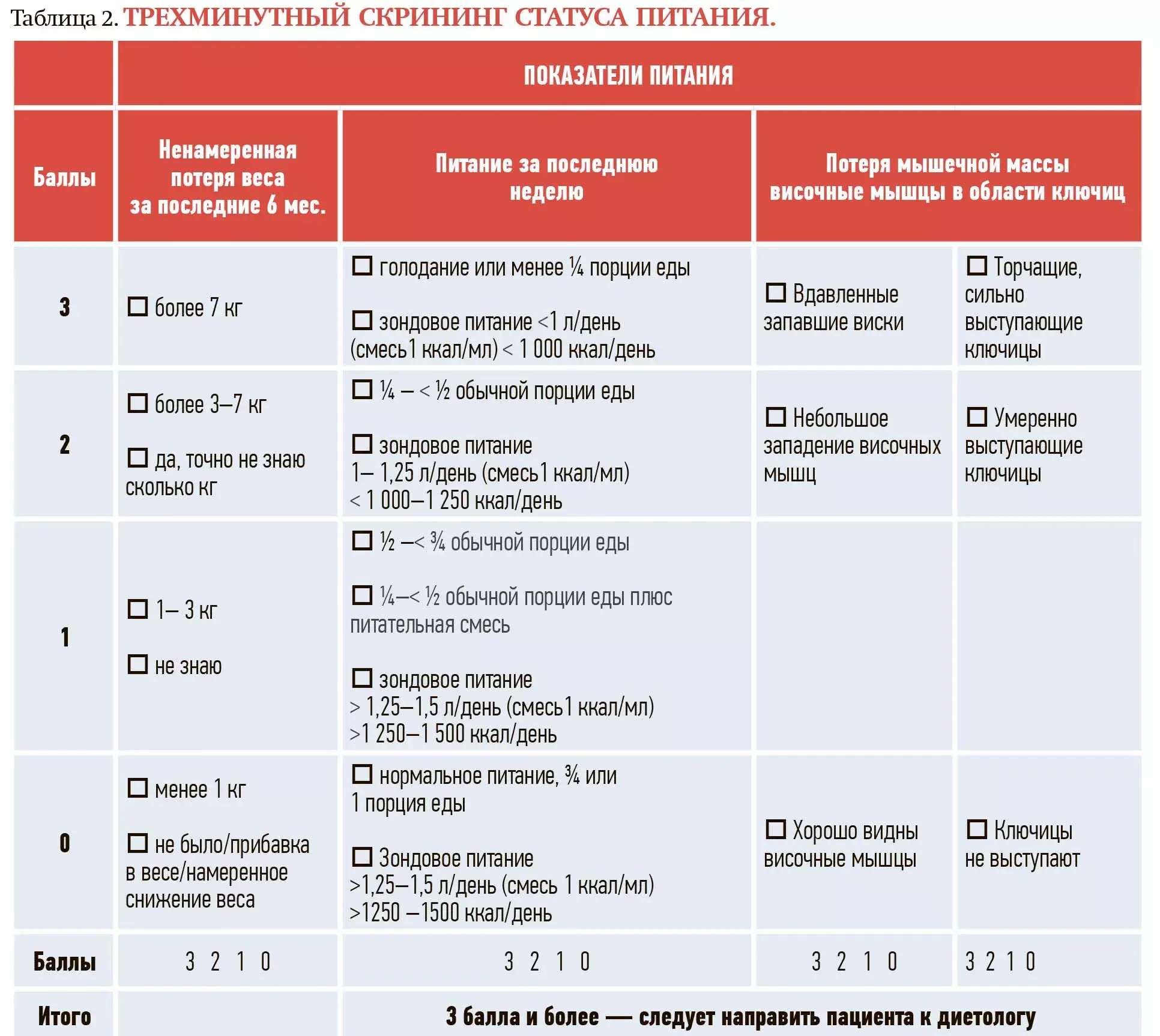
При скрининге оцениваются следующие параметры:
- ненамеренное снижение веса за последние 6 месяцев. Менее 1 кг — 0 баллов; 1–3 кг — 1 балл; 3–7 кг — 2 балла; более 7 кг — 3 балла;
- питание за последнюю неделю. Спрашиваем пациента, ест ли он обычную порцию, если нет, то какую порцию съедает за один раз;
- утрата мышц в области висков и ключиц. Если мышцы в этих областях атрофированы, то у пациента явно есть потеря мышечной (саркопения) и жировой массы.
По результатам 3 балла и более пациента следует направить на консультацию к диетологу.
Эксперт также сообщила, что по российским клиническим рекомендациям следует выделять пациентов с выраженной нутритивной недостаточностью для более ранней консультации диетолога и коррекции питания: с ИМТ <18,5 кг/м2; потерей >5 %; массы тела за месяц или >15 %; за 3 месяца; потреблением <25 %; от должной нутритивной потребности. Эти критерии относятся и к пациентам, закончившим терапию рака и находящимся в ремиссии.
Коррекция питания
Варвара Веретюк:
Рацион с высоким потреблением овощей/фруктов, цельнозерновых продуктов, бобовых, орехов, нежирных молочных продуктов, птицы и рыбы связан с уменьшением смертности и рецидивов рака по сравнению с высоким потреблением очищенного зерна, мясных продуктов глубокой переработки, а также молочных продуктов с высоким содержанием жира.
Этот же рацион связан и с уменьшением сердечно-сосудистой смертности. Часто приходится сталкиваться с мифами у наших пациентов, которые полностью исключают из своего рациона мучное, сладкое, молочное, красное мясо, прочитав в интернете, что они вызывают рак.
В итоге они недополучают питательных веществ, страдают от запретов, а потом срываются. Им нужно пояснить, что безопасным является добавленный сахар до 5 % от суточной потребности в калориях, ВОЗ рекомендует до 10 %.
Пациенты после гастрэктомии (удаления желудка) нуждаются в особых рекомендациях. Пища у них переваривается в тонком кишечнике вместо желудка.
Варвара Веретюк:
Сначала рацион такого пациента будет диетическим, где половина — это белковые продукты, а вторая половина — зерновые, овощи, фрукты, жиры. Блюда готовятся в вареном, паровом, запеченном виде.
Мы настоятельно рекомендуем сокращать быстрые углеводы, потому что они связаны с демпинг-синдромом. Он проявляется головокружением, слабостью, тошнотой, потливостью, спазмами в животе, диареей сразу после приема пищи или через несколько часов после.
Общие рекомендации для пациентов после гастрэктомии:
- Ешьте небольшими порциями, не менее 6–8 раз в день, даже если не чувствуете голода.
- Ешьте медленно, тщательно пережевывайте пищу.
- Прекратите есть, как только достигаете насыщения.
- Избегайте приема пищи и напитков одновременно.
- Ограничивайте простые сахара (не более 10 % от суточной калорийности).
- Пейте достаточно жидкости (более 1,5 литра в день).
- Используйте питательные смеси/протеиновые напитки.
- Следите за гигиеной полости рта и зубов.
«Наши пациенты часто задают вопрос об алкоголе. Следует пояснить, что именно у пациентов после противоопухолевого лечения рака желудка и поджелудочной железы алкоголь увеличивает риск обезвоживания, даже в небольшом количестве может вызвать интоксикацию и гипогликемию. Также употребление алкоголя связано со снижением уровня витамина В9 (фолиевой кислоты), В1 и В6, что усугубляет наличие анемии, которая зачастую бывает у этой категории пациентов».
Нутритивная поддержка
При наличии хотя бы одного из следующих факторов пациентам необходима нутритивная поддержка:
- непреднамеренное снижение массы тела за последние 3 месяца на 10 % и более;
- ИМТ <20 кг/м2;
- ухудшение возможности приема пищи за последнюю неделю;
- низкий объем пищи (калорийность <1500 ккал/сут).
«Несмотря на бытующее мнение, что у пациентов после лечения рака может хуже нарастать мышечная масса, это неверно. Дело в другом, у них усиливается катаболизм, поэтому белка им нужно больше, чем в среднем рекомендуется обычному человеку, то есть не 0,8 г на кг массы тела в сутки, а 1–1,2, иногда до 1,5 г/кг/сутки, энергетическая потребность 20–30 ккал/кг/сутки».
«При рекомендации пациентам сипинговых питательных смесей следует разъяснять, что поглощать их нужно небольшими глотками. Некоторые этого не понимают, выпивают всю бутылочку 125 г, после чего жалуются на диарею. Также ошибочно считать, что проблему с питанием можно закрыть только готовыми питательными смесями. Пациент должен жевать, это важный момент в здоровом пищеварении».
Варвара Веретюк:
По поводу приема витаминных добавок рекомендации всех профессиональных сообществ — и отечественных, и зарубежных — сходятся на том, что пациентам, которые находятся либо прошли терапию рака, не нужно принимать добавки, а следует получать питательные вещества из пищи там, где это возможно.
По показаниям можно назначать витамины и минералы в дозах, соответствующих рекомендуемой суточной норме. Не следует использовать высокие дозы микронутриентов при отсутствии конкретных дефицитов. Если пациент поступает после длительного голодания, неадекватного питания, с явными признаками рефидинг-синдрома, целесообразен прием витамина В1 в дозе 200–300 мг/сут, а также сбалансированного комплекса микроэлементов.
Следует контролировать и при необходимости восполнять калий, фосфат, магний. При выявлении анемии всегда следует выяснить, точно ли она железодефицитная.
Контроль нутритивного статуса для пациентов после лечения рака в т. ч. после гастрэктомии:
- общий анализ крови;
- биохимический анализ крови (общий белок, альбумин, АЛТ, АСТ, билирубин общий и прямой, щелочная фосфатаза, ГГТ, глюкоза, мочевина, креатинин, мочевая кислота, общий холестерин, кальций, калий, натрий, хлор, фосфор, ферритин, железо, ОЖСС, ЛДГ) при каждом посещении;
- липиды крови каждые 6–12 месяцев в зависимости от риска;
- витамин В12 ежегодно, затем каждые 3–6 месяцев при приеме добавок, фолиевая кислота, витамин D;
- оценка тиамина;
- HbA1c, ТТГ в отдаленном периоде наблюдения;
- остеоденситометрия исходно и через 2 года.
По мнению эксперта, весьма актуальной является разработка программ подготовки терапевтов для долгосрочного ведения пациентов после завершения терапии рака.
