Технология высокопроизводительного секвенирования ДНК нового поколения (Next-generation sequencing, NGS) оказала значительное влияние на исследования в области молекулярной биологии и привела к новым научным идеям и открытиям, помогла определить генетическую причину многих заболеваний и персонализировать лечение пациентов.
История появления и развития метода
 Анжелика СолнцеваПроцесс определения точного порядка расположения нуклеотидов (A, G, C и T) в молекуле ДНК называют секвенированием. Первым методом, который ученые сумели применить для определения нуклеотидной последовательности ДНК, стало секвенирование по Сэнгеру. Это полностью автоматизированный процесс, который выполняется на специальных приборах — секвенаторах. Метод используется для целенаправленного повторного секвенирования в исследовательских и клинических лабораториях. Именно при помощи этого метода был впервые расшифрован геном человека.
Анжелика СолнцеваПроцесс определения точного порядка расположения нуклеотидов (A, G, C и T) в молекуле ДНК называют секвенированием. Первым методом, который ученые сумели применить для определения нуклеотидной последовательности ДНК, стало секвенирование по Сэнгеру. Это полностью автоматизированный процесс, который выполняется на специальных приборах — секвенаторах. Метод используется для целенаправленного повторного секвенирования в исследовательских и клинических лабораториях. Именно при помощи этого метода был впервые расшифрован геном человека.
Секвенирование по Сэнгеру является золотым стандартом для подтверждения последовательностей ДНК. Однако сегодня эффективность этого метода приблизилась к своему пределу и дальнейшее его использование считается затратным по времени и стоимости.
 Екатерина ПоляковаНедавние значительные достижения в области молекулярной биологии позволили решить данную проблему. Это привело к развитию технологии высокопроизводительного секвенирования нового поколения (NGS).
Екатерина ПоляковаНедавние значительные достижения в области молекулярной биологии позволили решить данную проблему. Это привело к развитию технологии высокопроизводительного секвенирования нового поколения (NGS).
Возможности NGS в медицине
Большими преимуществами NGS-секвенирования является высокая производительность и меньшие требования к качеству биологических образцов по сравнению с секвенированием по Сэнгеру. В настоящее время в учреждениях здравоохранения используются различные технологии NGS в зависимости от цели исследования (см. рисунок). Это может быть полногеномное секвенирование (Whole genome sequencing, WGS), полноэкзомное (Whole exome sequencing, WES), панельное (таргетное), метагеномное, а также РНК-секвенирование. Использование технологии NGS в медицине повышает качество диагностики заболеваний и позволяет определить молекулярные таргетные препараты для индивидуального лечения конкретного пациента.
Рисунок. Методы высокопроизводительного секвенирования
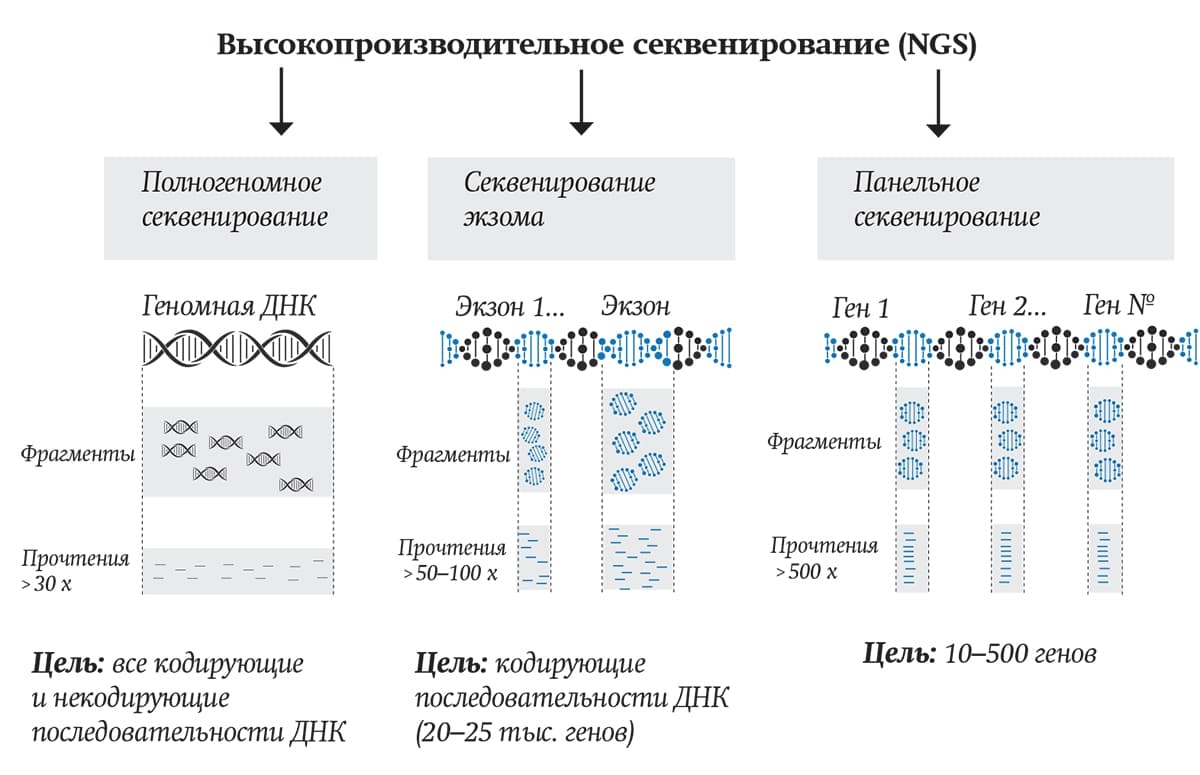
![]() Екатерина СкоповецПолногеномное секвенирование (WGS) дает возможность оценить нуклеотидную последовательность ДНК человека, включая как белок-кодирующие участки (экзом), так и некодирующие участки. Эта технология характеризуется высокой стоимостью проводимого анализа и требует наличия дорогостоящего оборудования.
Екатерина СкоповецПолногеномное секвенирование (WGS) дает возможность оценить нуклеотидную последовательность ДНК человека, включая как белок-кодирующие участки (экзом), так и некодирующие участки. Эта технология характеризуется высокой стоимостью проводимого анализа и требует наличия дорогостоящего оборудования.
Полноэкзомное секвенирование (WES) позволяет определить нуклеотидную последовательность ДНК только кодирующих участков (экзонов). Это составляет около 2 % генома человека и, следовательно, дает возможность углубленно проанализировать нуклеотидную последовательность ДНК только этих регионов. Данный метод представляет собой более экономичный вариант секвенирования по сравнению с полногеномным, хотя характеризуется меньшим объемом получаемой информации.
Обе технологии выполняются на специальных приборах для секвенирования, которые используют образцы биоматериала пациента для перевода биологической информации в цифровую последовательность нуклеотидов. Нуклеотидные последовательности, соответствующие ДНК пациента, затем можно проанализировать и изучить с помощью специальных биоинформационных методов анализа для обнаружения мутаций.
Панельное (таргетное) секвенирование генов является важным инструментом для диагностики многих заболеваний. Таргетные панели содержат выбранный набор генов или областей генов, которые известны или предположительно связаны с конкретным заболеванием или фенотипом. Применение данной методики секвенирования, например, незаменимо в диагностике врожденных ошибок иммунной системы: панель для секвенирования содержит 290 генов, ассоциированных с данными заболеваниями.
РНК-секвенирование, в отличие от методов секвенирования ДНК, позволяет измерить экспрессию генов, обнаружить точечные мутации и небольшие вставки. Кроме того, полученная информация может быть использована для прогнозирования реакции пациента на конкретное лечение.
Метагеномное секвенирование дает возможность всесторонне исследовать генетическую информацию всех организмов, присутствующих в образце, например, оценить бактериальный состав микробиоты кишечника, кожи или легких в организме человека. Метагеномное секвенирование предоставляет лучший метод для анализа некультивируемых микроорганизмов.
В клинической практике с помощью метагеномного секвенирования можно определить дисбиотические состояния у пациентов с различными заболеваниями и скорректировать назначенные схемы лечения. Эта технология дает полезную информацию для сравнительной характеристики микробиома в здоровом и болезненном состоянии или до и после лечения, например, после трансплантации фекальной микробиоты. Благодаря метагеномному секвенированию стало возможным персонализированное лечение инфекционных заболеваний.
Опыт применения NGS-секвенирования в РНПЦ ДОГИ
В области онкологии и онкогематологии. Ключевым событием в развитии и последующей эволюции опухолевого клона при солидных и онкогематологических заболеваниях является нарушение нормального функционирования генетического аппарата клетки, причиной которого могут быть структурные (хромосомные аберрации, точечные мутации) и регуляторные (изменения активности генов) аномалии.
Определение соматических и врожденных мутационных изменений в опухолевых клетках позволяет решить ряд задач на различных этапах терапевтического процесса:
- диагностика наследственных/врожденных синдромов с предрасположенностью к развитию злокачественных новообразований (синдром Линча, синдром Ли-Фраумени, СEBPA-ассоциированные наследственные формы острого миелобластного лейкоза (ОМЛ);
- определение генетического подтипа опухоли (саркомы, ОМЛ), определение терапевтической стратегии на основании риск-адаптированной терапии (лимфо- и миелопролиферативные заболевания, нейробластома, аденокарцинома легких);
- использование таргетных препаратов (вемурафениб при BRAF V600E-позитивной меланоме);
- выявление резистентных форм (мутации гена B2M при иммунотерапии меланомы).
На базе РНПЦ ДОГИ с использованием технологии высокопроизводительного секвенирования проводится диагностика опухолей головного мозга, рабдомиосаркомы и ОМЛ. Применяется диагностическая панель для врожденных и соматических мутаций при неопластических процессах миелоидного ростка кроветворения, которая включает 141 ген. Эти гены играют решающую роль в процессах злокачественной трансформации при миелоидных неоплазиях и выступают в качестве ключевых диагностических и прогностических биомаркеров ОМЛ (CEBPA, WT1, NPM1, RUNX1, ASXL1 и др.). Кроме того, в используемую диагностическую панель включены гены, ассоциированные с синдромами предрасположенности к развитию ОМЛ, такими как синдром Блума (BLM), синдром Нунана (PTPN11, NRAS, KRAS), синдром Ли-Фраумени (TP53, CHEK2), тяжелая врожденная нейтропения (ELANE, CSF3R) и другие.
Специалистами РНПЦ ДОГИ выполнена диагностика для 109 пациентов с ОМЛ. Выявленные соматические мутационные изменения использованы для разработки метода клон-специфического мониторирования минимальной остаточной болезни при ОМЛ у детей и внедрены в работу клинических отделений центра.
В области врожденной иммунопатологии. Врожденные ошибки иммунитета (ВОИ), или первичный иммунодефицит (ПИД), представляют собой гетерогенную группу заболеваний, обусловленных генетическими поломками в 485 генах, участвующих в иммунных реакциях. Помимо тяжелых инфекционных болезней у пациентов с ВОИ отмечается повышенный риск развития аутоиммунных и онкологических заболеваний. Врожденная иммунопатология является одной из основных причин детской инвалидности и смертности.
Вариации генотипа и фенотипа ВОИ с атипичными клиническими проявлениями делают диагностику еще более сложной, т. к. генетические дефекты в одном и том же гене могут приводить к различным клиническим проявлениям. Часто клинико-лабораторные признаки недостаточно специфичны, что не всегда позволяет с уверенностью установить правильный диагноз. Применение секвенирования нового поколения позволяет упростить диагностический поиск, получить дополнительную информацию о носительстве патогенных мутаций, повышенном риске каких-либо заболеваний и т. д. Ранняя диагностика ВОИ имеет решающее значение для назначения своевременного лечения и улучшения качества жизни пациентов.
На базе РНПЦ ДОГИ с использованием технологии высокопроизводительного секвенирования нового поколения успешно проводится диагностика врожденной патологии иммунной системы. Для установления генетической причины используется таргетная панель, состоящая из 290 генов, ассоциированных с ВОИ. Это позволяет с высокой эффективностью установить истинную причину врожденных иммунологических нарушений.
Таким образом, применение секвенирования нового поколения стало значительным технологическим прорывом в практике диагностической и клинической медицины. Данные, полученные с помощью этой технологии, обеспечивают точную идентификацию биомаркеров заболевания, выявление наследственной патологии и генетических факторов, которые могут быть использованы в области персонифицированной терапии.
