В последние 5–7 лет появилось много научных публикаций, посвященных проблемным аспектам в лечении сахарного диабета у взрослых. Большой резонанс вызвала опубликованная в 2019 году статья о том, что иммунные формы сахарного диабета (СД 1-го типа) могут регистрироваться у лиц старше 40 лет, а не только до 25–30 лет, как считалось ранее. В последующие годы в различных исследованиях изучались патогенетические механизмы и были выявлены подтипы сахарного диабета, при которых аутоиммунные процессы, поражение клеток поджелудочной железы и недостаточная выработка инсулина (признаки СД 1-го типа) сочетаются с инсулинорезистентностью (характерный признак СД 2-го типа).
 В настоящее время продолжается поиск оптимальных критериев реклассификации сахарного диабета, поскольку установление подтипа играет ключевую роль в выборе оптимальной персонифицированной терапии и достижении более эффективных результатов лечения. Об этом на прошедшем вебинаре рассказала заведующая кафедрой клинической эндокринологии ИПКиПКЗ БГМУ, доктор мед. наук, профессор Лариса Данилова.
В настоящее время продолжается поиск оптимальных критериев реклассификации сахарного диабета, поскольку установление подтипа играет ключевую роль в выборе оптимальной персонифицированной терапии и достижении более эффективных результатов лечения. Об этом на прошедшем вебинаре рассказала заведующая кафедрой клинической эндокринологии ИПКиПКЗ БГМУ, доктор мед. наук, профессор Лариса Данилова.
Необходимость реклассификации
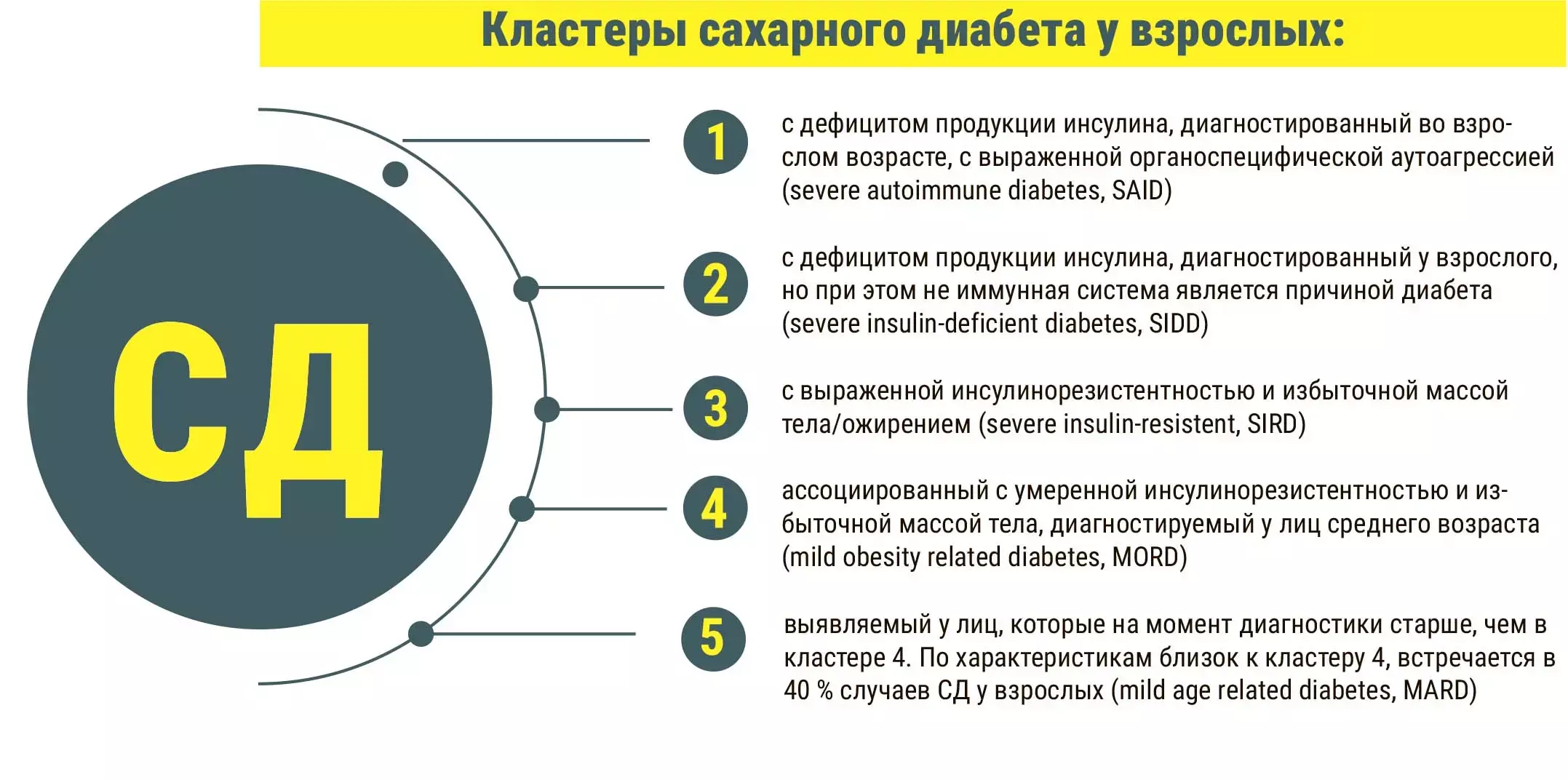
В начале своего выступления Лариса Данилова подчеркнула, что сахарный диабет — это не одно гомогенное заболевание, а множество заболеваний, объединенных общей чертой — гипергликемией. Впервые такую формулировку предложил Дэвид Лесли в 2016 году. В 2019-м ВОЗ предложила выделять подтипы диабета у взрослых, при которых аутоиммунные процессы сочетаются с инсулинорезистентностью. Специалисты ряда европейских стран пытались сформулировать критерии и проанализировать соотношение разных подтипов диабета, характерных для европейской популяции. Так, Emma Ahlqvist с соавторами (Швеция, 2020) выделили 5 подтипов, полученных путем кластеризации на основе клинико-лабораторных параметров.
— Среди этих пяти кластеров два связаны с дефицитом продукции инсулина: первый (с иммунным поражением островковых клеток) и второй (с неиммунными причинами дефицита инсулина), — акцентировала внимание Лариса Данилова. — Правильная верификация кластера очень важна и влияет на выбор оптимальной персонифицированной терапии. Диагностическим инструментом для дифференциации инсулинодефицитного диабета и гиперинсулинемического диабета является оценка секреции инсулина.
Неотъемлемой частью классификации новых субфенотипов является определение секреции инсулина, основанной на выявлении С-пептида натощак и рассчитанной с помощью «модели оценки гемостаза 2» функции β-клеток (НОМА2-В). Субфенотип SAID характеризуется низкой секрецией инсулина (57±45). Клинически наиболее сложные субфенотипы SIDD и SIRD характеризуются низким (48±29, SIDD) или повышенным (150±47, SIRD) НОМА2-В.
Расчеты, которые использовала Emma Ahlqvist в своей работе, весьма трудоемки и редко применяются в практической медицине. Кроме того, измерение эндогенной секреции инсулина во многих центрах и странах до сих пор не стандартизировано и не очень хорошо сопоставимо между различными лабораториями.
— В 2020 году появилась публикация, показавшая, что соотношение С-пептид/гликемия натощак (CGR) на момент верификации диагноза является достаточно информативным методом, позволяющим оценить секреторную функцию β-клеток и продукцию ими инсулина, — сообщила Лариса Данилова. — Это соотношение по своей информативности приближается к индексам HOMA-B и HOMA2-B. При этом измерение С-пептида в сыворотке или плазме крови — метод надежный и хорошо стандартизированный. Соотношение С-пептид/гликемия натощак может помочь в практической работе диабетологов. На начальном cкрининговом этапе у взрослых пациентов расчет CGR позволяет классифицировать диабет с дефицитом продукции инсулина и подтипы диабета взрослых, при которых нет дефицита инсулина.
Соотношение С-пептид/гликемия натощак
Один из ключевых вопросов после постановки диагноза диабета: нужен ли инсулин? Такое решение должно быть в начале фармакологической терапии диабета или, что еще важнее, при коррекции терапии у пациента с неадекватным гликемическим контролем.
— Основные формы дефицита инсулина у взрослых — аутоиммунный диабет (SAID) и неиммунный диабет с дефицитом продукции инсулина (SIDD) — требуют заместительной терапии инсулином, и очень важно, чтобы старт инсулинотерапии не запаздывал, — подчеркнула Лариса Данилова. — Определив уровень С-пептида (пмоль/л) и глюкозы (мг/дл) и рассчитав соотношение С-пептид/гликемия натощак, мы можем выделить пациентов, у которых, безусловно, должна стартовать инсулинотерапия, и тех пациентов, которым в данный момент (процедуры верификации типа диабета) необязательно стартовать с инсулинотерапии и можно использовать другие глюкозокорригирующие подходы. Авторы публикации, согласно проведенным ими расчетам, предложили «отсекающее» значение, равное 2. Это соотношение оказалось информативным.
Применяя в практической деятельности соотношение CGR, необходимо учитывать следующие моменты:
- пациент с HbA1c (гликированный гемоглобин) выше целевого значения (>6,5%) и CGR<2 демонстрирует лабораторные критерии дефицита инсулина, следовательно, должен лечиться инсулином;
- ни один человек с нормальной толерантностью к глюкозе, предиабетом или недавно диагностированным СД 2-го типа не демонстрирует CGR<2;
- пациенты с СД 1-го типа (среди них недавно диагностированные в стадии ремиссии) демонстрируют медианный CGR ниже 1;
- CGR ниже 2 соответствует HOMA2-B — 50 (в диапазоне SAID и SIDD в классификации Ahlqvist et al., 2018);
- чем ниже соотношение CGR, тем выше вероятность того, что пациенту потребуется инсулинотерапия.
— Соотношение С-пептид/гликемия натощак, согласно мнению авторов публикации, также помогает выделить пациентов, которым необязательно потребуется лечение инсулином, поскольку у них наблюдается нормальная секреция инсулина или даже гиперсекреция, — отметила Лариса Данилова. — Для этого предлагается пороговое значение 5. Аргументом в пользу такого утверждения является тот факт, что медиана соотношения CGR натощак в популяции здоровых людей среднего возраста составляет 5,3.
Специалист обратила особое внимание на то, что CGR натощак может быть неточным при нарушении функции почек, поэтому его не следует использовать у пациентов с СКФ ниже 50 мл/мин/1,73 м2. Также не рекомендуется рассчитывать и применять CGR у пациентов в состоянии тяжелой метаболической декомпенсации, поскольку глюкотоксичность может остро, но обратимо нарушать секрецию инсулина.
Лариса Данилова ознакомила участников вебинара с предлагаемой европейскими специалистами концепцией выбора обоснованной патофизиологической терапии диабета.
Шаг 1. Определение CGR и разделение пациентов на три группы: CGR<2 — требуется инсулинотерапия, части пациентов — базис-болюсная инсулинотерапия; CGR>2 и <5 — базальный инсулин + антигипергликемические препараты, для решения вопроса об инсулинотерапии перейти к шагу 2; СGR<5 — инсулинотерапия в данный момент не требуется, назначаются антигипергликемические препараты.
Шаг 2. Повышены ли кардиоваскулярные риски у пациента? Исходя из этого дополнительно к инсулинотерапии взрослым пациентам с CGR<2 возможно назначение ингибиторов натрий-глюкозного котранспортера или агонистов рецепторов глюкогоноподобного пептида 1. При CGR>2 могут рассматриваться ингибиторы DPP-4, ингибиторы натрий-глюкозного котранспортера 2-го типа. Многие страны сохранили в схемах глюкозокорригирующей терапии глитазоны, а также производные сульфонилмочевины.
Шаг 3. Возраст пациента. Лицам старшего возраста с нормальными значениями гликированного гемоглобина: при СGR<2 необходима инсулинотерапия, при CGR>2 нет необходимости в обязательной инсулинотерапии, применяют другие глюкозокорригирующие подходы.
Проблемы аутоиммунного диабета у людей старшего возраста
Одна из мировых тенденций последних лет — рост числа впервые диагностированных случаев иммунных форм сахарного диабета у взрослых, при которых присутствуют определенные иммунные сигнатуры, такие как аутоантитела, специфичные к островкам β-клеток поджелудочной железы.
Лариса Данилова:
Исследования с оценкой полигенных факторов риска показывают, что 42 % всех новых проявлений аутоиммунного диабета возникают после 30 лет. При этом лишь 38 % взрослых с впервые диагностированным СД 1-го типа получают инсулинотерапию немедленно из-за того, что им ошибочно выставляют иной тип сахарного диабета либо иной кластер сахарного диабета.
— Это подчеркивает важность выявления дефицита инсулина, присутствующего при позднем аутоиммунном диабете взрослых, поскольку отсутствие своевременного начала инсулинотерапии и/или неадекватная терапия с использованием агентов, способствующих кетоацидозу, таких как ингибиторы SGLT2, может иметь фатальные последствия для пациентов с СД 1-го типа, — сообщила Лариса Данилова.
Еще одна проблема: у пациентов, которым в детстве диагностируют инсулинозависимый СД 1-го типа, на самом деле может быть моногенный диабет (известный как диабет зрелого возраста у молодых, MODY) или даже СД 2-го типа. В обзоре научных статей, приведенных Ларисой Даниловой, отмечается, что некоторые моногенные типы диабета очень долго могут не быть классифицированы правильно, не верифицированы. Описываются случаи тяжелой гипогликемии на инсулинотерапии у пожилых лиц, которым далее были выполнены молекулярно-генетические исследования и верифицированы неонатальные формы моногенного СД и формы диабета MODY.
Лариса Данилова:
Парадоксально, что до сих пор как в Беларуси, так и в других странах инсулинотерапия основывается лишь на субъективном мнении врача/пациента и желании/нежелании пациента начинать инсулинотерапию.
— Современный подход с выделением пяти подтипов СД у взрослых подразумевает, что потребность в инсулинотерапии не только стратегия лечения, но и диагностический критерий кластеров СД взрослых (при наступлении 6 месяцев после постановки диагноза), и основание для дополнительного обследования на предмет иммуноопосредованного сахарного диабета взрослых (при наступлении 3 лет после постановки диагноза), — сообщила Лариса Данилова.
Специалист также напомнила, что в ряде ситуаций возникает временная потребность в инсулинотерапии даже у пациентов с СД 2-го типа, особенно на фоне тяжелых соматических заболеваний. Кроме того, по мере эволюции СД 2-го типа и накапливания нарушений в процессах апоптоза инсулинотерапия защищает остаточный пул β-клеток. Независимо от своего воздействия на гликемический контроль, инсулин обладает противовоспалительными и антиоксидантными свойствами, которые могут помочь защитить от эндотелиальной дисфункции и повреждений, приводящих к сосудистым заболеваниям.
Моногенный диабет
Возникает в результате одного или нескольких дефектов одного гена или хромосомного локуса. Может наследоваться в семьях как доминантный, рецессивный или неменделевский признак либо проявляться как спонтанный случай вследствие мутации de novo. Выделяют следующие формы моногенного диабета: неонатальный; MODY; связанный с экстрапанкреатическими особенностями; синдромы моногенной инсулинорезистентности.
— Такие случаи встречаются в нашей практике, их немного, но они есть, — рассказала Лариса Данилова. — Моногенные формы СД, как правило, стартуют в детском возрасте, но часто остаются неверно классифицированными, и пациент живет с неверным диагнозом (СД 1-го или 2-го типа). Например, такая форма моногенного диабета, как неонатальный диабет, часто дебютирует в первые полгода жизни. При неверно поставленном диагнозе, отсутствии верификации с помощью молекулярно-генетических исследований во взрослом состоянии такие пациенты часто дают тяжелые гипогликемические реакции. Верификация диагноза и назначение производных сульфонилмочевины у таких пациентов весьма эффективно минимизирует гипогликемические реакции и улучшает качество жизни. Поэтому важно уточнять семейный анамнез, условия старта диабета и принимать решения о целесообразности реклассификации и верификации типа СД.
Клинические характеристики MODY:
- наличие транзиторной неонатальной гиперинсулинемической гипогликемии;
- семейный анамнез диабета, родители имели MODY;
- диабет с ранним началом в подростковом и юношеском возрасте (обычно в возрасте менее 35 лет, чаще до 25 лет);
- особенности, нетипичные для СД 1-го типа, в т. ч. отсутствие панкреатических аутоантител, особенно на момент постановки диагноза;
- низкая потребность в инсулине для лечения (например <0,5 ЕД/кг/сут), доказательства продукции инсулина вне фазы «медового месяца» (спустя более 3–5 лет после постановки диагноза диабета) с определяемым С-пептидом (>0,6 нг/мл или >200 пмоль/л) при уровне глюкозы >72 мг/дл или >4 ммоль/л, который будет сохраняться более 3–5 лет;
- отсутствие кетоацидоза при исключении инсулина из лечения.
Наиболее распространенным вариантом легкой стабильной гипергликемии натощак является GCK-MODY (обусловленная мутацией гена гексокиназы). Установление верного диагноза в подобных случаях очень важно, поскольку у таких пациентов гипергликемия не прогрессирует, не развиваются осложнения, нет ответа на низкие дозы инсулина или пероральные препараты. Такие пациенты не должны получать лечение.
Для оценки вероятности моногенного диабета MODY и СД 1-го типа специалист порекомендовала калькулятор.
Анти-островковые аутоантитела
Много дискуссий в диабетологических и эндокринологических сообществах посвящено медленно прогрессирующему аутоиммунному диабету со стартом во взрослом возрасте — LADA, включающему состояния с позитивностью анти-островковых аутоантител. Общество по иммунологии диабета (IDS) указывает следующие критерии: 1) начало диабета после 35 лет, 2) позитивность по любому из известных анти-островковых антител, 3) необходимость в инсулинотерапии в течение более 6 месяцев после постановки диагноза диабета.
— Концепция LADA, которой уже более 15 лет, сейчас активно пересматривается, — сообщила Лариса Данилова. — Японские коллеги предлагают расширить спектр определения аутоантител к β-клеткам, включая антитела к транспортеру цинка, к инсулин-ассоциированному антигену и др. Разумеется, чем больше типов аутоантител верифицировано, тем более точный диагноз выставляется пациенту.
Удивительные исследования, на которые обращают внимание все диабетологи, — выявление островковых аутоантител у пациентов с клиническим диагнозом СД 2-го типа. Число таких пациентов варьирует от 5 % до 10 % в Исландии, до 12 % в Великобритании.
Согласно гистоморфологическим исследованиям с использованием маркера СD45, оказалось, что у одного и того же пациента есть уничтоженные островки β-клеток за счет иммунного воспаления, а есть нормально функционирующие. Продолжается поиск возможностей превенции, обратного развития и клеточной редифференцировки у пациентов с СД.
