Наличие большого выбора антибактериальных препаратов значительно расширяет возможности лечения, но одновременно требует от врача-клинициста глубоких знаний о свойствах антибиотиков, спектре действия, эффективности в отношении той или иной инфекции, побочных эффектах, возможном токсическом влиянии и взаимодействии с другими лексредствами.
 О наиболее частых ошибках при назначении антибиотиков врачами амбулаторного звена рассказал директор РНПЦ медтехнологий, информатизации, управления и экономики здравоохранения, профессор кафедры кардиологии и внутренних болезней БГМУ Дмитрий Рузанов на прошедшей республиканской научно-практической конференции с международным участием «Общая врачебная практика: вчера, сегодня, завтра».
О наиболее частых ошибках при назначении антибиотиков врачами амбулаторного звена рассказал директор РНПЦ медтехнологий, информатизации, управления и экономики здравоохранения, профессор кафедры кардиологии и внутренних болезней БГМУ Дмитрий Рузанов на прошедшей республиканской научно-практической конференции с международным участием «Общая врачебная практика: вчера, сегодня, завтра».
Ошибка № 1
Антибиотики как средство лечения симптомов или профилактики бактериальной инфекции
По словам спикера, часто антибиотики назначаются на основании наличия симптомов, например, кашля или лихорадки, а не на основании диагностированной или предполагаемой бактериальной инфекции. Еще одна распространенная ситуация — когда врач выписывает антибиотики пациенту с ОРВИ в качестве профилактики присоединения бактериальной инфекции.
Дмитрий Рузанов:
Сегодня принята презумпция неназначения антибиотиков. Они отнюдь не являются безопасными препаратами. Без четких показаний, очевидных признаков бактериальной инфекции антибиотик может нанести больше вреда, чем принести пользы, и конкретному пациенту, и обществу в целом.
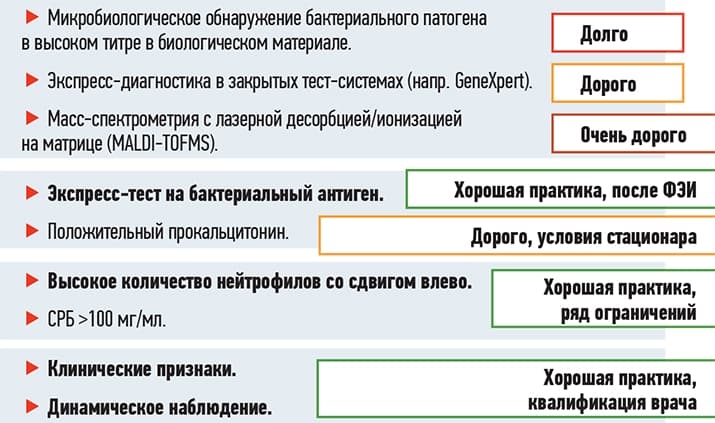
Существуют различные диагностические методы детекции бактериологического возбудителя (см. рис. 1). Часть из них длительны по времени (например, микробиологический посев), другие — точные, быстрые, но крайне дорогостоящие (масс-спектрометрия), некоторые тоже недешевы и используются в условиях стационара (прокальцитонин).
Рисунок 1. Диагностические критерии бактериальной инфекции.
Дмитрий Рузанов:
В большинстве случаев врачу приходится полагаться на свой опыт и мастерство при диагностике бактериальной инфекции. Это во многом определяется клиническими признаками и динамическим наблюдением за пациентом. Общий анализ крови имеет недостаточную специфичность и чувствительность в отношении диагностики бактериальной этиологии инфекции.
Среди недооцененных в амбулаторной практике, но при этом чувствительных и недорогих диагностических методов можно отметить определение С-реактивного белка: если показатель больше 100 мг/мл — с высокой вероятностью это бактериальная инфекция, требующая неотложного назначения антибиотика, а снижение СРБ скажет об эффективности антибиотика.
Как определить, нужен ли пациенту антибиотик? В первую очередь следует исключить те диагнозы, которые требуют их обязательного и неотложного приема: пневмонию, острый стрептококковый тонзиллит (ангину), острый гнойный средний отит, гнойный риносинусит. И это может каждый врач общей практики. Нужны стетоскоп, шпатель и отоскоп. Услышали бронхиальное дыхание или хрипы — сделайте обзорный снимок легких.
Исключив эти четыре патологии, можно продолжить динамическое наблюдение без антибиотика. Конечно, стоит учитывать и эпидемиологическую ситуацию, например, подъем заболеваемости гриппом, привит ли пациент, сведения о предшествующих назначениях антибиотика, наличие факторов риска антибиотикорезистентности.
Дмитрий Рузанов:
Важно обращать внимание и на факторы риска и коморбидность пациента. Чем она выше, тем больше вероятность бактериальной инфекции, тем выше риски устойчивости к стартовым антибиотикам. Возможна гипердиагностика «гнойности» выделений.
Например, ряд аллергических заболеваний могут давать характерный желтоватый цвет выделений слизи как из бронхиального дерева, так и из верхних дыхательных путей. К 5–7-му дню риновирусной инфекции слизь может окрашиваться омертвевшими клетками эпителия. И наоборот, иммунокомпрометированные сопутствующими заболеваниями пациенты могут иметь стертые клинические симптомы бактериальной инфекции, подострое начало и невысокую лихорадку.
Стадийность течения респираторной инфекции в целом характерна как для вирусной, так и для бактериальной. И здесь много заблуждений. Например, так называемое правило третьего дня, когда антибиотик назначают на 3-и сутки заболевания при сохранении повышенной температуры, нерационально. Почему? Потому что большинство вирусов (аденовирус, парагрипп, РСВ, метапневмовирус) сопровождаются лихорадкой в течение недели, их часто и называют семидневными. Снижаться температура начинает с 4–5-го дня и нормализуется к 7-му. В итоге — череда совпадений: на 3–4-й день назначаются антибиотики, а через день температура снижается. Но это не заслуга антибиотика, а естественное течение вирусной инфекции. Наиболее частый «трехдневный» вирус — риновирус, когда действительно к 3-му дню субфебрильная температура возвращается в норму и пациента чаще всего минует участь принимать антибиотик.
Дмитрий Рузанов:
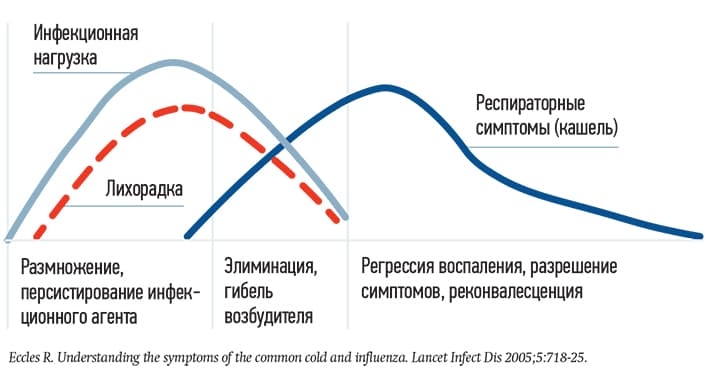
Еще одна частая причина избыточного использования антибиотика — когда кашель при вирусных инфекциях появляется через несколько дней после лихорадки и к 7-му дню усиливается, достигая своего пика, а температура обычно к этому времени уже нормализуется (см. рис. 2).
Часто именно в этот момент и начинают прием антибиотика или его замену («Пациенту стало хуже, у него нарастает кашель, инфекция прогрессирует…»). Вместе с тем, как правило, кашель самостоятельно начинает стихать и проходит в течение одной-двух недель. Такой кашель и называют постинфекционным.
Но в случае назначения в этот период антибиотика появляется ошибочное мнение, что сработал именно антибактериальный препарат. Поэтому стоит помнить об этапности развития респираторной инфекции. При сборе анамнеза важно понимать, в какой патогенетической фазе находится пациент, чтобы прогнозировать дальнейшее течение, выбрать лечение и исключить избыточное назначение антибиотиков, — уверен эксперт.
Рисунок 2. Патогенез и симптоматика ОРВИ.
Изменилось отношение и к профилактическому использованию антибиотиков на фоне вирусной инфекции («А вдруг пневмония присоединится?»). Исследования в области детекции некультивируемых микроорганизмов позволили открыть и говорить еще об одном органе нашего тела — микробиоме, в том числе респираторном. Да, нижние дыхательные пути далеко не стерильны, как нас когда-то учили! Они заселены микробами, грибами, вирусами, которые регулируют иммунитет и защищают от патогенных микроорганизмов. Соответственно, антибиотики способны нарушить это равновесие.
Другими словами, поясняет Дмитрий Рузанов, антибиотики способны повысить вероятность присоединения бактериальной инфекции, даже если ее не было.
Ошибка № 2
Назначение антибиотиков с избыточно широким спектром действия
Неверно полагать, что чем шире спектр действия у препарата, тем лучше. И другая крайность — когда назначаются антибиотики, у которых нет активности в отношении, например, респираторных патогенов.
«Нереспираторные» антибиотики:
- Фторхинолоны 2-го поколения
- Ко-тримоксазол
- Аминогликозиды
- Цефалоспорины 1-го поколения
- Эритромицин
Дмитрий Рузанов:
Существует широкий гипотетический спектр респираторных инфекций, которые могут быть у пациента. Но на практике для амбулаторной инфекции актуальны лишь несколько возбудителей: пневмококк, гемофильная палочка, моракселла, пиогенный стрептококк и микоплазма, совсем редко — стафилококк. Все остальное обычно удел госпитальных тяжелых инфекций. Соответственно, и антибиотики в этом случае понадобятся другие, а если они не сработают по причине резистентности, пациент погибнет. Поэтому мы и должны ограничить их широкое использование, не стрелять, как говорится, из пушки по воробьям.
Если проанализировать клинические руководства по лечению респираторных бактериальных инфекций — белорусские, российские, китайские, австралийские, европейские, — везде стартовым препаратом для антибиотикотерапии будет амоксициллин. Как при гнойном среднем отите, так и при бактериальном риносинусите или инфекции нижних дыхательных путей. И это обосновано и рационально. Цефалоспорины 1-го поколения или фторхинолоны 1–2-го поколения не имеют антипневомококковой активности. А, например, у левофлоксацина с его широчайшим спектром активности есть все шансы уничтожить микробиом, в том числе респираторный.
Все существующие современные рекомендации предлагают придерживаться ключевого принципа антибиотикотерапии — принципа минимальной достаточности. То есть уничтожить только наиболее вероятного возбудителя, не затрагивая микробиом. Важно учитывать бактерицидную активность препарата, его токсичность, биодоступность и концентрацию непосредственно в слизистой.
Ошибка № 3
Необоснованное назначение парентерального антибиотика для лечения нетяжелых инфекций или препарата с низкой биодоступностью
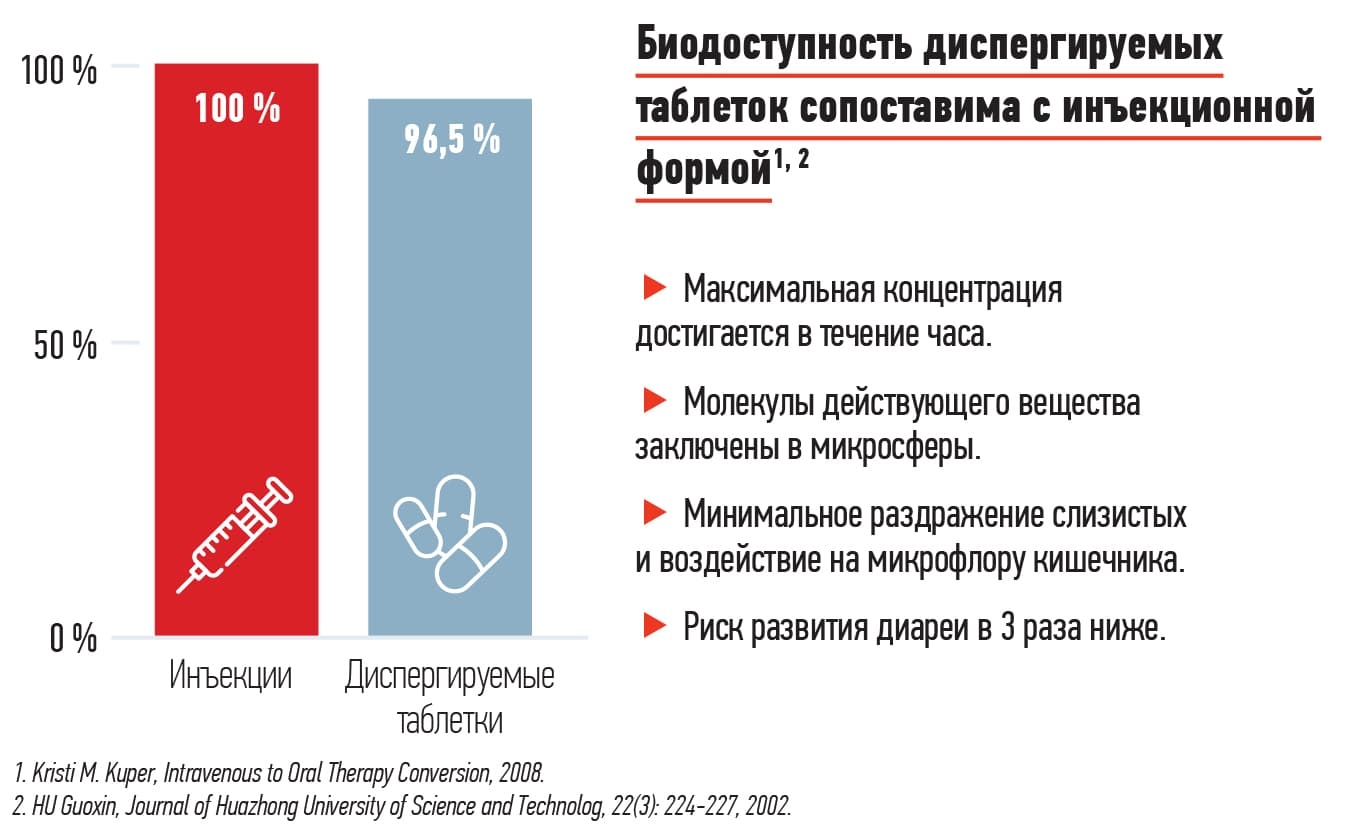
Целый ряд исследований показал, что нет никаких принципиальных отличий между назначением препарата с адекватной биодоступностью и внутривенных или внутримышечных лекарственных средств у пациента с нетяжелым течением инфекции. Тем более многие антибиотики сегодня имеют диспергируемые формы (см. рис. 3).
Рисунок 3. Биодоступность диспергируемых таблеток.
Дмитрий Рузанов:
Диспергируемые таблетированные антибиотики имеют близкую к 100 % биодоступность, создают низкую концентрацию в просвете кишечника, а значит меньше влияют на кишечную микрофлору.
Пример нерационального выбора антибиотика для лечения респираторной инфекции — пероральный ампициллин (см. рис. 4). Его биодоступность составляет не более 40 %, а при приеме с пищей — лишь 15–20 %. Вроде название созвучное, тоже аминопенициллин и спектр активности такой же, как и у амоксициллина, но тем не менее его не стоит применять в лечении респираторных инфекций из-за низкой биодоступности, подчеркнул специалист.
Рисунок 4. Нерациональный выбор антибиотика для лечения респираторной инфекции.

Ошибка № 4.
Погрешности в дозировании и кратности приема антибиотиков
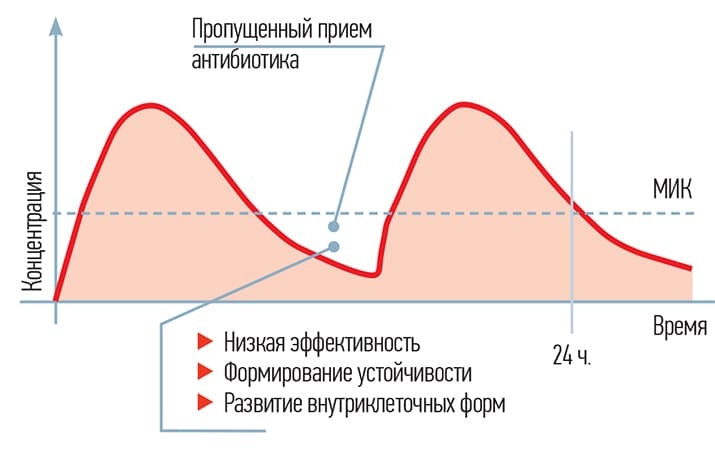
Следует также помнить о фармакокинетической кривой. Большую часть времени она должна быть выше минимальной ингибирующей концентрации. Что происходит, когда она снижается? В первую очередь, что наиболее нежелательно, формируется устойчивость, нет должной эффективности, некоторые возбудители «сохраняются» внутриклеточно.
Дмитрий Рузанов:
Назначая амоксициллин по таблетке 3 раза в день, мы сохраняем концентрацию выше минимальной ингибирующей. Но стоит пациенту пропустить одну дозу, и концентрация снижается ниже минимальной ингибирующей. По данным исследований, пропуск третьего приема наблюдается почти в половине случаев. Через несколько дней такого приема возможна и отрицательная динамика из-за формирования устойчивости (см. рис. 5).
Двукратный прием лекарственных средств увеличивает приверженность пациента в сравнении с более частым. Как выход, допустимо назначать антибиотики в более высокой дозировке, например, амоксициллин по 1000 мг 2 раза в день. Ряд исследований демонстрируют меньшее количество клинических неудач в лечении инфекций при таком варианте дозы и кратности.
Рисунок 5. Фармакокинетическая кривая амоксициллина.
Ошибка № 5
Нерациональное назначение вместе с антибиотиком патогенетического лечения: избыточная противовоспалительная, иммуностимулирующая и отхаркивающая терапия
Нерациональной патогенетической терапией можно навредить. Пациент с респираторной инфекцией при повышении температуры практически всегда будет использовать аспирин, парацетамол или другие НПВС. Реклама настойчиво велит это делать!
Но воспаление при респираторном заболевании спасает жизнь пациента, с его помощью организм борется с инфекцией (см. рис. 6).
Рисунок 6. Динамика нормальной воспалительной реакции — хорошее воспаление.
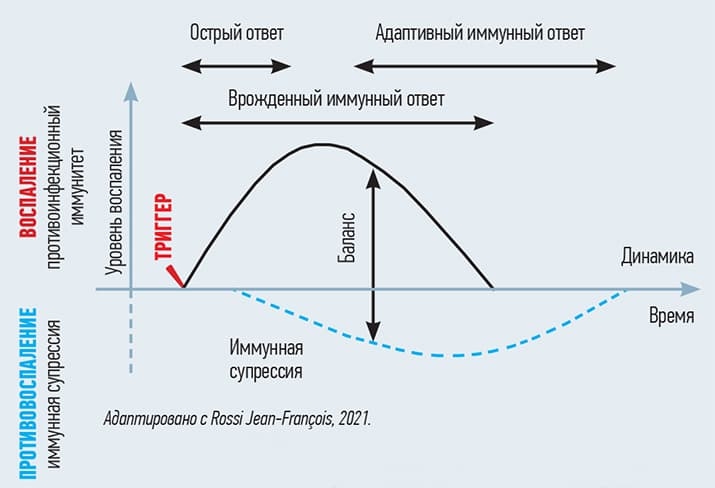
Противовоспалительные же препараты дают обратный эффект и нередко приводят к затяжному и осложненному течению инфекции. Рекомендация всем хорошо известна — если лихорадка не изнуряет пациента и не выше 38,5 °С, НПВС не используются при условии достаточной водной нагрузки.
Дмитрий Рузанов:
Есть хорошее воспаление, но есть и плохое (например, при коронавирусной инфекции в виде цитокинового шторма). Плохое воспаление может персистировать после перенесенной респираторной инфекции — у пациента продолжается лихорадка, сохраняются респираторные симптомы. Это нарушение баланса между про- и противовоспалительной реакцией (см. рис. 7).
Рисунок 7. Иммунный дисбаланс плохого воспаления.
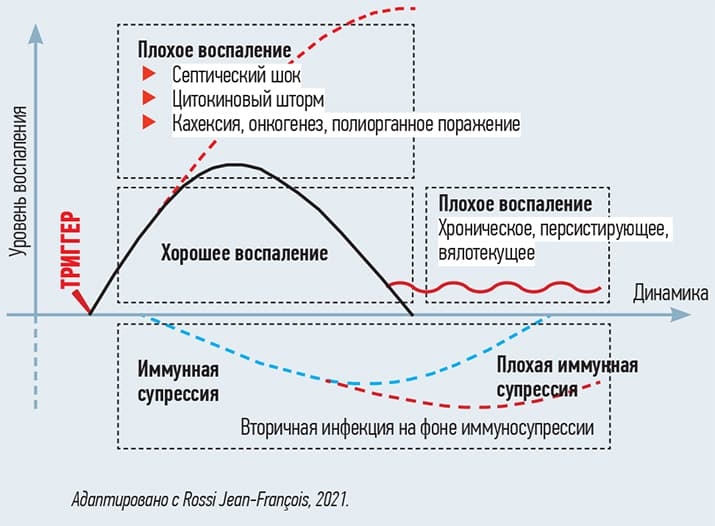
Но не нужно впадать и в другую крайность — рутинно стимулировать провоспалительную активность организма. Все постсоветское пространство, по словам Дмитрия Рузанова, отличается стремлением стимулировать иммунитет при инфекциях. Особенно в педиатрической практике.
Стоит ребенку пойти в садик, он абсолютно естественно, сталкиваясь с незнакомыми инфекциями, начинает болеть, у него формируется иммунитет, но тут на него обрушивается весь богатый арсенал фармацевтического рынка в виде иммуностимулирующей терапии. Растут и риски «расплаты» за эту провоспалительную активность — дебютом через несколько месяцев аллергических и аутоиммунных заболеваний.
Дмитрий Рузанов:
Я не хочу сказать, что такой вид терапии не должен применяться! Но вдумчиво, контролируемо и индивидуально, не забывая о балансе про- и противовоспалительной активности.
И в завершение часто используемая мукоактивная терапия. Самый простой анализ показывает, что лидерами продаж являются лекарственные средства на основе трав, рефлекторные отхаркивающие препараты.
Доказательства эффективности использования растительных экспекторантов отсутствуют, а побочные эффекты превышают возможную пользу.
Ситуация складывается следующая. К врачу приходит пациент с жалобами на сильный кашель с большим количеством выделяемой мокроты уже на протяжении нескольких недель. В анамнезе ОРИ. Доктор предполагает различные диагнозы, ломает голову, как лечить, не пора ли использовать антибиотики. А все очень просто! Пациент пошел в аптеку и купил «безопасные» растительные отхаркивающие, которые быстро «помогли» — мокроты стало много, правда, и кашель усилился, да еще и изжога появилась. Увы, это миф — чем больше мокроты, тем эффективнее «очищение».
ВОЗ в общеврачебной практике рекомендует при назначении антибиотиков в качестве мукоактивной терапии использовать ацетилцистеин. Этот препарат обладает целым рядом важных патогенетических эффектов, в том числе препятствует формированию биопленок.
- Ацетилцистеин обладает клинически значимыми антибактериальными свойствами.
- За счет предотвращения адгезии обладает профилактическими свойствами в отношении бактериальных инфекций.
- Синергизм при совместном использовании с антибиотиками.
Однако важно помнить об особенностях его использования.
Рекомендации по приему ацетилцистеина при ОРИ:
- Начинать в первый день острой респираторной инфекции, продолжительность от одной до четырех недель в дозе не менее 600 мг.
- Последний вечерний прием должен быть не позднее 18–19 часов для дополнительной активности по эвакуации секрета.
- Для улучшения дренажной функции бронхов через 60 минут после приема рекомендовать пациенту активно покашлять, провести дыхательную гимнастику.
- Показаны кинезотерапия, вибрационный массаж. Особенно их проведение важно у больных пожилого возраста со сниженным кашлевым рефлексом и у детей.
Вопрос от слушателей
«Амоксициллин или амоксиклав? Как в двух словах их разграничить и определить нишу для каждого?»
Д. Р.: Все просто: если в анамнезе были антибиотики последние 3 месяца, а также если это коморбидный пациент или возраст старше 60 лет, то стоит назначать амоксициллин, защищенный клавулановой кислотой. В остальных случаях достаточно амоксициллина (см. рис. 8).
Рисунок 8. Что выбрать: амоксициллин или амоксиклав?

Только цифры
Повлияла ли пандемия COVID-19 на потребление антибиотиков?
На этот вопрос Дмитрий Рузанов однозначно ответил положительно. В качестве примера привел такие данные: в 2021 году амбулаторное потребление антибиотиков выросло почти в 1,5 раза, а количество использованного азитромицина увеличилось в 3,4 раза. Естественно, рост потребления антибиотиков в популяции является риском роста антибиотикорезистентности. И общая задача — в постковидную эру вернуться на рельсы бережного и рационального отношения к антибиотикам.

