В течение двух последних десятилетий неотъемлемой частью диагностики и мониторинга онкогематологических заболеваний стали цитогенетические исследования, которые позволили выявлять хромосомные аномалии — ключевые маркеры для дифференциальной диагностики и классификации гемобластозов. Хромосомные и/или молекулярно-генетические перестройки играют определяющую роль в патогенезе острых и хронических лейкозов, лимфом и других болезней крови опухолевой природы. Они определяют биологические свойства опухолевых клеток и, соответственно, морфологические, иммунологические и клинические особенности самих заболеваний. Генетические изменения обычно представлены мутациями хромосомного типа и могут быть выявлены методами стандартной и молекулярной цитогенетики.
Хромосомные аномалии и методы их выявления
К основным типам хромосомных перестроек относятся транслокации, делеции, инверсии, инсерции и дупликации (см. рис. 1).
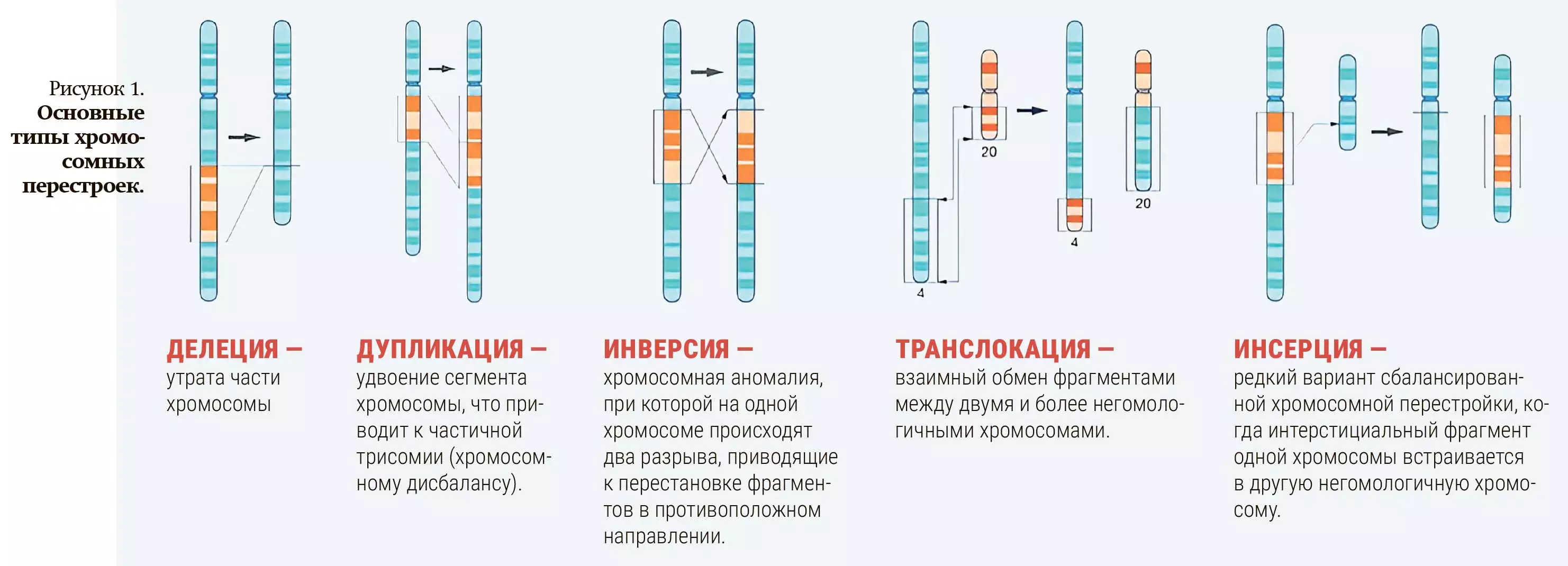
В настоящее время для выявления генетических перестроек у онкогематологических пациентов применяют широкий набор цитогенетических методов. Золотым стандартом является GTG-окрашивание — метод окраски хромосом, который используется для визуализации хромосомного набора и выявления их структурных особенностей. Данный метод окрашивания активно применяется в РНПЦ ДОГИ при гематологической и онкогематологической патологии у детей и молодых взрослых не только для постановки диагноза, но и для прогнозирования течения заболевания и выбора оптимальной терапии. Метод основан на использовании красителя Гимза и фермента трипсина (см. рис. 2). Его преимуществом является одновременное выявление как числовых, так и структурных хромосомных аберраций. Однако этот метод имеет ряд недостатков. Так, при его использовании не всегда удается выявить криптические, мелкие, неразличимые при световой микроскопии хромосомные перестройки или идентифицировать маркерные хромосомы.
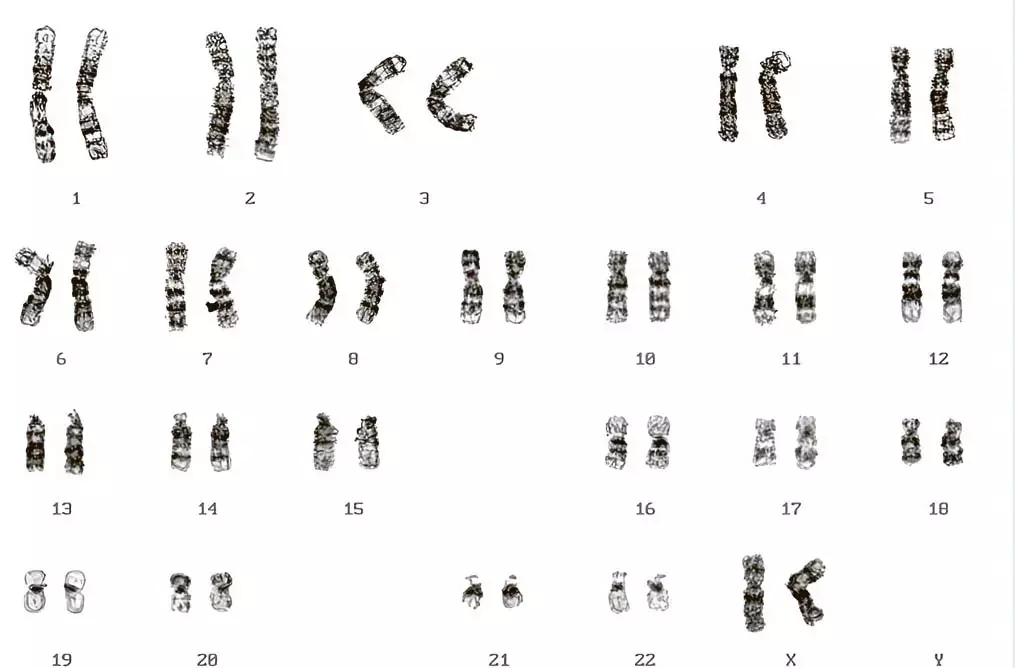
Рисунок 2.Кариограмма GTG-окрашенной метафазной пластинки.
 Анжелика СолнцеваТакже стандартное цитогенетическое исследование (СЦИ) может быть затруднено или невозможно из-за отсутствия делящихся клеток. В некоторых случаях при изучении опухолевых клеток может наблюдаться нормальный кариотип, что обусловлено разным митотическим индексом нормальных и опухолевых клеток или небольшим размером опухолевого клона.
Анжелика СолнцеваТакже стандартное цитогенетическое исследование (СЦИ) может быть затруднено или невозможно из-за отсутствия делящихся клеток. В некоторых случаях при изучении опухолевых клеток может наблюдаться нормальный кариотип, что обусловлено разным митотическим индексом нормальных и опухолевых клеток или небольшим размером опухолевого клона.
Для решения перечисленных проблем важным направлением становится использование молекулярно-цитогенетических методов, таких как флуоресцентная гибридизация in situ (FISH), хромосомный микроматричный анализ (ХМА), мультиплексная лигированно-зависимая амплификация зонда (MLPA).
Флуоресцентная гибридизация in situ (FISH) применяется в цитогенетической лаборатории РНПЦ ДОГИ не только при онкогематологических заболеваниях, но и для постановки диагноза при солидных опухолях, опухолях ЦНС. При FISH-анализе задействуют меченые ДНК-зонды, направленные на выбранные мишени. Данный метод имеет более высокое разрешение (примерно 40 Кб — 1 Мб, в зависимости от размера FISH-зондов), чем СЦИ (от 5–7 Мб).
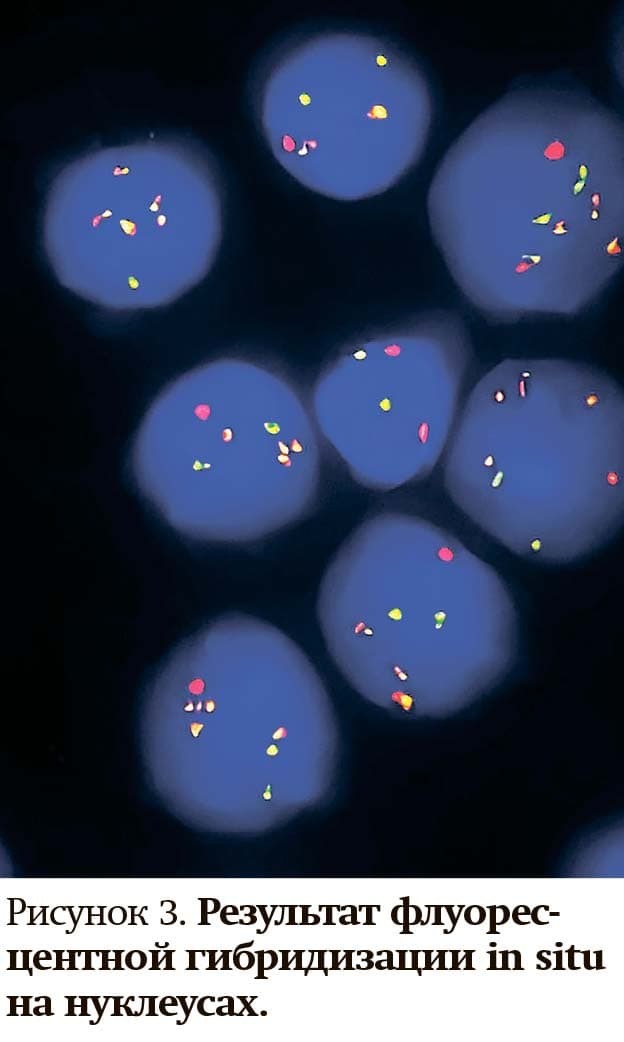 Кроме того, его преимуществом является использование как на метафазах, так и на неделящихся клетках (интерфазных ядрах). В большинстве случаев применяют образцы костного мозга и периферической крови, также могут быть исследованы образцы опухолевого материала, выпота, спинномозговой жидкости и парафиновые срезы тканей (см. рис. 3).
Кроме того, его преимуществом является использование как на метафазах, так и на неделящихся клетках (интерфазных ядрах). В большинстве случаев применяют образцы костного мозга и периферической крови, также могут быть исследованы образцы опухолевого материала, выпота, спинномозговой жидкости и парафиновые срезы тканей (см. рис. 3).
Поскольку геномная характеристика является неотъемлемой частью клинического ведения гематологических злокачественных новообразований, для диагностических, прогностических и терапевтических целей нередко используют современные молекулярно-генетические методы: ХМА и MLPА.
Однако необходимо признать ограничения данных методов: неспособность обнаруживать сбалансированные хромосомные перестройки и субклональные аномалии. Их чувствительность недостаточная (минимум 30 % опухолевых клеток), а низкая инфильтрация образца опухоли или субклонов может привести к увеличению ложноотрицательных результатов. Также MLPA зависит от конструкции ограниченного числа специфических наборов зондов, неспособных обеспечить полногеномный анализ.
Таким образом, учитывая преимущества и недостатки современных молекулярно-генетических методов, на сегодняшний день в лаборатории РНПЦ ДОГИ используются классические цитогенетические методы, такие как СЦИ и FISH.
Клиническое и прогностическое значение
 Дарья КарпузаПолученная информация о хромосомных изменениях играет большую роль в диагностике и прогнозировании онкогематологических заболеваний, а также в выборе современных способов терапии. Основную группу онкогематологических заболеваний среди детей и молодых взрослых составляют острые лейкозы, лимфомы и миелодиспластические неоплазии. Наиболее распространен в детском возрасте острый лейкоз. Он классифицируется на основе типа клеток, из которых возникает, выделяют два основных типа: острый лимфобластный лейкоз (ОЛЛ) и острый миелобластный лейкоз (ОМЛ).
Дарья КарпузаПолученная информация о хромосомных изменениях играет большую роль в диагностике и прогнозировании онкогематологических заболеваний, а также в выборе современных способов терапии. Основную группу онкогематологических заболеваний среди детей и молодых взрослых составляют острые лейкозы, лимфомы и миелодиспластические неоплазии. Наиболее распространен в детском возрасте острый лейкоз. Он классифицируется на основе типа клеток, из которых возникает, выделяют два основных типа: острый лимфобластный лейкоз (ОЛЛ) и острый миелобластный лейкоз (ОМЛ).
Согласно последней классификации ВОЗ 2022 года, каждый вариант острого лейкоза имеет определенные генетические аномалии.
В цитогенетической лаборатории РНПЦ ДОГИ исследуется весь спектр генетических аберраций, характерных для острых миелобластных лейкозов. К таким хромосомным изменениям относятся t(8;21)(q22;q22), inv(16)(p13;q22)/t(16;16)(p13;q22), t(15;17)(q22;q21), t(9;11)(р21;q23), t(6;9)(p23;q24), inv(3)(q21;q26)/t(3;3)(q21;q26), t(1;22)(p13;q13), inv(16)(p13.3;q24.3), t(16;21)(p11.2;q22.2) и t(9;22)(q34;q11.2), наличие перестроек генов MECOM, NUP98, KMT2А. Перечисленные аномалии имеют существенное клиническое и прогностическое значение, так как цитогенетический вариант лейкоза нередко диктует выбор определенной лечебной тактики. Например, t(9;22) и t(15;17) являются диагностическими маркерами и мишенями для таргетной терапии. Кроме того, по хромосомным аномалиям можно судить о прогнозе заболевания. Установлено, что прогноз при t(8;21) благоприятный, поэтому выбор терапевтической тактики может быть менее агрессивным. Напротив, миеломоноцитарные и моноцитарные варианты лейкозов с t(9;11)(p22;q23), t(6;9)(р23;q34), а также лейкозы с аномалией 3-й хромосомы inv(3)(q21;q26)/t(3;3)(q21;q26), перестройкой гена NUP98 являются прогностически крайне неблагоприятными.
Согласно риск-стратификации пациентов Республики Беларусь по протоколу ОМЛ-ММ-2020, наличие этих аномалий требует интенсификации химиотерапии и проведения трансплантации костного мозга в первой линии терапии.
Таким образом, всем пациентам с диагнозом острого миелобластного лейкоза в начале заболевания проводится цитогенетическое исследование костного мозга.
 Елена ВолочникДля В-лимфобластного лейкоза (В-ОЛЛ) выявляется множество хромосомных аномалий, имеющих прогностическое значение. В рамках протокола ALL-MB-2015 для пациентов с данной нозологией в РНПЦ ДОГИ проводится цитогенетическое исследование (ЦГИ), включающее кариотипирование и FISH, для выявления рекуррентных хромосомных аберраций, описанных в классификации ВОЗ. Наиболее значимыми для диагностики являются транслокации t(9;22)(q34;q11) и t(4;11)(q21;q23). Их наличие указывает на крайне неблагоприятный прогноз и необходимость интенсификации терапии и проведения трансплантации костного мозга, а t(12;21)(p13;q22) указывает, напротив, на благоприятный прогноз. При этой аномалии ремиссия достигается у 100 % пациентов, а пятилетняя выживаемость составляет около 90 %.
Елена ВолочникДля В-лимфобластного лейкоза (В-ОЛЛ) выявляется множество хромосомных аномалий, имеющих прогностическое значение. В рамках протокола ALL-MB-2015 для пациентов с данной нозологией в РНПЦ ДОГИ проводится цитогенетическое исследование (ЦГИ), включающее кариотипирование и FISH, для выявления рекуррентных хромосомных аберраций, описанных в классификации ВОЗ. Наиболее значимыми для диагностики являются транслокации t(9;22)(q34;q11) и t(4;11)(q21;q23). Их наличие указывает на крайне неблагоприятный прогноз и необходимость интенсификации терапии и проведения трансплантации костного мозга, а t(12;21)(p13;q22) указывает, напротив, на благоприятный прогноз. При этой аномалии ремиссия достигается у 100 % пациентов, а пятилетняя выживаемость составляет около 90 %.
В 2024 году была принята новая версия протоколаALL-MB-2015. Согласно ей с середины 2024 года в лаборатории РНПЦ ДОГИ впервые в Беларуси было внедрено исследование генетических маркеров BCR/ABL1-подобного лейкоза (гены ABL1, ABL2, PDGFRB, CSF1R, CRLF2, JAK2, EPOR), других молекулярно-биологических маркеров плохого прогноза (гены PAX5, MEF2D, ZNF384 и CREBBP), имеющих важное значение в качестве предикторов рецидивов заболевания.
На сегодняшний день для пациентов с острым лимфобластным лейкозом из Т-предшественников (Т-ОЛЛ) нет стратификации на основе генетических особенностей опухолевых клеток. Однако в РНПЦ ДОГИ активно ведется научная работа по изучению цитогенетических и молекулярно-генетических маркеров для разработки диагностического комплекса, а также для стратификации пациентов с Т-ОЛЛ по группам риска.
Развитие миелодиспластической неоплазии (МДС) нередко связано с известными хромосомными аномалиями. В связи с этим определенную роль в диагностике и прогнозе играют ЦГИ. Наиболее распространенными хромосомными аномалиями при МДС являются трисомия 8-й, моносомия 5-й или 7-й хромосомы, делеция длинных плеч 5-й или 7-й хромосомы, а также делеция 20q, которые составляют около 40 % случаев МДС. Остальные аномалии встречаются реже. Для пациентов с подозрением на МДС проводятся кариотипирование и FISH-исследование для выявления хромосомных аномалий. Нередко ЦГИ является единственным методом подтверждения диагноза.
Особую группу составляют пациенты с анемией Фанкони, которые имеют высокий риск трансформации в МДС, а затем в ОМЛ. Таким пациентам ежегодно проводится цитогенетическое исследование костного мозга для обнаружения хромосомных аберраций с целью ранней диагностики МДС. Для некоторых вариантов МДС требуется проведение цитогенетического мониторинга, чтобы оценить эффективность новых препаратов, направленных на уничтожение опухолевого клона в костном мозге.
В настоящее время установлено, что около 90 % всех лимфом имеют цитогенетические повреждения.
Некоторым группам лимфом соответствуют свои специфические хромосомные нарушения. Сложность кариотипа становится важным прогностическим фактором: чем больше маркерных хромосом, тем хуже прогноз. Тем не менее существуют и отдельные независимые маркеры плохого прогноза при лимфомах, такие как делеция 13q, трисомия 2-й хромосомы, dmin, разрывы в участках 1q21–22 и 6q23–25, а также численные и структурные изменения 17-й хромосомы.
Таким образом, развитие цитогенетических методов исследования и их интеграция в клиническую практику позволяет улучшить результаты лечения пациентов и способствует развитию новых терапевтических подходов.
