Онкологическое заболевание — серьезный вызов для организма. Злокачественный процесс сам по себе и мощная терапия неизбежно влекут комплекс сопутствующих соматических и психоэмоциональных проблем. Их решение нельзя отложить на потом, ведь зачастую они определяют эффективность лечения, прогноз заболевания, качество жизни пациента... Необходимость междисциплинарного подхода к ведению пациентов с онкологической патологией очевидна. Особое значение приобретает и тщательный подбор лекарственных препаратов, чтобы без ущерба эффективности лечения и качеству жизни минимизировать риск лекарственных взаимодействий, нежелательных реакций и осложнений.
Проблемы, с которыми чаще всего сталкиваются пациенты с онкозаболеваниями, и пути их решения стали темой разговора за круглым столом с Ольгой Мычко, врачом-онкологом, начальником отдела планирования и организации паллиативной медицинской помощи РНПЦ ОМР им. Н. Н. Александрова, главным внештатным специалистом Минздрава по паллиативной медицинской помощи (взрослому населению) и Ириной Патеюк, заведующей кафедрой общей врачебной практики с курсом гериатрии ИПКиПКЗ БГМУ, кандидатом мед. наук, доцентом.
Артериальная гипертензия на фоне онкологии: что нужно знать?
С какими основными вызовами приходится сталкиваться онкологическому пациенту на всех этапах борьбы с заболеванием?
 Ирина ПатеюкИ. П.: При общемировой тенденции к росту распространенности онкозаболеваний смертность от них в последние десятилетия снижается, благодаря ранней диагностике и повышению эффективности методов лечения. Рост числа выживших после рака определяет актуальность проблемы коморбидности у данной категории лиц. К моменту выявления злокачественного процесса большинство пациентов уже имеют груз заболеваний.
Ирина ПатеюкИ. П.: При общемировой тенденции к росту распространенности онкозаболеваний смертность от них в последние десятилетия снижается, благодаря ранней диагностике и повышению эффективности методов лечения. Рост числа выживших после рака определяет актуальность проблемы коморбидности у данной категории лиц. К моменту выявления злокачественного процесса большинство пациентов уже имеют груз заболеваний.
По статистике, у 70–75 % лиц старше 60 лет есть сопутствующие заболевания, более чем в половине случаев это сердечно-сосудистая патология, чаще всего артериальная гипертензия (АГ). Распространенность АГ у онкологических пациентов составляет до 40 %.
Многие противоопухолевые лекарственные средства обладают токсичностью и могут стать причиной или усугубить течение болезней системы кровообращения. В списке проблем у выживших после рака — АГ, сердечная недостаточность, тромбозы, миокардит, нарушения ритма. Еще один краеугольный камень — психоэмоциональные расстройства, которые могут усугублять клиническую картину, повышать восприимчивость к боли, снижать мотивацию к лечению. И, безусловно, одна из самых сложных проблем — это болевой синдром.
 Ольга МычкоО. М.: По данным 2024 года в нашей стране 5-летняя выживаемость после радикального курса лечения составляет 82 %, оставшиеся с продвинутыми формами онкозаболевания, не излечимыми, как мы говорим, в один прыжок, вынуждены жить с болезнью. Современный уровень медицинской помощи позволяет продлить жизнь, но ключевой задачей становится качество этой жизни. В этом контексте выделяют три основных принципа: не больно, не страшно, не одиноко. Они отражают направленность и цель медицинской паллиативной помощи и вообще философии паллиатива.
Ольга МычкоО. М.: По данным 2024 года в нашей стране 5-летняя выживаемость после радикального курса лечения составляет 82 %, оставшиеся с продвинутыми формами онкозаболевания, не излечимыми, как мы говорим, в один прыжок, вынуждены жить с болезнью. Современный уровень медицинской помощи позволяет продлить жизнь, но ключевой задачей становится качество этой жизни. В этом контексте выделяют три основных принципа: не больно, не страшно, не одиноко. Они отражают направленность и цель медицинской паллиативной помощи и вообще философии паллиатива.
Вы сказали, что онкозаболевание часто сопровождается АГ. Что первично: гипертензия или онкология? Чем АГ опасна именно для онкопациентов?
И. П.: АГ в целом распространена в популяции: по данным исследования STEPS 2020 года, доля населения с повышенным АД составляет 25,8 %. Траектории АГ и рака могут быть разными. Одни пациенты имеют анамнез АГ задолго до развития злокачественного новообразования, у других повышенное АД выявляется сразу после постановки онкологического диагноза. Достоверно оценить распространенность «новой» АГ среди пациентов с онкопатологией сложно ввиду высокой вероятности развития стресс-индуцированной и «маскированной» АГ. Также АГ может быть вызвана противораковыми препаратами (ингибиторы фактора роста сосудистого эндотелия (VEGFi), бригатиниб, ибрутиниб, фторпиримидины, цис-платин, абиратерон, бикалутамид), неонкологическими препаратами (НПВС), такими факторами, как боль или почечная недостаточность.
О. М.: При этом стресс, тревога, депрессия, которые сопровождают онкологическое заболевание, могут усугублять течение АГ или приводить к ее развитию. Стресс выступает провоцирующим фактором.
И. П.: Что касается рисков — это вероятность развития сердечно-сосудистых катастроф (инсульты, инфаркты) и поражение органов-мишеней.
Неоспоримый факт: наличие ранее недиагностированной АГ до начала химиотерапии значительно увеличивает риск индуцированной сердечно-сосудистой токсичности.
Нелеченая АГ является фактором риска развития сердечной недостаточности, что особенно актуально для пациентов при терапии VEGFi, антрациклинами, ибрутинибом. Неконтролируемая тяжелая АГ может препятствовать противораковому лечению — если САД ≥180 и/или ДАД ≥110 мм рт. ст., любое противораковое лечение, связанное с АГ, следует отложить или временно приостановить до тех пор, пока АД не будет контролироваться до значений САД <160 мм рт. ст. и ДАД <100 мм рт. ст. Терапия рака может быть возобновлена после достижения контроля АД с учетом снижения дозы. Во время лечения рака рекомендуется целевое САД <140 мм рт. ст. и ДАД <90 мм рт. ст., а при хорошей переносимости антигипертензивного лечения — АД менее 130/80 мм рт. ст.
Каковы особенности контроля артериального давления у онкологических больных?
И. П.: Принципы контроля АГ стандартны и идентичны для всех: достижение целевого уровня АД, защита органов-мишеней, профилактика сердечно-сосудистых осложнений. Но для онкопациентов этих целей достигнуть сложнее, при этом риск развития сердечно-сосудистых осложнений у них выше. Если АГ развивается в процессе лечения рака, целесообразность, интенсивность и длительность антигипертензивной терапии (АГТ) определяется уровнем рассчитанного сердечно-сосудистого риска и прогнозом выживания из-за наличия онкологического заболевания (см. таблицу).
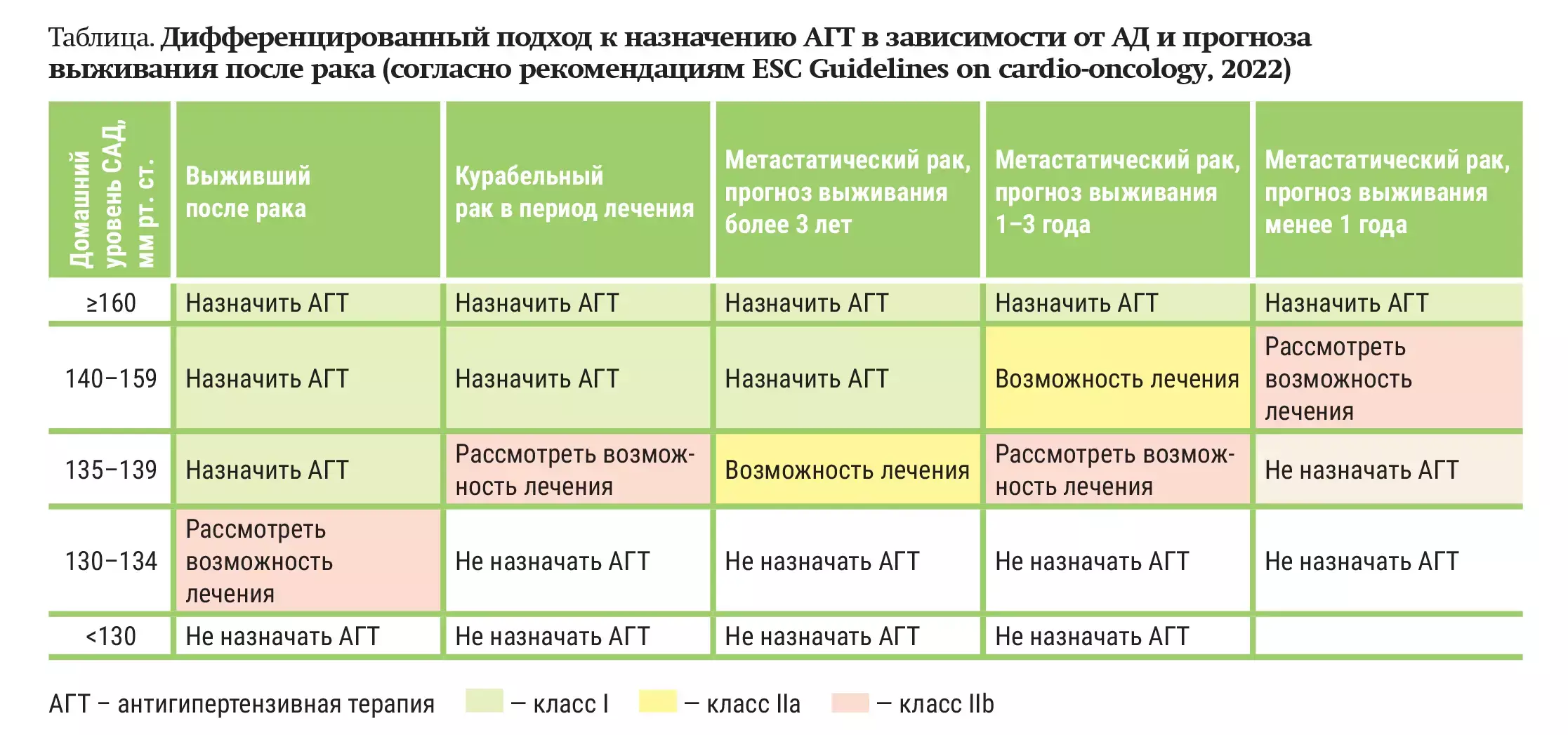
Получается, не все гипотензивные препараты подходят для назначения онкопациентам?
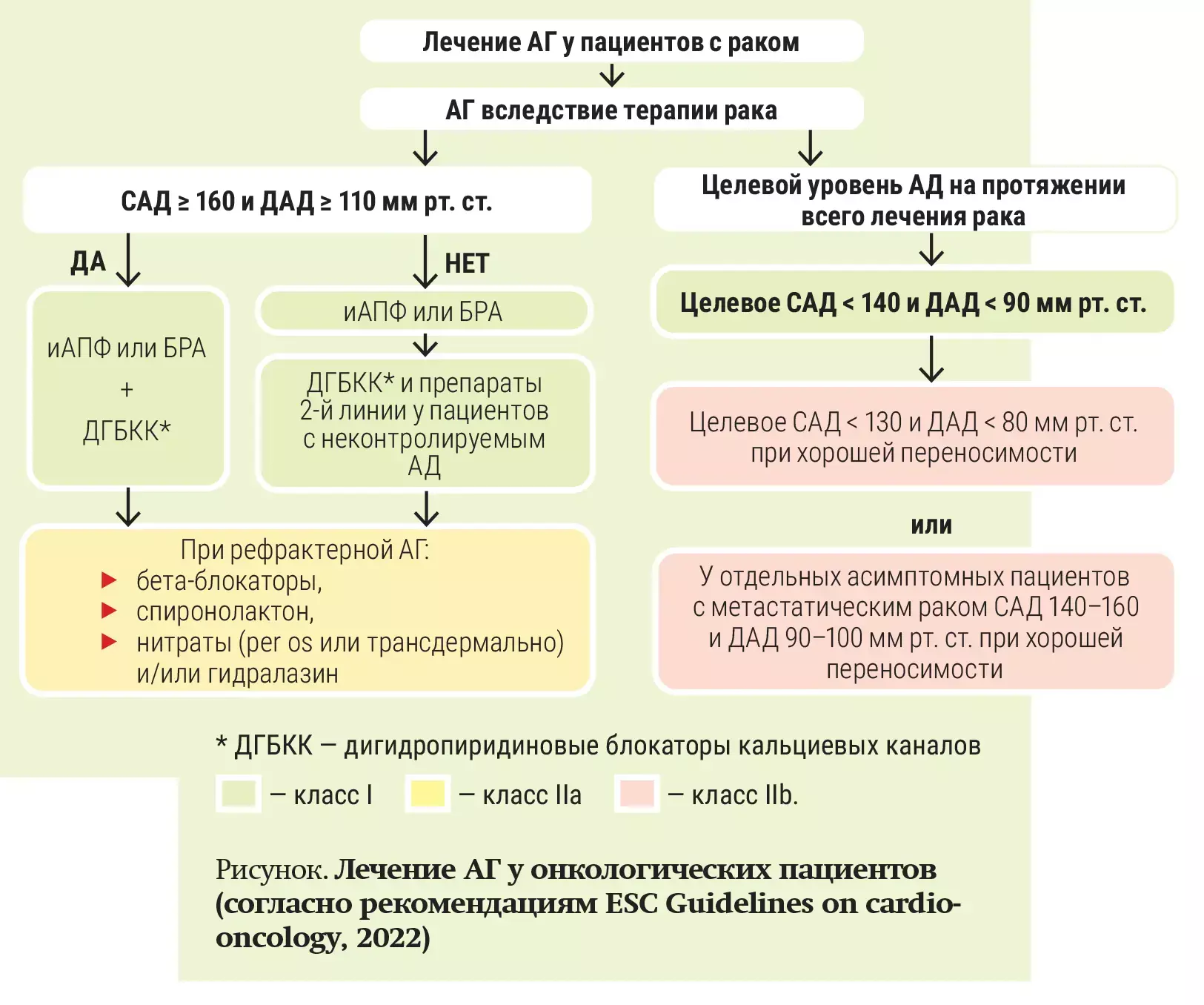
И. П.: АГТ у онкологических пациентов должна включать препараты, безопасность и эффективность которых подтверждена именно для этой категории пациентов, иметь кардиопротективный эффект. Согласно обновленным в 2022 году клиническим рекомендациям Европейского общества кардиологов по кардиоонкологии, препаратами первой линии для лечения АГ для снижения риска сердечно-сосудистой токсичности, связанной с терапией рака, являются блокаторы рецепторов ангиотензина (БРА) и ингибиторы ангиотензинпревращающего фермента (иАПФ).
Онкопациентам с САД ≥160 и/или ДАД ≥100 мм рт. ст. рекомендуется комбинированная терапия БРА или иАПФ с дигидропиридиновым блокатором кальциевых каналов. У пациентов с резистентной АГ, связанной с терапией рака, следует рассмотреть назначение спиронолактона, пероральных нитратов и/или гидралазина (см. рисунок). С точки зрения антигипертензивного действия БРА и иАПФ — равновеликие классы. При назначении важно учитывать преимущества лекарственного препарата и данные клинических исследований. БРА характеризуются благоприятным профилем переносимости и малым количеством побочных эффектов.
В клинической практике о длительности действия антигипертензивного препарата судят по отношению остаточной активности (через 24 часа после приема последней дозы) к пиковой (максимальное действие в момент максимальной концентрации препарата в крови). Для онкологических пациентов особенно важна длительность действия: например, при приеме один раз в день такого БРА, как телмисартан, обеспечивается клинически значимое снижение остаточного САД и ДАД, сравнимое со снижением АД на пике действия. Для дозы 40 мг отношение остаточной активности к пиковой составляет 66 % для САД и 100 % для ДАД, для дозы 80 мг — 92 % для САД и 100 % для ДАД.
Для пациентов с онкологической патологией имеет значение контроль вариабельности АД — резких «скачков» в течение суток, которые увеличивают нагрузку на сердце и сосуды и сопряжены с 4-кратным повышением риска сердечно-сосудистых осложнений, усложняют процесс лечения, ухудшают прогноз.
Также клинические исследования показали, что телмисартан не связан с повышенным риском развития рака и безопасен при применении. Телмисартан не метаболизируется системой цитохрома печени Р450 и практически не взаимодействует с препаратами, метаболизирующимися по этому механизму. Это важный критерий для клинической практики, поскольку, согласно статистике, около 30 % серьезных побочных эффектов обусловлены нежелательным лекарственным взаимодействием.
Не рекомендованы на фоне химиотерапии недигидропиридиновые антагонисты кальция из-за различных лекарственных взаимодействий; диуретики назначают пациентам с АГ только с признаками задержки жидкости.
Опасная тревога
Пациенты с онкопатологией имеют дополнительный фактор развития или прогрессирования АГ — тревожность. Как решать эту проблему?
О. М.: Тревога как патологический симптом встречается у 38–46 % онкобольных. Как правило, она появляется уже на начальном этапе при подтверждении или даже подозрении на онкологический диагноз. Но мы все тревожимся в норме. Другое дело, когда речь не просто о реакции на диагноз, а о психическом состоянии, которое лишает человека желания бороться за жизнь... Иногда классической психологической поддержки недостаточно, приходится применять фармакологию. Клиническими протоколами предусмотрен обширный арсенал средств для этого. Есть категория препаратов скорой помощи, чтобы быстро купировать состояние. Но зачастую за тревогой формируется «депрессивный хвост», поэтому чаще всего это работа вдолгую, и назначение антидепрессантов полностью оправдано. Более того, многие из антидепрессантов являются адъювантами, т. е. потенциируют действие других препаратов, применяемых в комплексной онкотерапии, например, для лечения хронической боли.
В паллиативной практике для длительной терапии идеально подходит эсциталопрам. Он хорошо переносится, легко контролируется, его безопасность подтверждена. Он не только улучшает настроение, но и снимает тревогу, которая мешает адекватному восприятию противоопухолевой терапии.
Также тревога, депрессия всегда сопровождаются нарушениями сна. Лечение инсомнии — одна из сложных задач, в онкологии в том числе.
К сожалению, назначение по старинке барбитуратов, того же зопиклона, — не редкость.
Его нельзя принимать больше 2-х недель, но пьют годами и уже не для того, чтобы восстановить сон, а потому что развилась зависимость.
Поэтому лечим ли мы АГ, или тревогу, или боль — назначение препаратов должно быть строго по показаниям и в тех дозировках, которые необходимы, индивидуально и точечно. Для лечения инсомнии используют в том числе антидепрессанты в малых дозах — кветиапин, миртазапин (препараты off-label). Важно подобрать эффективный препарат в зависимости от причины нарушений сна.
С точки зрения лекарственных взаимодействий и коморбидности онкологических пациентов какие антидепрессанты наиболее безопасны?
О. М.: Те же эсциталопрам, миртазапин — это современные лекарственные средства с высоким профилем безопасности. Они хорошо сочетаются как в комбинации с химиотерапией, так и с лечением патологических симптомов, связанных с болью, тошнотой, рвотой и т. д.
Клиническими исследованиями подтверждено, что миртазапин помимо высокой эффективности в коррекции инсомнии оказывает положительное действие на ЖКТ даже на фоне химиотерапии, снижает негативные проявления от приема достаточно агрессивных противоопухолевых препаратов (миртазапин блокирует 5-HT3-рецепторы в кишечнике, что приводит к уменьшению тошноты, рвоты и диареи — частые побочные эффекты химиотерапии).
И. П.: Для лечения пациентов с сердечно-сосудистыми заболеваниями и умеренной или выраженной депрессией клинические рекомендации как европейских, так и российских профессиональных сообществ выделяют селективные ингибиторы обратного захвата серотонина (СИОЗС). В рекомендациях по лечению пациентов с хронической сердечной недостаточностью названы как безопасные сертралин и эсциталопрам. К слову, амитриптилин, напротив, противопоказан из-за высокой кардиотоксичности. Есть исследования и по миртазапину: в терапевтических дозах он не оказывает отрицательного влияния на сердечно-сосудистую систему. Кроме того, последние исследования подтверждают, что СИОЗС активируют Т-лимфоциты и усиливают противоопухолевую активность иммунитета.
О. М.: Тема не новая, между прочим. В свое время она легла в основу концепции паллиативной помощи родственникам в течение периода горевания (1 года) после утраты. По статистике, вокруг умирающего задействованы 7 человек — близкие родственники, друзья, соседи. И если учесть, что одна из теорий развития онкозаболеваний — хронический стресс, то ближайшее окружение представляет собой группу риска.
Есть же еще понятие патологического горя, ухода в болезнь, так называемые ямы, когда спустя 4–6 месяцев после утраты близкого человека у горюющего велик риск суицида...
Поэтому психологическое сопровождение близких, назначение антидепрессантов при необходимости — это действительно то, что может не допустить реализации стресса в тяжелую болезнь и профилактирует другие негативные последствия.
Кроме онкопациентов надо думать и об их родственниках.

Приходится ли убеждать онкологических пациентов принимать антидепрессанты, если есть необходимость? Какие доводы приводить?
О. М.: Иногда действительно нужны усилия, чтобы объяснить пациенту, почему важно принимать антидепрессанты не менее 6 месяцев, сохраняя приверженность лечению. И почему возможны изменения эмоционального состояния в первые 2 недели приема — это ключевой период адаптации к препарату с регулярным наблюдением каждые 3 дня, чтобы после выписки пациент мог продолжить амбулаторное лечение.
Конечно, врач должен объяснить, что прием антидепрессантов — это помощь в восстановлении психологического и физического состояния, которое влияет на успех лечения онкозаболевания. Доказано, что у пациентов с продвинутыми формами болезни шанс уйти в стойкую ремиссию в 1,8 раза выше, если они хорошо обезболены, у них нет тревоги и соответственно есть желание жить.
И. П.: Депрессия — это не про «возьми себя в руки», это заболевание, которое требует вмешательства. Антидепрессант является адъювантным лекарственным средством, которое не оказывает непосредственного обезболивающего действия, однако способствует уменьшению боли и обладает морфин-сберегающим эффектом. При лечении хронического болевого синдрома любой интенсивности, прежде чем увеличить дозу анальгетика или перейти на следующую ступень обезболивания, необходимо назначить адъювант.
НПВП при онкоболи
Аргумент в пользу более эффективного обезболивания при приеме антидепрессантов звучит особенно убедительно, ведь боль — одна из самых пугающих составляющих онкозаболевания...
О. М.: По данным разных источников, от хронической боли страдает от 10 % до 20 % населения земного шара и порядка 80 % первичных обращений в медучреждения связаны именно с жалобами на боль.
На ранних этапах онкозаболевания от 10 % до 45 % пациентов уже испытывают болевой синдром разной степени интенсивности. По мере прогрессирования болезни цифра растет не арифметически, а геометрически.
На терминальных стадиях боль испытывают от 75 % до 100 % онкопациентов. Это подтверждает и наш собственный анализ, который мы проводили в хосписе на протяжении 10 лет. Он показал, что только 5 % пациентов на терминальной стадии не предъявляют жалоб на боль, но имеют другие тяжелые симптомы: одышку, тошноту, нарушение сознания…
Поэтому, конечно, вопрос эффективного обезболивания актуален на всех этапах развития онкопатологии.
Старт лечения болевого синдрома всегда начинается с простого: с препаратов первой линии — это прежде всего нестероидные противовоспалительные (НПВП) и препараты, к ним приравненные. Грамотное назначение НПВП — фундамент обезболивающей терапии.
Здесь важна фармакокинетика и понимание механизма действия каждого препарата. Но в клинической практике одно и то же лексредство может по-разному воздействовать на пациентов.
Но наверняка есть общие критерии, по которым можно определить преимущества в выборе того или иного НПВП в онкологии?
О. М.: Действительно есть исследования, позволяющие сравнить анальгетическую активность НПВП. Парацетамол считается препаратом с наименьшей анальгетической активностью.
Для лечения хронической боли лучше всего подходят препараты напроксен, кетопрофен, мелоксикам. Они демонстрируют хорошую эффективность и приемлемый профиль безопасности при длительном применении. Это очень важно, поскольку в паллиативной практике пациенты часто принимают эти препараты месяцами.
Также одним из ключевых принципов лечения хронической боли является регулярный прием лекарственных средств строго по часам, а не «когда заболело». Предпочтение пероральному введению, чтобы избежать пиковых концентраций и минимизировать нагрузку на организм, особенно на иммунитет, который у онкобольных и так ослаблен. И, конечно, выбор в пользу пролонгированных форм препаратов, когда достаточно принять 1 таблетку в сутки, например.
И. П.: Любые НПВП повышают риск развития нежелательных явлений со стороны сердечно-сосудистой системы — дестабилизации АГ и сердечной недостаточности, нарушений сердечного ритма, инфаркта миокарда, инсульта, тромбоэмболии легочной артерии. Риск развития этих осложнений зависит от особенностей конкретного препарата, дозы и длительности его приема, но не от селективности НПВП.
Согласно российскому консенсусу экспертов 2024 года по рациональному использованию НПВП, напроксен в меньшей степени вызывает дестабилизацию АГ и сердечной недостаточности. Напроксен не ассоциируется со значимым повышением риска сердечно-сосудистой смертности.
Подтверждением этого является метаанализ 31 РКИ (n=116 429), в котором изучалась кардиоваскулярная безопасность НПВП, критерием оценки являлась частота эпизодов инфаркта миокарда, инсульта и смерти из-за кардиоваскулярных причин. Суммарный риск этих осложнений был наиболее низким для напроксена.

О. М.: Стоит отметить, что монотерапия в лечении хронической боли часто оказывается недостаточной и может исчерпать себя буквально через 2–3 дня. Поэтому оправдано применять комплексную терапию с включением препаратов, которые сами по себе анальгетической активности не имеют, но потенциируют действие основных обезболивающих — тех же антидепрессантов.
При осложненных состояниях иногда разумнее использовать препараты совершенно другого ряда из другого класса, например, слабые опиоиды, которые уберут болевой синдром и обеспечат необходимое качество жизни.
Как совмещать антигипертензивную, антидепрессивную, обезболивающую терапию с наименьшими рисками для пациента?
И. П.: Ключевым остается мультидисциплинарный подход, когда совместно и слаженно работает целая команда специалистов — онкологов, кардиологов, эндокринологов, врачей общей практики и многих других, — чтобы, учитывая все факторы, подбирать наиболее эффективную и безопасную комплексную терапию, предупреждать развитие осложнений и добиваться желаемого терапевтического эффекта, сохраняя при этом достойное качество жизни пациента.
Как оценить, что все сделано правильно?
О. М.: Если опустить медицинские детали, все правильно — это когда пациенту не больно, не страшно, не одиноко.
