«Если у кого-то болит рука, то утешают не руку, а страдающего», — с этой цитаты философа Людвига Витгенштейна начала свое выступление на тему «Боль у паллиативного ребенка» заместитель директора по медицинской части Республиканского клинического центра паллиативной медицинской помощи детям, кандидат мед. наук, доцент Жанна Безлер.
 Слушателями были участники Республиканской научно-практической конференции с международным участием «Развитие паллиативной медицинской помощи детскому и взрослому населению Республики Беларусь», которая прошла недавно на базе РНПЦ онкологии и медрадиологии имени Н. Н. Александрова.
Слушателями были участники Республиканской научно-практической конференции с международным участием «Развитие паллиативной медицинской помощи детскому и взрослому населению Республики Беларусь», которая прошла недавно на базе РНПЦ онкологии и медрадиологии имени Н. Н. Александрова.
Частота и симптомы
Частота болевых ощущений среди пациентов с онкопатологией такова: 55 % из них испытывают боль во время лечения, 39,3 % — после лечения, 66,4 % — на последних стадиях заболевания с метастазированием. По данным исследователей из разных стран, в целом 84 % паллиативных детей в последнюю неделю жизни испытывают боль, 63 % — слабость, 58 % страдают от тошноты (рвоты), 55 % — от одышки, 47 % — от запоров.
Последствия некупированной боли: негативное влияние на функцию жизненно важных систем организма, стресс, возрастание частоты осложнений, ателектаз, пневмония, гипоксемия, аритмия, ишемия и инфаркт миокарда, медленное восстановление функции ЖКТ, тромбоз глубоких вен / ТЭЛА, риск психических расстройств, затруднение реабилитации.
Оценка состояния
При возможности вербального общения с ребенком проводится первичная оценка боли по следующим параметрам: число и локализация очагов боли, интенсивность и характер. При отсутствии возможности вербального общения (ранний возраст, тяжесть состояния, задержка речевого и умственного развития пациента и др.) оценка боли проводится на основании наблюдения за поведением ребенка, показателями жизненно важных функций.
Дети по-разному реагируют на боль: одних невозможно успокоить, утешить, другие становятся замкнутыми или ищут утешения и комфорта. Усиливаются беспокойство и суетливость, ребенок легко вздрагивает, отстраняется при прикосновении, извивается или принимает вынужденное положение. Мы можем видеть скованность конечностей, сжатие рук в кулаки, выгибание спины, сопротивление движению.
Сон ребенка нарушается: увеличена или уменьшена его продолжительность. При осмотре обращаем внимание на наличие тахикардии, потливости, озноба, на изменение цвета кожных покровов, задержку дыхания, слезы. Появление атипичного, нехарактерного для ребенка поведения может говорить о боли — это отрешенное выражение лица, смех без причины, самоповреждающее поведение.
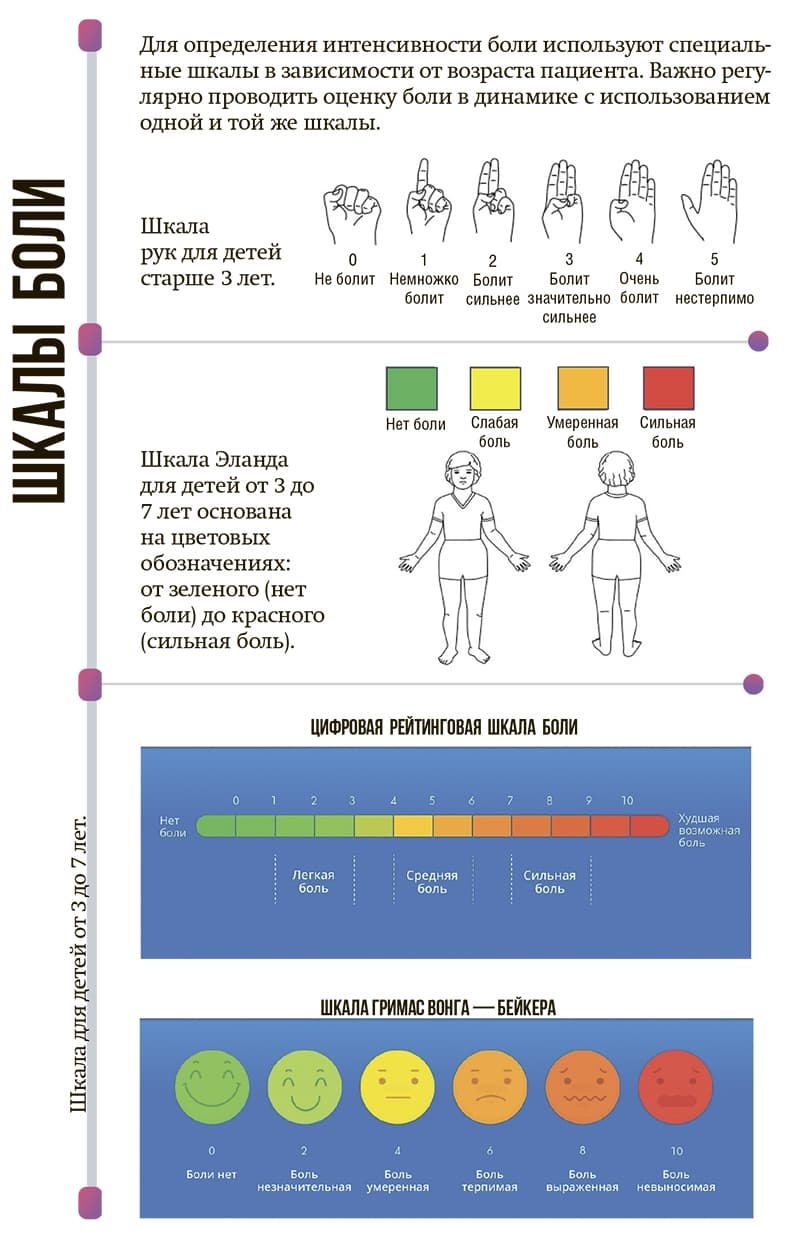
Самооценка боли пациентом — наиболее ценный инструмент. Во всех случаях нужно прислушиваться к его мнению и доверять его ощущениям. И помните: если вы говорите, что болеть не должно, а пациент говорит, что болит, — вы не правы!
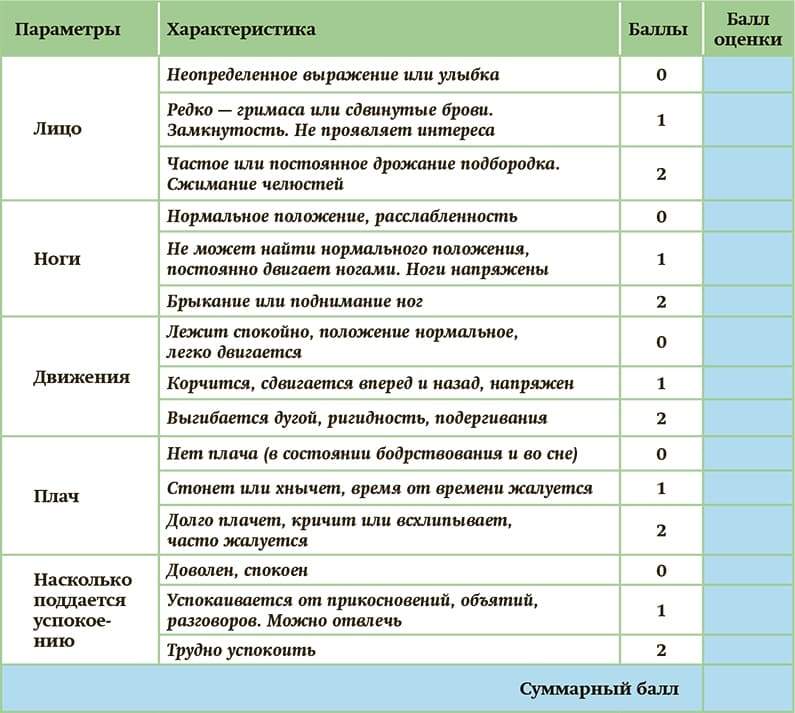
Для оценки боли у невербальных пациентов можно использовать шкалу FLACC. Поведенческая шкала для детей в возрасте до 3 лет (FLACC — Face, Legs, Activity, Cry, Consolability) выглядит так:
Принципы терапии
В 1996 году ВОЗ провозгласила 5 принципов терапии боли: способ введения препаратов через рот (энтеральный путь); по часам (анальгетики следует назначать регулярно по схеме, в соответствии с длительностью эффекта препарата, не дожидаясь развития сильной боли, исключая возможность прорывной); по восходящей (от неопиоидных анальгетиков при слабой боли к мягким опиоидам при умеренной и сильным опиоидным анальгетикам при сильной боли, по мере нарастания интенсивности боли в соответствии с лестницей обезболивания ВОЗ); индивидуальный подход (наиболее эффективный анальгетик в нужной дозе с наименьшими побочными эффектами для конкретного пациента); с вниманием к деталям (учет особенностей каждого пациента, назначение коанальгетиков и адъювантов при необходимости).
Таким образом, следует исключить все инъекционные формы анальгетиков, проводить терапию с использованием неинвазивных лекарственных форм (таблетки, капсулы, сиропы, трансдермальные терапевтические системы, ректальные формы и т. д.). Принимать препарат нужно регулярно, не дожидаясь возобновления боли, чтобы принять следующую дозу.
Лекарство следует принимать до тех пор, пока существует причина боли. Если причина боли устранима, доза может быть уменьшена вплоть до отмены препарата; если причина боли неустранима, препарат нужно принимать постоянно длительное время, в противном случае боль вернется.
Лестница обезболивания ВОЗ включает три ступени, однако для пациентов детского возраста рекомендована двухступенчатая схема обезболивания.
Тактика ведения болевого синдрома
Ступень 1
Терапия слабой боли. Неопиоидные анальгетики +/– вспомогательная терапия. Интенсивность боли оценивается пациентом в пределах 1–3 балла. На первой ступени обезболивания у детей используется парацетамол. Внутрь доза по 10–15 мг/кг каждые 4–6 часов; ректально доза по 15–20 мг/кг каждые 4–6 часов; при печеночной и почечной недостаточности необходимо снижение дозы и увеличение интервала до 8 часов.
Ибупрофен можно давать детям с 3-месячного возраста: внутрь по 5–10 мг/кг каждые 6–8 часов; максимальная суточная доза 40 мг/кг, во время еды. НПВП показаны в большинстве случаев на всех этапах терапии боли, достаточно эффективны у пациентов с опухолями и/или метастазами, поражающими мягкие ткани и кости, которые сопровождаются выраженным перифокальным воспалением. Кеторолак имеет ограничения по возрасту: используется у пациентов старше 16 лет и не более 5 дней из-за выраженных нежелательных реакций со стороны ЖКТ.
Нежелательные реакции при приеме НПВП со стороны ЖКТ: диспепсия, язвы, кровотечение/перфорация; повреждение печеночных клеток; кардиоренальные: артериальная гипертензия, инфаркт миокарда, инсульт, периферические отеки; почечные: снижение клубочковой фильтрации, интерстициальный нефрит; повышение риска кровотечения.
Высокоселективные ингибиторы циклооксигеназы-2 (ЦОГ-2) имеют противовоспалительный эффект с наименьшим риском развития нежелательных реакций со стороны ЖКТ (кровотечения, язвы, диспепсия). Целекоксиб можно назначать по 1–2 мг/кг детям после 2 лет. Интервал 12–24 часа. При массе более 25 кг — 100 мг 2 раза в сутки. Препарат отличается относительно низким риском кардиоваскулярных осложнений.
Переход на 2-ю ступень может быть достаточно быстрым, если боль не контролируется неопиоидными анальгетиками. Индивидуально у пациентов старше 14 лет с онкозаболеваниями для лечения умеренного болевого синдрома (4–6 баллов) может применяться трамадол (используется в трехступенчатой схеме лечения боли ВОЗ), стартовая доза по 50 мг каждые 4–6 часов, увеличивать при необходимости до 400 мг в сутки.
Предостережения: прием трамадола обусловливает такие симптомы, как сухость во рту, тошнота, рвота, метеоризм, боль в животе, повышенное потоотделение, головокружение, головная боль, слабость, повышенная утомляемость, заторможенность. Препарат блокирует обратный захвата норадреналина и серотонина в нейрональных синапсах, в результате чего возможна парадоксальная стимуляция ЦНС: нервозность, ажитация, тревожность, тремор, спазмы мышц, эйфория, эмоциональная лабильность, галлюцинации, нарушения координации и др. С учетом генетических особенностей активности цитохрома Р450 у 8–10 % пациентов европеоидной расы трамадол не оказывает обезболивающего эффекта. С осторожностью его нужно применять при эпилепсии, при приеме препаратов — ингибиторов цитохрома Р450.
Тримеперидин (промедол) не должен применяться при терапии хронической боли. Нейротоксичность метаболитов (нормеперидин) может вызвать судороги, психозы, что оговорено в ряде зарубежных руководств, где разрешена продолжительность терапии не более 2–3 дней. Может применяться для прорывов боли кратковременно.
Ступень 2
Терапия умеренной/сильной боли — это сильные опиоидные +/– неопиоидные анальгетики +/– вспомогательная терапия. Интенсивность боли оценивается пациентом в пределах 4–10 баллов. Адекватный контроль боли не достигается приемом парацетамола, НПВП и адъювантов. Используются морфина сульфат/гидрохлорид, гидроморфон, фентанил.
Золотым стандартом обезболивания является морфин быстрого (короткого) действия, контролирует боль в течение 4–6 часов. Титровать дозу следует быстро, чтобы в течение 3–4 дней достичь необходимого обезболивания. Регулярно (каждые 4 часа) необходимо проводить оценку боли, эффективности действия препарата, развития нежелательных реакций. Начинать со стартовой дозы морфина п/к или в/в, перорально — каждые 4 часа, при прорывных болях резервная доза составляет 5–10 % (или 1/6) от суточной дозы.
Стартовая разовая доза морфина зависит от возраста. Перорально детям от 6 месяцев до 12 лет дают 0,15–0,3 мг/кг, от 12 до 18 лет — 5–10 мг. П/к и в/в, струйно (не менее 5 минут) первой группе детей вводят 0,05–0,1 мг/кг 6 раз в сутки, максимально 2,5 мг, второй группе — разовая доза 2,5 мг. В стационарных условиях при анальгезии, контролируемой медперсоналом, родителями: базовая инфузия 0,015 мг/кг/ч, болюсная доза — 0,015 мг/кг. Минимальный интервал между болюсами на фоне продолжающейся инфузии — 10–15 минут (максимально 4–6 болюсов за 1 час).
Наиболее простой метод подбора суточной дозы обезболивания — назначение морфина короткого действия каждые 4 часа, т. е. 6 раз в сутки (например, в 6:00, 10:00, 14:00, 18:00, 22:00, 02:00). Регулярно принимаемая доза называется основной. Для купирования болей, внезапно возникающих на фоне приема основных доз, должна быть введена резервная обезболивающая доза.
Если боль возникает ранее установленного времени приема морфина, резервную дозу пациент может принимать столько раз, сколько это необходимо. Интервал между приемами резервных доз — не менее 1 часа. Время приема основных доз не сдвигается, даже если резервная была введена за 30 минут до приема основной. После использования начальной дозы дальнейшее введение препарата корректируют до достижения эффективного обезболивания. При этом максимальное повышение дозы в амбулаторных условиях не должно превышать 50 % в сутки.
Основную дозу морфина нужно пересматривать ежедневно с учетом принятых резервных доз за прошедшие сутки. Если пациенту понадобились 1–2 резервные дозы, можно подождать 2–3 дня и не увеличивать основную суточную дозу. Если вводились 3 и более резервных доз, то следует пересчитать основную. При расчете новой суточной основной дозы необходимо к основной за прошедшие сутки добавить сумму всех принятых за сутки резервных доз. Потом рассчитать новую разовую основную дозу, разделив новую общую суточную дозу на 6 приемов. Т. е. нужно увеличивать разовую дозу препарата, а не кратность приема морфина.
После достижения обезболивающего эффекта — рассчитать суточную дозу и перевести на пролонгированный морфин. Морфина сульфат в таблетках пролонгированного действия (12 ч) следует принимать независимо от приема пищи, но с достаточным количеством жидкости. Таблетку нельзя делить, ее нужно проглатывать целиком, не разламывая и не разжевывая. Биодоступность морфина при его применении через рот составляет 30–50 %, поэтому разовая доза морфина 30 мг эквивалентна 10 мг морфина, введенного парентерально, но ее эффект продлен до 12 часов.
Морфин не имеет потолка анальгетического действия, в отдельных случаях при длительном применении дозы могут возрастать в десятки раз относительно стартовой.
С осторожностью следует назначать сильные опиоидные анальгетики пациентам с нарушениями функции почек или печени умеренной и тяжелой степени, как альтернативу использовать фентанил продленного действия.
Нежелательные реакции опиоидных анальгетиков
Могут выражаться в виде воздействия на ЖКТ (запор, тошнота/рвота), быть автономными (ксеростомия); возможны задержка мочи, ортостатическая гипотензия. Нарушения со стороны ЦНС — угнетение дыхания, сонливость, когнитивные нарушения, миоклонус, галлюцинации. Возможны повышенная потливость, кожный зуд.
Купируют нежелательные реакции, уменьшая дозу, если анальгезия хорошая. Смена опиоида показана, если анальгезия плохая и/или есть побочные эффекты средней и высокой степени тяжести. Для безопасного перехода с одного опиоидного анальгетика на другой необходимо выбранную эквипотенциальную (эквианальгетическую) дозу нового препарата при первом приеме снизить на 30–50 %, а затем, при отсутствии неблагоприятных эффектов, постепенно повышать до необходимой.
Нежелательные реакции морфина: нарушение функции почек (необходимо снижение дозы на 25–50 % или смена на другой опиоидный анальгетик); нарушение функции печени (в таком случае не стоит назначать морфин или необходимо снизить дозу); седативный эффект (купируется самостоятельно после 2–3 дней приема препарата); тошнота и рвота (купируется приемом противорвотных препаратов); запоры (необходима профилактика слабительными с первых дней приема морфина); зуд кожи (рекомендуется смена опиоидного анальгетика, местная терапия); задержка мочеиспускания (довольно редко, может потребоваться катетеризация мочевого пузыря); угнетение дыхания (дозозависимый эффект). При передозировке опиоидных анальгетиков в качестве антидота используют налоксон, проводится посиндромная терапия.
Самым сильным опиоидным анальгетиком среди препаратов, предназначенных для терапии хронической боли, является фентанил, который применяют в виде трансдермальной терапевтической системы (ТТС) (12,5; 25; 50; 75; 100 мкг/ч). Назначается детям старше 2 лет с толерантностью к морфину, получающим дозу перорального морфина более 45 мг, что соответствует примерно 12,5 мкг/ч фентанила. При переходе на фентанил с другого опиоидного анальгетика следует использовать таблицу эквианальгетических доз, уменьшая дозу нового препарата на 30–50 %, а в последующем, при отсутствии нежелательных реакций и при хорошей переносимости, увеличивать ее до эффективной.
ТТС наклеивается на сухую неповрежденную кожу в верхней половине туловища, где есть подкожно-жировая клетчатка. Допустима аппликация и на конечностях, если нет явлений лимфостаза или нарушения кровообращения. Перед аппликацией кожу промывают водой (без спирта или моющих средств) и вытирают насухо. Повторное применение ТТС на этом участке возможно не ранее чем через 6 дней. После аппликации ТТС максимальный эффект наступает через 18–24 часа, поэтому в течение первых суток необходимо сохранять прежнюю обезболивающую терапию. ТТС нельзя назначать для лечения боли в ургентных состояниях, при повышенной температуре, обильном потоотделении, выраженной кахексии и отсутствии у пациента подкожной жировой клетчатки.
Отмена морфина и других наркотических анальгетиков после кратковременной терапии (7–14 суток): дозу уменьшают на 10–20 % от начальной каждые 8 часов, постепенно увеличивая интервалы между введениями. После длительного лечения снижение дозы проводится не более чем на 10–20 % в неделю или путем постепенного ее уменьшения на 1/3 каждые 3 дня.
Концепция сбалансированной анальгезии
Адъюванты применяются для снижения интенсивности боли, которую не удалось устранить с помощью монотерапии анальгетиками. При спазмах скелетных мышц назначают миорелаксанты центрального действия и бензодиазепины. При спазмах гладкой мускулатуры — миотропные спазмолитики. Глюкокортикоиды применяют при перитуморальном отеке, внутричерепной гипертензии при опухолях ЦНС, нейропатической боли за счет сдавления спинного мозга или периферических нервов.
Адъюванты (антиконвульсанты, трициклические антидепрессанты) могут быть препаратами первой линии для терапии нейропатической боли. Габапентин внутрь назначают детям в возрасте 2–12 лет по схеме: 1-й день по 10 мг/кг однократно, 2-й — по 10 мг/кг 2 раза в день, 3-й — по 10 мг/кг 3 раза, в дальнейшем доза может быть увеличена до 20 мг/кг (максимальная разовая доза 600 мг). Детям в возрасте 12–18 лет: 1-й день — по 300 мг однократно, 2-й — по 300 мг 2 раза, 3-й день — по 300 мг 3 раза в сутки, максимальная доза по 800 мг 3 раза в сутки. Отменять постепенно в течение 7–14 дней; нельзя использовать у детей с психическими заболеваниями в анамнезе.
Карбамазепин: начальная разовая доза 2,5 мг/кг, внутрь каждые 12 часов, максимальная суточная доза 20 мг/кг, увеличивать постепенно, каждые 3–7 дней, чтобы избежать нежелательных реакций.
Амитриптилин внутрь: детям в возрасте от 2 до 12 лет разовая доза 0,2–0,5 мг/кг (максимальная суточная 25 мг) на ночь; детям в возрасте 12–18 лет назначают 10–25 мг на ночь (при необходимости можно увеличить до максимальной суточной 75 мг).
Мультимодальная анальгезия, основанная на принципах ВОЗ, включает не только использование нескольких болеутоляющих препаратов (опиоидов, неопиоидов, адъювантов), но и интегративную терапию (массаж, гипноз, тепло/холод и т. д.), а также при необходимости инвазивные методы (местная анестезия, лечебная блокада и др.).
Нужно лечить причину, лежащую в основе; определить тип боли; использовать нефармакологические и фармакологические методы обезболивания; принимать во внимание психосоциальный стресс у пациента; регулярно оценивать в динамике статус боли и ответ на лечение.