В кишечнике обитают миллионы бактерий, которые в совокупности известны как микробиом. Это сообщество микроорганизмов играет центральную роль в сохранении здоровья человека, «обучая» иммунные клетки поддерживать иммунный гомеостаз. Микробиота кишечника разнообразна и состоит из множества различных видов бактерий. Согласно данным проекта «Микробиом человека» (The Human Microbiome Project), в кишечнике содержится до 10 тысяч различных видов, насчитывающих триллионы клеток: полезные комменсальные бактерии, такие как Bifidobacterium и Lactobacillus, нейтральные штаммы, а также некоторые потенциально вредные бактерии, такие как Clostridia.
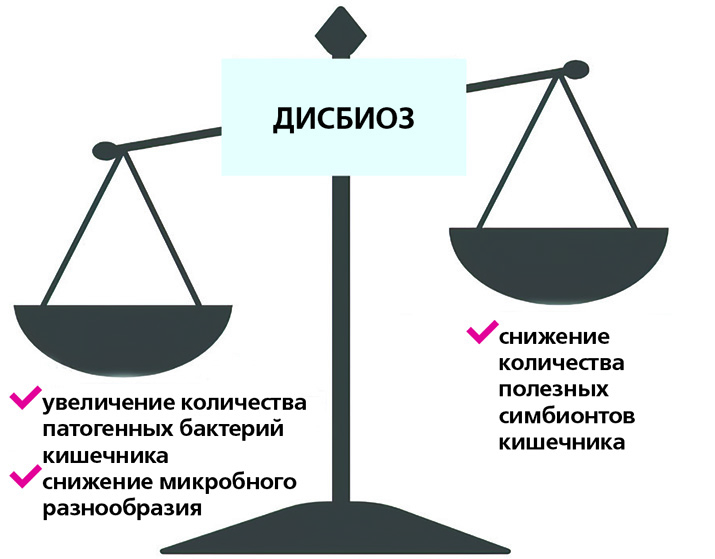
В зависимости от разнообразия и баланса бактерий кишечника микробиом может ингибировать либо способствовать развитию иммунного ответа. Несбалансированный микробиом, известный как дисбиоз, связан с хроническим воспалением и может увеличить риск развития воспалительных заболеваний кишечника, аутоиммунных патологий и других болезней. Однако воздействуя на микробиом кишечника, можно предотвратить развитие воспалительных реакций.
Регуляция баланса микроорганизмов
 Состав микробиоты кишечника имеет две характеристики: разнообразие (количество видов микроорганизмов, присутствующих в кишечнике) и богатство (общее количество присутствующих микроорганизмов). Нарушение хотя бы одной из них нередко приводит к заболеваниям.
Состав микробиоты кишечника имеет две характеристики: разнообразие (количество видов микроорганизмов, присутствующих в кишечнике) и богатство (общее количество присутствующих микроорганизмов). Нарушение хотя бы одной из них нередко приводит к заболеваниям.
Ключ к созданию и управлению здоровой микробиотой кишечника и таким образом к реализации ее полезного воздействия на здоровье человека — в регуляции баланса между полезными и патогенными микроорганизмами.
Диета играет решающую роль, не только обеспечивая сбалансированность поступления энергии, но и поставляя определенные питательные вещества, которые непосредственно влияют на состав микробиоты.
Добавление пребиотиков необходимо для оптимальной функции кишечной микробиоты. Положительное влияние пребиотиков на рост и активность микробиоты хорошо изучено, в частности, способность питать полезные комменсальные бактерии, одновременно помогая подавлять вредные.
Роль микробиоты
Ключевые функции бактерий кишечника связаны с метаболизмом, синтезом многих веществ, защитой от инвазии патогенов и регуляцией иммунной системы.
Если бы не кишечный микробиом, организму не хватало бы ряда полезных для него веществ, включая витамины и аминокислоты. Одной из важнейших ролей кишечного микробиома является способность к ферментации неперевариваемых волокон. Эти волокна выступают питательными веществами для группы, производящей короткоцепочечные жирные кислоты (КЦЖК). Наиболее необходимые производимые КЦЖК — ацетат, пропионат и бутират.
Бутират является важным источником энергии для клеток внутренней оболочки толстой кишки (колоноцитов). Считается, что недостаток КЦЖК играет ключевую роль во многих проблемах, связанных с микробиомом, а также приводит к запуску местного воспаления. Бутират выполняет ряд функций в организме человека, включая способность вызывать апоптоз клеток рака толстой кишки, участвует в активации кишечного глюконеогенеза, что имеет значение для энергетического баланса и связано с патогенезом сахарного диабета. Кроме того, он также может стимулировать «иммуноуспокаивающие» Treg клетки.
Пропионат необходим для контроля уровня глюкозы, поскольку он регулирует глюконеогенез в печени и участвует в передаче сигналов о насыщении.
Ацетат участвует в регуляции метаболизма внекишечных тканей, включая метаболизм холестерина и липогенез.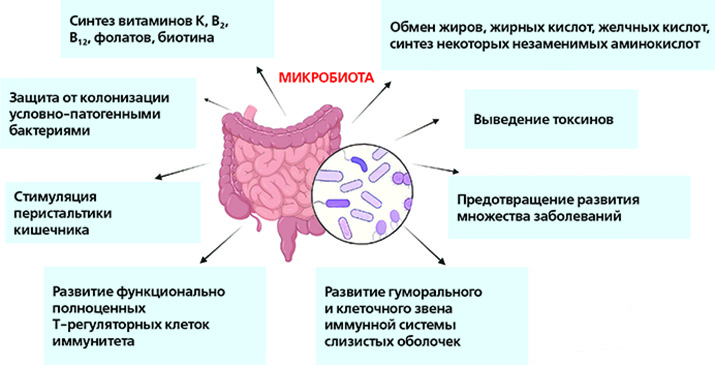
Связь между кишечником и иммунной системой
Пищеварительную систему называют первичной системой иммунной защиты, поскольку она является основным звеном между внешней средой и внутренними системами нашего организма. Иммунная система и микробиота кишечника находятся в симбиотических отношениях, чтобы поддерживать и регулировать друг друга. Значимость этого взаимодействия подчеркивается тем фактом, что 70–80 % иммунных клеток организма находятся в кишечнике.
Микробиота кишечника формируется у новорожденных и сохраняется на протяжении всей жизни. По мере развития организма микробиота участвует в формировании иммунной системы, а та в свою очередь влияет на состав микробиоты. Здоровый пищеварительный тракт защищает организм от внешних факторов.
Полезные бактерии в кишечнике, такие как Bifidobacterium и Lactobacillus, принимаю участие в регуляции иммунной системы: подавляют рост патогенов, конкурируют за биологические вещества, поддерживают развитие иммунных клеток, борясь с воспалением, защищают кишечный барьер, вырабатывая продукты метаболизма и способствуя регуляции иммунных ответов.
Помимо «обучения» иммунных клеток, кишечные бактерии и их метаболиты могут «успокаивать» иммунную систему или вызывать развитие воспалительных реакций. Новые исследования также показывают, что состав микробиома может влиять на выработку интерлейкина-10, мощного противовоспалительного цитокина.
С другой стороны, некоторые бактерии производят провоспалительные вещества, активируя цитокины и Т-хелперы, запуская иммунный ответ.
Грамотрицательные бактерии содержат липополисахариды в своей внешней оболочке, эндотоксин, который способствует воспалительной реакции. Когда грамотрицательные бактерии погибают, эндотоксины выделяются в окружающую среду. Если эти соединения пересекают слизистую оболочку кишечника и попадают в кровоток, они могут привести к хроническому и системному воспалению.
В частности, дисбаланс в микробиоме связан с повышенной проницаемостью эпителиального барьера кишечника, более известной как «дырявый кишечник». Липополисахариды бактерий могут попасть в системный кровоток, вызывая развитие воспалительных реакций со стороны рецепторов клеток иммунитета.
В отличие от генов микробиом динамичен и реагирует на диету и образ жизни. Поэтому мы можем поддержать иммунное здоровье, соблюдая диету, богатую пребиотическими растительными волокнами и с низким содержанием жиров. Таким образом стимулирется выработка противовоспалительных метаболитов, таких как бутират.
Дисбаланс в кишечнике может стать активатором болезни
Изменения в микробиоте кишечника коррелируют почти со всеми известными иммунологическими заболеваниями, но в большинстве случаев остается неясным, являются ли эти изменения причиной или следствием заболевания либо просто отражением эпидемиологических различий между группами. Представители микробиоты кишечника участвуют в модуляции иммунитета организма, а также в развитии и прогрессировании множества заболеваний: атеросклероза, ожирения, СД 1-го типа, воспалительных заболеваний кишечника, синдрома раздраженного кишечника, хронической обструктивной болезни легких, атопических заболеваний, депрессии, аутизма и др.
Есть мнение, что микробиота кишечника может быть связана с развитием таких нейродегенеративных заболеваний, как болезнь Альцгеймера и болезнь Паркинсона. Действительно, существует двунаправленная связь между кишечником и мозгом, так называемая ось «мозг — кишечник», и микробиота кишечника может влиять на взаимодействие этих органов. Вот почему наш кишечник иногда называют вторым мозгом.
Изменения микробиоты при первичных иммунодефицитах
Первичные иммунодефициты (ПИД) — группа гетерогенных генетических заболеваний, приводящих к развитию как качественной и (или) функциональной недостаточности, так и к неконтролируемой активации пролиферации иммунокомпетентных клеток и формированию аутоиммунных, аутовоспалительных и аллергических заболеваний. Генетические дефекты, вызывающие ПИД, приводят к нарушениям традиционных механизмов, лежащих в основе гомеостаза в кишечнике, при этом происходит нарушение иммунного надзора за кишечным барьером, изменение кишечной проницаемости, бактериальная транслокация.
Под влиянием определенных факторов окружающей среды и генетической предрасположенности человека аберрантные взаимодействия между микробиомом и иммунной системой хозяина способствуют развитию различных иммуноопосредованных нарушений.
Например, при ВЗК-подобных патологиях, часто возникающих у пациентов с ПИД, использование антибиотиков или диетические изменения при наличии генетической предрасположенности (например, мутация NOD2) могут привести к изменениям конфигурации микробиома кишечника, включая уменьшение богатства и нарушение таксономического и метаболитного состава. Эти изменения микробиома тесно связаны с аберрантными иммунными реакциями слизистых оболочек, включая усиленные реакции клеток типа Th17, Th1 и Th2, подавление Т-регуляторных клеток и нарушение регуляции гуморального иммунитета. В конечном итоге это может привести к хроническому, клинически выраженному воспалению кишечника и повреждению тканей.
По многочисленным литературным данным, ассоциированные со здоровьем микробные сообщества истощены у пациентов с ПИД. Микробные сообщества кишечника у таких пациентов значительно отличаются от здоровых по разнообразию и составу. Одной из объединяющих характеристик микробиома при ПИД является снижение разнообразия бактерий кишечника.
Другой общей чертой исследований у пациентов с ПИД является транслокация липосахаридов (ЛПС) в воспалительных очагах и в системном кровотоке. Бактериальный ЛПС связан с хронической иммунной активацией и иммунной дисрегуляцией.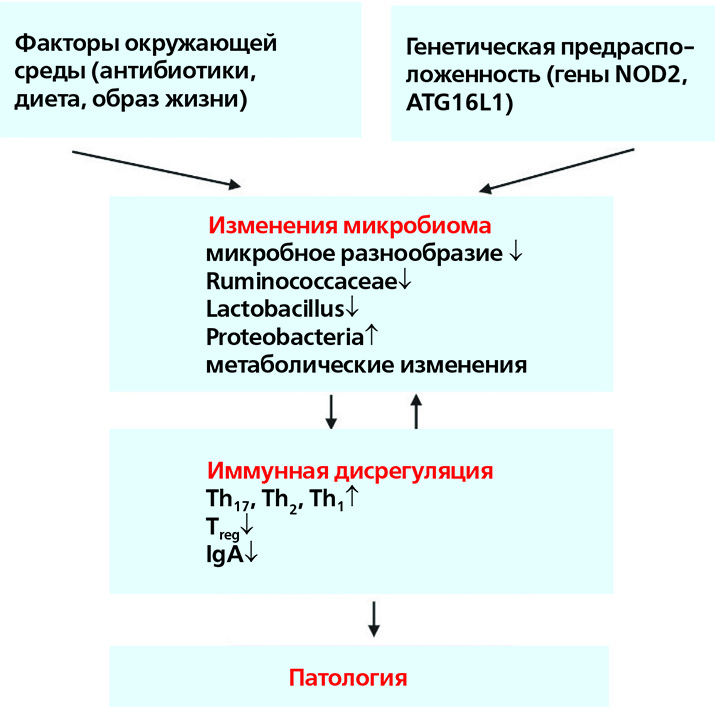
Микробиота при аутоиммунных патологиях
Данные убедительно свидетельствуют о том, что существует определенная степень взаимодействия между аутоиммунным заболеванием и здоровьем микробиома кишечника. Однако необходимы дополнительные исследования, чтобы определить, являются ли нарушения микробиома причиной аутоиммунного заболевания, следствием или и тем, и другим сразу.
Микробиом пациентов с системной красной волчанкой, по литературным данным, характеризуется значительным снижением микробного разнообразия, а также увеличением численности вида Ruminococcus gnavus. Эти изменения также коррелируют с тяжестью течения заболевания.
Существует очевидная связь между обострениями болезни Крона и численностью бактерий Ruminococcus gnavus в кишечнике. R. gnavus является типичным представителем микробиома кишечника человека, но производит вредные полисахариды, оказывающие в большом количестве воспалительное действие на организм.
При СД 1-го типа у пациентов часто наблюдается «дырявый кишечник», Исследования показывают, что дисбиоз может влиять на патогенез СД 1-го типа, воздействуя на иммунный гомеостаз и тем самым приводя к данному патологическому состоянию.
Проводятся также исследования по анализу микробиома у пациентов с рассеянным склерозом: отмечается дисбиоз, особенно при отсутствии или чрезмерном преобладании нескольких родов и видов микробов.
Среди них некоторые виды вовлечены в повышенную экспрессию генов, которые участвуют как во врожденном, так и в адаптивном иммунитете.
Еще одним аутоиммунным заболеванием, при котором отмечаются изменения микробиома, является ревматоидный артрит: по сравнению с составом бактерий кишечника здоровых людей, у пациентов с ревматоидным артритом отмечается повышенная численность одних бактерий и сниженное количество других, что приводит к воспалительным реакциям в кишечнике.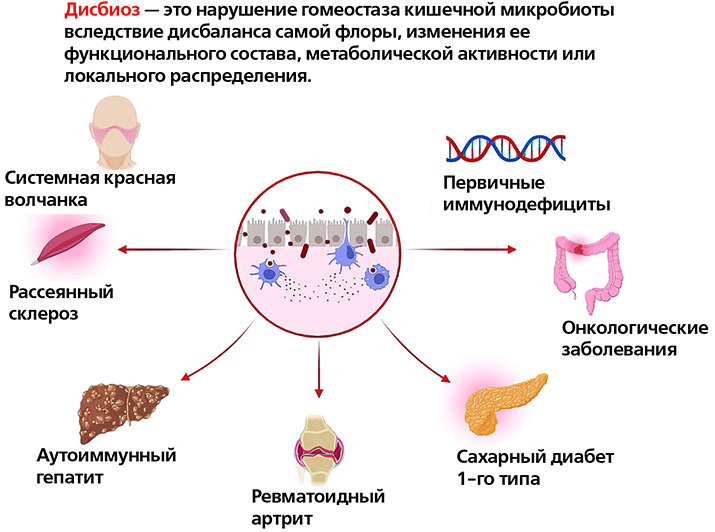
Микробиом и онкология
Считается, что взаимодействие между микробиотой кишечника и иммунной системой влияет на иммунный надзор за онкологическими заболеваниями. При раке толстого кишечника уничтожение опухолей естественными киллерами (NK-клетками) напрямую ингибируется присутствием вида Fusobacterium nucleatum в микроокружении опухоли.
Более высокое количество бактерий F. nucleatum при колоректальном раке связано с более низкой плотностью CD3+T-клеток — популяции клеток иммунной системы, связанной с более благоприятным клиническим исходом. В печени комменсальные бактерии рода Clostridium желудочно-кишечного тракта используют желчные кислоты в качестве мессенджеров для усиления противоопухолевого эффекта печеночных клеток CXCR6+ NKT, поражая как первичные, так и метастатические опухоли печени.
Различные мировые исследователи пришли к выводу о том, что микробиом также модулирует ответы противоопухолевой иммунотерапии. Например, более высокое содержание комменсалов Bifidobacterium longum, Collinsella aerofaciens и Enterococcus faecium стимулирует более благоприятный Т-клеточно-опосредованный ответ на анти-PD-1-терапию у пациентов c меланомой.
Описана положительная корреляция между количеством таксона Akkermansia muciniphila и эффективностью блокады PD-1 у пациентов с эпителиальными опухолями. Иммунный ответ на другие противораковые методы лечения онкологических заболеваний, включая блокаду CTLA-4 и циклофосфамид, также был связан с различными конфигурациями микробиома кишечника. Выяснение роли кишечного микробиома в противоопухолевом иммунном надзоре и иммунотерапии может иметь большие перспективы в оптимизации ответа на лечение у онкологических больных.