Лучевая терапия является важным компонентом лечения большинства злокачественных опухолей и ряда доброкачественных образований. Однако, как и любой другой метод лечения, она может принести не только пользу, но и вызвать тяжелые осложнения, которые могут отрицательно повлиять на качество жизни и даже представлять угрозу для жизни пациента.
 Ольга ГиземоваОсновной целью лучевой терапии является достижение баланса между вероятностью контроля над опухолевым ростом и вероятностью развития осложнений в нормальных тканях. Именно для этого совершенствуется медицинское оборудование для проведения облучения, развиваются высокотехнологичные методики лучевой терапии, используются различные режимы фракционирования и радиомодификаторы.
Ольга ГиземоваОсновной целью лучевой терапии является достижение баланса между вероятностью контроля над опухолевым ростом и вероятностью развития осложнений в нормальных тканях. Именно для этого совершенствуется медицинское оборудование для проведения облучения, развиваются высокотехнологичные методики лучевой терапии, используются различные режимы фракционирования и радиомодификаторы.
При проведении лучевого лечения злокачественных опухолей в зону облучения, как правило, включается не только макроскопический видимый объем опухоли (GTV), но и зона субклинического распространения опухоли (СТV), в которой находятся как еще недоступные для визуализации опухолевые клетки, так и довольно большой объем нормальных тканей. Кроме этого, необходимо учитывать возможные погрешности укладки пациента во время сеансов лучевой терапии и другие технические моменты.
Для того чтобы не произошло недооблучения опухоли, необходимо делать отступы и формировать дополнительный объем (PTV), также включающий нормальные ткани.
Таким образом, и опухоль, и нормальные ткани, включенные в объем облучения, получают одну и ту же дозу. Чтобы достичь оптимального терапевтического отношения при облучении больших областей, включающих помимо опухоли значительные объемы нормальных тканей, применяется фракционированное облучение. Наиболее распространенным является режим классического (традиционного, стандартного) фракционирования: 1,8–2 Гр за фракцию, ежедневно, 5 дней в неделю в течение 4–7 недель до достижения необходимой суммарной дозы. Радиобиологическая основа фракционирования — в том, что процессы восстановления в нормальных тканях протекают более полно и в более короткие сроки, чем в опухоли. За интервал между фракциями клетки нормальных тканей успевают в значительной мере восстановить повреждения.
Использование высокотехнологичных методик облучения, таких как лучевая терапия с модулированной интенсивностью (IMRT), лучевая терапия, модулированная по объему (VMAT), а также применение протонной терапии позволяет минимизировать лучевую нагрузку на нормальные ткани и снизить риск лучевых осложнений.
Однако при лечении опухолей, обладающих низкой чувствительностью к ионизирующему излучению (радиорезистентных), лучевая терапия в режиме классического фракционирования неэффективна. Возникает необходимость применения высокодозной лучевой терапии. В отличие от традиционного фракционирования высокодозное облучение (особенно ≥10 Гр за фракцию) предполагает значительно более мощный радиобиологический эффект посредством сосудисто-эндотелиального апоптоза и иммунных механизмов.
Высокодозное облучение может быть реализовано путем стереотаксической радиохирургии (однофракционное облучение) или стереотаксической гипофракционированной лучевой терапии (обычно 3–5 фракций). Использование этих методов возможно лишь при небольших объемах четко визуализируемых опухолей, минимальном включении в зону облучения здоровых тканей и очень надежной фиксации облучаемой части тела. Высокодозное облучение требует высокой квалификации и особой концентрации внимания медицинских работников, так как любая погрешность в процессе подготовки пациента и реализации лучевой терапии может привести к тяжелой лучевой токсичности.
Нормальные ткани обладают различной чувствительностью к ионизирующему излучению. Наиболее чувствительными являются лимфоциты, незрелые кроветворные клетки, кишечный эпителий, сперматогонии, клетки фолликулов яичника. Наименее чувствительны к излучению зрелые эритроциты, мышечные клетки, зрелая соединительная ткань, зрелые кости и хрящи, ганглиозные клетки.
При планировании лучевой терапии необходимо учитывать толерантность нормальных тканей к ионизирующему излучению. Существуют понятия минимальной и максимальной толерантной дозы. Минимальная толерантная (переносимая) доза — это доза, приводящая не более чем к 5 % тяжелых осложнений в течение 5 лет после лечения. Максимальная толерантная доза приводит не более чем к 50 % тяжелых осложнений в течение 5 лет после лечения.
В 1991 году группа профессора Эмами опубликовала результаты исследования, в котором определили минимальные и максимальные толерантные дозы для различных органов и тканей при облучении в режиме классического фракционирования. Так, например, для зрительных нервов и хиазмы была указана минимальная толерантная доза 50 Гр. При соблюдении данного параметра риск развития слепоты не будет превышать 5 % в течение 5 лет после облучения.
Однако данное исследование было построено на небольшом числе наблюдений. Для получения более надежной прогностической модели была создана международная группа QUANTEC (Quantitative Analyses of Normal Tissue Effects in the Clinic), рекомендации которой основаны на многочисленных исследованиях, проведенных на больших выборках пациентов. На сегодняшний день определены толерантные дозы для большинства органов и тканей при проведении лучевого лечения не только в режиме классического фракционирования, но и для однофракционной радиохирургии, и для гипофракционирования с использованием 3 и 5 фракций облучения. Хотя данная модель не лишена недостатков, рекомендациями QUANTEC руководствуются при планировании лучевой терапии в настоящее время во многих онкологических центрах.
Важным моментом в планировании лучевого лечения и профилактике осложнений является понимание того, насколько быстро реагирует та или иная нормальная ткань и опухоль на лучевое воздействие. Для оценки реакции опухолей и нормальных тканей на изменения в схемах фракционирования была разработана линейно-квадратичная модель. На основании кривых выживаемости клеток определено соотношение α/β, где α — линейная компонента, описывает гибель клеток, обусловленную одномоментными двойными разрывами ДНК, β — квадратичная компонента, описывает гибель клеток за счет накопления одиночных разрывов ДНК. Высокие соотношения α/β характерны для рано реагирующих тканей и большинства опухолей (примерно от 7 до 20 Гр, в среднем около 10 Гр), низкие — для поздно реагирующих тканей (примерно от 1 до 6 Гр, в среднем около 3 Гр). Соотношения α/β определены для большинства опухолей и нормальных тканей. Например, слизистые быстро реагируют на излучение, для них значение α/β = 8–15 Гр, а для нормальной мозговой ткани характерны поздние реакции, α/β = 3 Гр.
Для большинства опухолей характерны высокие значения α/β. Однако для меланомы, саркомы, почечно-клеточного рака и некоторых других опухолей показатели α/β очень низкие, эти опухоли слабо реагируют на лучевое воздействие, они радиорезистентны.
При лечении радиорезистентных опухолей часто используется облучение высокими разовыми дозами, чтобы включить все возможные эффекты высокодозного облучения. При этом целесообразно применять стереотаксические методы, чтобы максимально снизить нагрузку на здоровые ткани и минимизировать риск лучевых осложнений.
При оценке побочных эффектов лучевой терапии следует различать острую и позднюю лучевую токсичность. Первая возникает во время лучевой терапии или в течение 90 дней после окончания облучения. В основе ее развития лежит изменение проницаемости сосудов (воспаление) и истощение быстро делящихся стволовых клеток. Поздняя лучевая токсичность возникает более чем через 90 дней после окончания облучения. В основе — потеря нормального микроциркуляторного русла, фиброзное замещение нормальной тканевой структуры.
Согласно рекомендациям RTOG/EORTC (Radiation Therapy Oncology Group/European Organization for Research and Treatment of Cancer), острая и поздняя лучевая токсичность разделяется на степени от нулевой до пятой, где нулевая степень — отсутствие симптомов, а пятая — смерть, непосредственно связанная с воздействием радиации. Так, например, острая лучевая токсичность 1-й степени со стороны слизистых проявляется гиперемией, а 4-й степени — изъязвлениями, некрозами и кровотечениями. В своей повседневной практике врачи — радиационные онкологи используют данную шкалу для оценки побочных эффектов лучевой терапии и определения тактики лечения пациента.
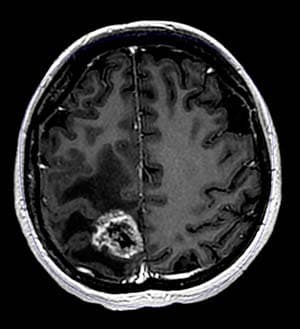 Рисунок. Радионекроз в правой лобно-теменной области головного мозгаВ шкале оценки нежелательных явлений CTCAE (Common Terminology Criteria for Adverse Events) выделено 5 степеней тяжести всех возможных побочных эффектов лечения с уникальными клиническими описаниями каждого эффекта. Например, подробно описаны осложнения со стороны нервной системы: головная боль, нейрокогнитивные нарушения, нарушения со стороны черепно-мозговых нервов, проявления отека головного мозга и радионекроза и другие явления. На рисунке продемонстрирована МР-картина радионекроза в правой лобно-теменной области головного мозга, клинически проявляющегося судорожным синдромом и гемипарезом (3-я степень тяжести по шкале CTCAE).
Рисунок. Радионекроз в правой лобно-теменной области головного мозгаВ шкале оценки нежелательных явлений CTCAE (Common Terminology Criteria for Adverse Events) выделено 5 степеней тяжести всех возможных побочных эффектов лечения с уникальными клиническими описаниями каждого эффекта. Например, подробно описаны осложнения со стороны нервной системы: головная боль, нейрокогнитивные нарушения, нарушения со стороны черепно-мозговых нервов, проявления отека головного мозга и радионекроза и другие явления. На рисунке продемонстрирована МР-картина радионекроза в правой лобно-теменной области головного мозга, клинически проявляющегося судорожным синдромом и гемипарезом (3-я степень тяжести по шкале CTCAE).
Шкала CTCAE в радиотерапии часто используется для оценки результатов научных исследований, сравнения различных методов и режимов лучевого лечения.
В практике принято различать лучевые реакции и лучевые повреждения. К лучевым реакциям относят изменения (функциональные или морфологические), возникающие в процессе лучевой терапии или непосредственно после ее окончания и носящие обратимый характер. Зачастую они не требуют специального лечения.
Но для того, чтобы облегчить состояние пациента и помочь ему завершить курс лучевой терапии, радиационный онколог может назначить лечение, купирующее возникшие симптомы.
Лучевые повреждения — функциональные и морфологические изменения органов и тканей, которые носят необратимый характер и требуют специального лечения.
Они могут существенно ухудшить качество жизни человека. В связи с этим необходимо как можно более раннее лечение лучевых повреждений, которое должно быть комплексным и по возможности радикальным.
Хотя в нынешних условиях больше внимания уделяется вышеописанным местным лучевым осложнениям, нельзя забывать и про общие лучевые реакции, которые могут проявляться повышенной раздражительностью, головной болью, головокружением, нарушением сна, изменениями со стороны крови и другими симптомами. В связи с использованием в настоящее время современного оборудования для лучевой терапии и высокотехнологичных методов облучения общие реакции, как правило, неярко выражены и обратимы.
Для профилактики общих лучевых реакций пациенту необходимо соблюдать режим дня, полноценно отдыхать, уделять внимание правильному питанию и прогулкам на свежем воздухе.
P.S. Полностью избежать побочных эффектов лучевой терапии невозможно. Однако знание основ радиобиологии, понимание механизмов развития лучевой токсичности, четкая оценка степени тяжести нежелательных явлений, использование высокотехнологичных методов, тщательный анализ планов лучевого лечения, а также внимательное отношение к пациенту необходимы для снижения риска тяжелых лучевых осложнений и оказания своевременной и качественной помощи пациенту во время и после окончания лучевого лечения.
