Первый международный конгресс специалистов СНГ в области респираторного здоровья стал площадкой для выступления ведущих пульмонологов, фтизиатров и других заинтересованных специалистов. Заместитель директора по научной работе РНПЦ пульмонологии и фтизиатрии, профессор кафедры кардиологии и внутренних болезней БГМУ, кандидат мед. наук Дмитрий Рузанов представил доклад на тему «Рациональная антибиотикотерапия респираторной инфекции: между Сциллой и Харибдой». Сегодня специалист отвечает на вопросы «Медицинского вестника».
В названии вашего доклада упоминаются Сцилла и Харибда. Как эта отсылка относится к антибиотикотерапии?
 Дмитрий РузановДа, название отсылает нас к древнегреческой мифологии, согласно которой на прибрежных скалах по обе стороны узкого пролива обитали два чудовища: Сцилла и Харибда, губившие мореплавателей. Когда мы говорим об антибиотикотерапии (АБТ), то выражение «между Сциллой и Харибдой» очень хорошо описывает подход к ее рациональному применению: с одной стороны, нужно предвидеть возможную неэффективность антибиотиков, в том числе оценивать широту спектра действия, с другой — предвидеть нежелательные лекарственные реакции (НЛР), в том числе формирование антибиотикорезистентности. Выступая на конгрессе, я проиллюстрировал эту дилемму старинной литографией, которая показывает сложность лавирования между эффективностью АБ-терапии и НЛР.
Дмитрий РузановДа, название отсылает нас к древнегреческой мифологии, согласно которой на прибрежных скалах по обе стороны узкого пролива обитали два чудовища: Сцилла и Харибда, губившие мореплавателей. Когда мы говорим об антибиотикотерапии (АБТ), то выражение «между Сциллой и Харибдой» очень хорошо описывает подход к ее рациональному применению: с одной стороны, нужно предвидеть возможную неэффективность антибиотиков, в том числе оценивать широту спектра действия, с другой — предвидеть нежелательные лекарственные реакции (НЛР), в том числе формирование антибиотикорезистентности. Выступая на конгрессе, я проиллюстрировал эту дилемму старинной литографией, которая показывает сложность лавирования между эффективностью АБ-терапии и НЛР.
Дмитрий Юрьевич, а что такое рациональная антибиотикотерапия и каковы ее основные принципы?
По сути, это и есть процесс выбора — лавирования в клинической практике. Рациональная АБТ — это обоснованное, эффективное и безопасное использование антибактериальных препаратов, направленное на излечение пациента, минимизацию побочных эффектов, снижение селекции резистентных штаммов, оптимизацию затрат здравоохранения. Что касается принципов, то давайте представим себе ладонь с пятью пальцами: каждый из них — это один из главных принципов рациональной антибиотикотерапии, та база, которой должен следовать доктор, когда сталкивается с необходимостью решить, нужна ли пациенту такая терапия и каким образом ее проводить. Первый вопрос, на который отвечает врач, видя пациента с определенными симптомами, как раз о том, нужна ли в этом конкретном случае АБ-терапия. Это и есть первый принцип рациональной АБТ — показания.
Второй принцип касается правильного выбора препарата: спектр его действия, фармакокинетика/фармакодинамика. Третий — дозировка и продолжительность — ни больше, ни меньше; четвертый — вопрос о пути введения: пероральный, парентеральный, ступенчатая терапия; и, наконец, пятый основной принцип — оценка эффективности и нежелательных реакций (когда менять или отменять препарат?).
Говоря об АБТ, все чаще используют еще один термин — антимикробный стюардшип. Вы, выступая на конгрессе, тоже его применяли. Что же он означает?
Антимикробный стюардшип — это скоординированная система мер, направленная на оптимизацию использования антимикробных препаратов для повышения эффективности лечения, снижения риска развития резистентности и уменьшения НЛР. В общем, речь идет опять же об антимикробной терапии, некоем комплексе мероприятий для рациональной АБТ, но не по отношению к каждому отдельному врачу, а по отношению ко всей системе — от учреждения до страны в целом. Это уже системное понятие и, конечно, это все та же история про Сциллу и Харибду — лавирование между двумя опасностями.
Нужно, сохраняя высокую эффективность антибиотика, предотвратить рост антибиотикорезистентности в стране, и все это с максимальным экономическим эффектом.
Предлагаю перейти к более подробному рассказу о принципах рациональной антибиотикотерапии. Первый из них, как мы помним, — показания к применению АБ.
Антибиотик принесет больше вреда, чем пользы, если назначать его без объективных признаков инфекции.
Сейчас на практике все чаще используется такое понятие, как презумпция неназначения антибиотика, другими словами, если антибиотик не показан, он противопоказан.
Дело в том, что современные представления о микробиоме человека изменили отношение к антибиотикам. Сегодня мы говорим о том, что, назначив антибиотик, мы нанесем существенный вред не только микробиому желудочно-кишечного тракта, но и микробиоте респираторного тракта — верхних и нижних дыхательных путей, а также коже, мочеполовой сфере. Мы уже знаем, что антибиотик способен менять микробиом и метаболом, тем самым нарушая равновесие между провоспалительными и противовоспалительными реакциями. Целый ряд исследований посвящен развитию заболеваний на фоне дисбиоза, и часто используемый термин «нездоровое старение» ассоциирован с дисбиозом.
Второй очень важный аспект бесконтрольного использования антибиотиков — это прогрессирование антибиотикорезистентности. То есть, назначая антибиотики, мы повышаем вероятность так называемого марша антибиотикорезистентности: сначала теряем амоксициллин, позже — защищенные аминопенициллины, потом всю линейку цефалоспоринов, затем — госпитальные карбапенемы, а с ними и весь класс бета-лактамных антибиотиков. То есть, назначив сегодня антибиотик на всякий случай, профилактически пациенту с просто температурой и кашлем, мы, возможно, лишаем его шанса в дальнейшем выжить на фоне тяжелой пневмонии, поскольку человека просто нечем будет лечить.
Еще одно критичное заблуждение — это правило третьего дня, которое гласит: «Если температура у пациента держится больше, чем три дня, нужно назначить антибиотик; инфекция, скорее всего, бактериальная».
Но это заблуждение, не основанное на реальной цикличности вирусной респираторной инфекции, поскольку большинство респираторных вирусов — аденовирусов, вирусов гриппа, парагриппа и других — в среднем проходят семидневный цикл от начала персистирования до элиминации из организма. Для этих вирусов допустима лихорадочная реакция порядка 7–8 дней. И день, когда у пациента снизится интоксикация, — пятые сутки, а не третьи.
Посмотрите, что часто происходит: мы назначаем пациенту с ОРВИ антибиотик на 3–4-й день и на 5-й отмечаем снижение интоксикации. Совпадение, но и врач, и пациент подкрепляют свою уверенность, что «пока антибиотик не назначишь, температура не снизится». Конечно, определяя показания для назначения препарата, нужно провести аускультацию и исключить пневмонию, а также острый стрептококковый тонзиллит — взять шпатель и посмотреть пациенту горло.
Хорошо, допустим, врач решил, что антибиотик необходим, но как правильно выбрать препарат?
Респираторные инфекции в амбулаторной практике вызывает достаточно ограниченный круг микроорганизмов: Streptococcus pneumoniae, Haemophilus influenzae, Moraxella catarrhalis, Streptococcus pyogenes, Mycoplasma pneumoniae. Как видите, их тоже пять, как и основных принципов рациональной антибиотикотерапии. Назначая такую терапию, мы хотели бы уничтожить только эти конкретные виды микроорганизмов, не трогая другие — грамотрицательные бактерии, в том числе анаэробы, которые составляют большую часть микробиоты.
Мы не должны охватывать госпитальные возбудители, будем помнить о них, когда нужно лечить госпитальную инфекцию. Напомню, сейчас мы говорим об амбулаторном лечении респираторных инфекций. Поэтому следующий важнейший принцип АБТ — принцип минимальной достаточности: нужно уничтожить только целевого микроба, а для этого в большинстве случаев достаточно аминопенициллинов, в частности, амоксициллина или клавуланата амоксициллина.
Дмитрий Юрьевич, а как в реальности? Чем лечат респираторные инфекции в нашей стране?
Реальную практику позволяет оценить база данных Medmarket, которая показывает, что реализуют аптеки. Конечно, это очень условные данные, но тем не менее считается, что до 60–70 % амбулаторных антибиотиков используются в лечении респираторных инфекций. Вот таблица, которая наглядно демонстрирует, какие изменения произошли за 5 лет (2019–2024) в розничной продаже антибиотиков, и какие сюрпризы нам преподнес COVID-19 (см. рис. 1). И если в 2019 году соотношение между аминопенициллином и защищенными аминопенициллинами было оптимальным, то в последнее время наметилась тенденция превалирования амоксициллина/клавуланата (А/К).
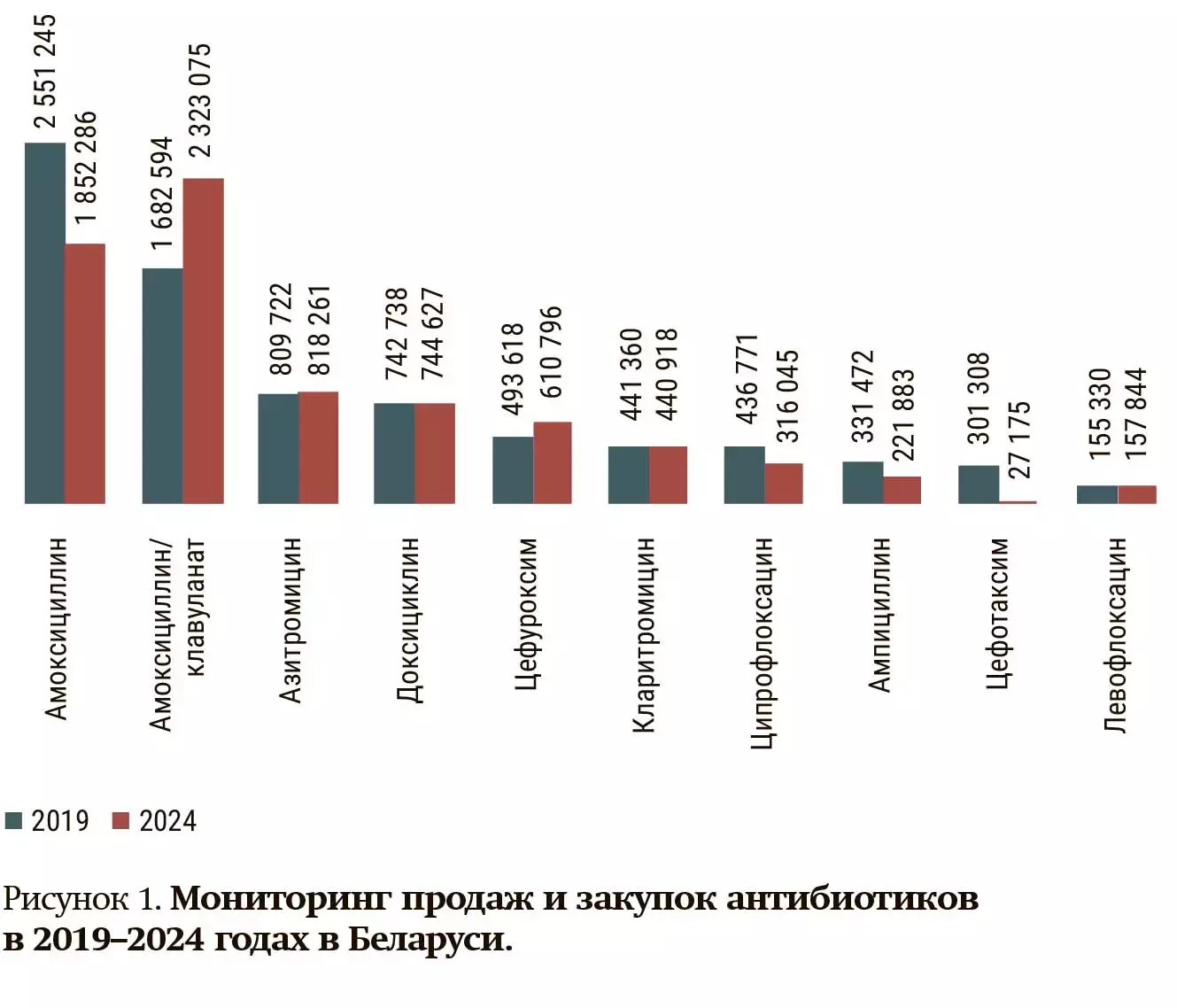
Как видно, амоксициллин/клавуланат широко используется как препарат по умолчанию в амбулаторной и госпитальной практике, несмотря на наличие показаний, при которых достаточно амоксициллина.
И почему это плохо? В чем проблема?
Дело в том, что при использовании амоксициллина/клавуланата не соблюдается принцип минимальной достаточности. Спектр активности у этого средства гораздо более широкий, чем требуется для лечения респираторной инфекции. Но при этом А/К обладает более широкой активностью, чем просто ампициллин, в отношении гемофильной палочки. В клинических ситуациях А/К следует использовать у пациентов с хроническими заболеваниями, в том числе ХОБЛ, у курильщиков, пожилых, у тех, кто раньше уже лечился аминопенициллинами и у них высокий риск бактерий с β-лактамазами. Упрощая, можно предложить алгоритм стартовой АБТ, которая исключает «нереспираторные» антибиотики: фторхинолоны 2-го поколения, ко-тримоксазол, аминогликозиды, цефалоспорины 1-го поколения, эритромицин (см. рис. 2). Респираторные фторхинолоны не должны назначаться рутинно, учитывая, что НЛР у них существенно выше, чем у аминопенициллинов.
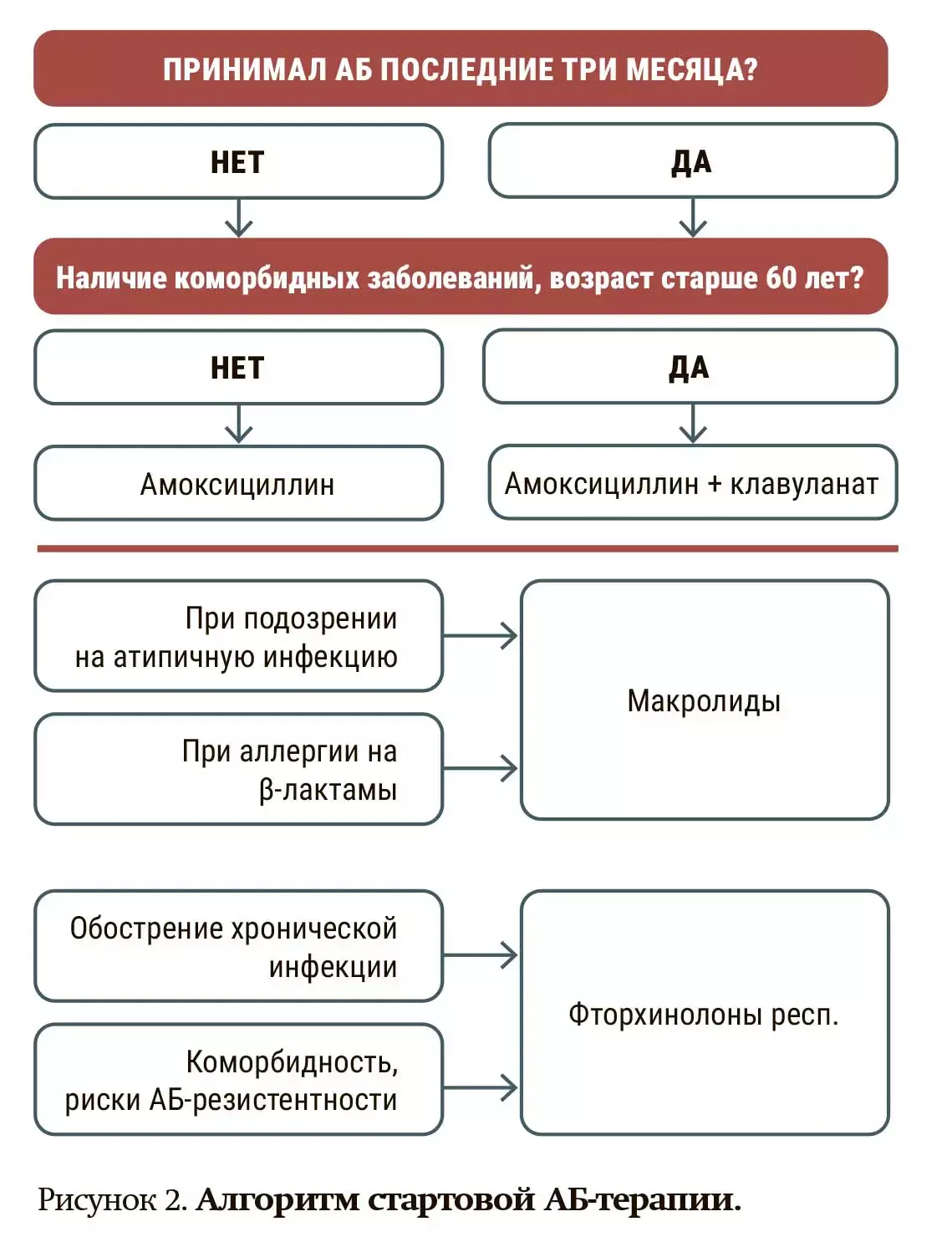
Детальные схемы лечения представлены в клинических протоколах, практических пособиях. Одно из актуальных практических пособий, которым часто пользуются врачи, это «Антимикробная терапия инфекционных заболеваний различных локализаций» (И. А. Карпов, Ю. Л. Горбич, Н. В. Соловей, Минск, 2023). Здесь хорошо прописаны эмпирические алгоритмы в зависимости от факторов риска и тяжести заболевания. В качестве примера привожу АБТ ХОБЛ (см. таблицу). Учитывая факторы риска, мы как раз и лавируем между Сциллой и Харибдой.
Таблица. АБ-терапия при обострении ХОБЛ.

Цена избыточного использования амоксициллина/клавуланата высока. Это прежде всего ненужное расширение спектра; применение при инфекциях, вызванных чувствительными микроорганизмами (например, S.pyogenes, S.pneumoniae), что не улучшает клинический исход, но расширяет антимикробное воздействие на микрофлору.
Кроме того, происходит селекционное давление и ускоренная эволюция β-лактамаз, широкое назначение А/К создает условия для отбора ингибитор-устойчивых TEM (IRT), индуцируемых AmpC-ферментов, не ингибируемых клавуланатом. Это ускоряет распространение перекрестной устойчивости к цефалоспоринам, карбапенемам и фторхинолонам. Возникает нарушение микробиома и риск осложнений — клавуланат значительно нарушает анаэробный компонент кишечной флоры, повышая рост бактерии Clostridioides difficile, риск диареи и устойчивой колонизации патогенами. Конечно, есть и экономическая и эпидемиологическая цена, так как распространение устойчивых β-лактамазных штаммов увеличивает расходы на лечение, продолжительность госпитализации и смертность при госпитальных и внебольничных инфекциях.
Итак, антибиотик выбран. Как определить его дозировку и продолжительность применения?
В этом вопросе тоже приходится лавировать между НЛР и эффективностью. Считается, что чем выше доза, тем выше эффективность антибиотика.
Но все-таки дозировка должна быть оптимальной, направленной на постоянное поддержание минимальной ингибирующей концентрации в крови. Все, что выше, это нежелательные лекарственные реакции, все, что ниже, — неэффективность и формирование резистентности.
Традиционно, скажем, амоксициллин назначается по 500 мг 3 раза в день. Но вероятность того, что пациент будет соблюдать такой прием с интервалом в 8 часов, как мы знаем, составляет не больше 60 %. Поэтому современные рекомендации в отношении ампициллинов предлагают использовать их 2 раза в день, по 1 000 мг.
Продолжительность приема тоже нужна оптимальная. Считается, что длительность антибиотикотерапии должна составлять порядка 5 дней. Но могут быть и короткие трехдневные курсы или, наоборот, длинные — до 7–10 дней.
Исследования часто демонстрируют, что трех- и семидневные курсы по эффективности примерно одинаковы, а вот частота побочных эффектов прямо коррелирует с продолжительностью приема.
Но ведь на приеме у врача общей практики пациенты часто слышат: «Раз вы уже начали принимать антибиотик, то продолжим минимум 5 дней». А вы говорите о возможности коротких курсов…
То, о чем вы сказали, тоже миф. Как только врач понял, что антибиотик не нужен пациенту, необходимо прекратить его прием, ведь каждый дополнительный день АБТ увеличивает риски НЛР, повышая вероятность антибиотикорезистентности. Это понимание пришло к нам с изучением микробиома — назначение антибиотикотерапии без показаний повышает риски бактериальных инфекций за счет того, что препарат «убивает» колонистов (большая группа микобактерий, чаще всего анаэробных и грамотрицательных), а их место занимают патогены.
Самые активные «убийцы» микробиома — цефалоспорины, фторхинолоны. Еще одна сторона медали — чем длительнее курс антибиотикотерапии, тем более вероятно появление антибиотикорезистентности. Так что сегодня отношение к антибиотикам изменилось, и крайне важно помнить о презумпции неназначения и принципе минимальной достаточности, прежде всего.
Перейдем к вопросу о путях введения антибиотика. Правда ли, что инъекции наиболее эффективны?
Биодоступность современных препаратов, в том числе таблеток, высока. Например, у амоксициллина она доходит до 93 %, более высокая доступность диспергированных форм. Показания для парентерального введения АБП ограничены: отсутствие оральной формы препарата, нарушения со стороны ЖКТ, тяжелое обострение заболевания, ИВЛ, плохой комплаенс со стороны пациента.
Ну и, наконец, что можно сказать об оценке эффективности и нежелательных реакций?
Причинами неэффективности антибиотикотерапии могут быть антибиотикорезистентность микроорганизмов; неверный выбор антибиотика; недостаточная дозировка или неправильный режим; позднее начало терапии; нарушение всасывания или инактивация; неинфекционная и/или небактериальная природа симптомов; ошибки в диагностике и тактике лечения; коморбидность и иммунодефицит пациента.
НЛР тоже немало — это реакции, связанные с прямым фармакологическим действием; аллергические; идиосинкразические и генетически обусловленные реакции; селекция резистентности. Соответственно, главные принципы профилактики — рациональное назначение антибиотиков; тщательный сбор анамнеза; выбор препарата с наилучшим профилем безопасности для конкретного пациента; коррекция дозы при почечной/печеночной недостаточности; мониторинг клинического анализа крови, биохимических показателей при длительной или потенциально токсичной терапии; информирование пациента о возможных побочных эффектах и тактике действий при их возникновении.
Разумеется, необходимо и повышение осведомленности пациентов о правильном применении антибиотиков, что рекомендует ВОЗ. Напоминайте своим пациентам об этих правилах, в том числе в виде листовок.
Нужно принимать антибиотики строго по назначению врача, никогда не требовать антибиотики, если врач уверяет, что в них нет необходимости; всегда соблюдать рекомендации врача по использованию препарата; никогда не передавать свои препараты другим лицам; избегать контакта с инфекционными больными. Важны своевременная вакцинация, защита от половых инфекций, соблюдение правил личной гигиеныи гигиены питания.
