Многие годы ученые всего мира пытаются найти оптимальный способ лечения рака, однако до сих пор это не удалось. Опухолевые клетки обладают способностью эволюционировать и приспосабливаться к меняющимся условиям внутри организма. Как следствие, классические методы лечения — химиотерапия, лучевая терапия, хирургия — приблизились к пределу своей эффективности и не позволяют ощутимо улучшить продолжительность и качество жизни пациентов.
Актуальность проблемы велика, поскольку онкологические заболевания занимают лидирующие позиции в структуре смертности населения всех стран мира, в Беларуси они находятся на 2-м месте. Стремительно развиваются альтернативные терапевтические подходы, в частности, иммунотерапия, которая подразумевает вовлечение иммунной системы пациента в борьбу с опухолью.
Онкология
Система иммунного надзора
 В нормальных условиях в организме человека работает система иммунного надзора, которая распознает изменившиеся клетки и уничтожает их. В некоторых случаях опухолевые клетки под давлением иммунитета начинают «прятаться».
В нормальных условиях в организме человека работает система иммунного надзора, которая распознает изменившиеся клетки и уничтожает их. В некоторых случаях опухолевые клетки под давлением иммунитета начинают «прятаться».
Это приводит систему в состояние равновесия, где количество убитых лимфоцитами злокачественных клеток восполняется за счет размножения тех, которые смогли избежать распознавания. На этом этапе ситуация все еще может разрешиться в сторону ликвидации опухоли. В противном случае опухолевые клетки приобретают способность подавлять иммунные реакции — и наступает стадия иммунного избегания. Цель иммунотерапии — разблокировать иммунитет и указать лимфоцитам мишень.
Особенности иммунотерапии
Условно можно выделить пассивную и активную иммунотерапию. При пассивном варианте пациенту переливают готовые иммунные компоненты, например, антитела, иммунные сыворотки, лимфоциты, активированные вне организма пациента. Активная иммунотерапия — гораздо более обширный сегмент, который направлен на формирование противоопухолевого ответа в условиях организма с полноценной иммунной системой. Доминирующим направлением здесь является противоопухолевая вакцинация.
Всем известны вакцины против вирусных и бактериальных заболеваний, таких как грипп, корь, столбняк и многие другие. В них используются либо убитые микроорганизмы, либо их компоненты, которые обучают иммунную систему. В результате этого формируются специфичные к возбудителю эффекторные В-лимфоциты, продуцирующие антитела, и Т-лимфоциты, убивающие зараженные клетки напрямую, а также клетки памяти, которые активируются при повторной встрече с возбудителем. При столкновении с конкретным болезнетворным агентом последний будет быстро распознан и уничтожен до того, как навредит организму, а заболевание либо не разовьется, либо будет протекать в легкой форме.
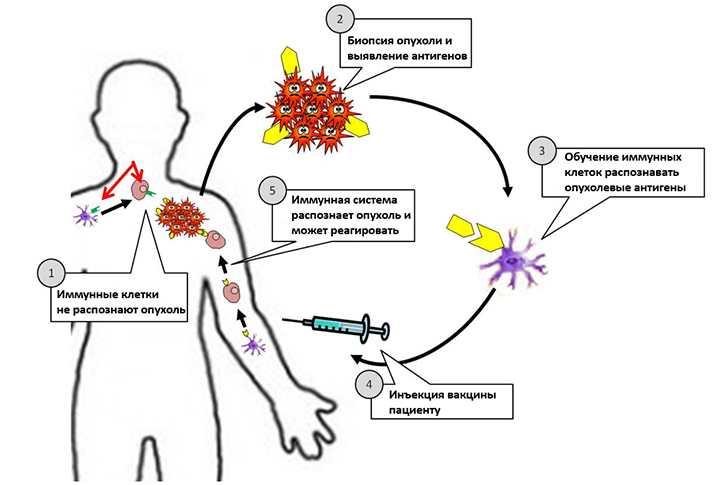
Принцип работы противоопухолевых вакцин
Противоопухолевые вакцины содержат определенные молекулы, отличающие опухолевые клетки от здоровых, и запускают всю цепочку иммунного ответа. В итоге они могут замедлить или полностью остановить опухолевую прогрессию, предотвратить рецидив заболевания или уничтожить опухолевые клетки, оставшиеся после предыдущего лечения.
В зависимости от исходного материала вакцины делятся на дендритно-клеточные, белковые, пептидные, вакцины на основе нуклеиновых кислот и вакцины из опухолевых клеток. Последний вариант является наиболее сложным и менее востребованным и подразумевает забор опухолевых клеток пациента, например во время хирургического удаления опухоли. Эти клетки инактивируют, чтобы они не могли делиться и прогрессировать, а служили мишенью для иммунитета. Кроме того, они могут быть модифицированы для синтеза провоспалительных молекул — цитокинов, которые будут привлекать и активировать клетки иммунитета.
Белковые вакцины включают искусственно синтезированные опухолевые белки, обычно конъюгированные с дополнительным иммуностимулятором. Антиидиотипические вакцины применяются исключительно для лимфом, так как в качестве мишени используют идиотип — уникальную для каждой лимфомы структуру опухолевого иммуноглобулина.
Дендритно-клеточные вакцины используют дендритные клетки пациента, главной функцией которых является передача «сигналов угрозы» от клетки-мишени лимфоцитам. В лабораторных условиях дендритные клетки культивируют совместно с опухолевым лизатом или определенным набором белков, а затем переливают обратно пациенту. Дендритные клетки расщепляют опухолевые белки на более мелкие фрагменты (процессинг) и представляют их лимфоцитам в организме пациента, оказывая дополнительную ко-стимуляцию.
Вакцины на основе нуклеиновых кислот проходят самый долгий путь преобразования в организме пациента, однако он является наиболее приближенным к реальному процессу синтеза белка в клетке. Любая белковая молекула в теле человека закодирована в ДНК, на основе которой в результате процесса транскрипции нарабатывается комплементарная матричная РНК. Далее следует процесс трансляции РНК в «незрелый» белок, который после ряда посттрансляционных модификаций приобретает свою функциональную активность. Последовательности нуклеотидов в ДНК, кодирующие любой человеческий белок, известны и находятся в специальных базах данных. Вакцины на основе нуклеиновых кислот могут быть получены как из ДНК, так и из РНК.
Три сферы применения
Противоопухолевые вакцины по сфере применения можно разделить на профилактические, терапевтические и персонализированные.
Профилактические вакцины применяются для здоровых людей с целью предотвратить развитие заболевания. Так, например, вирус папилломы человека (ВПЧ) является причиной почти 90 % случаев рака шейки матки, ассоциирован с развитием рака головы и шеи и др. FDA (Управление по санитарному надзору за качеством пищевых продуктов и медикаментов, США) одобрены несколько вакцин против ВПЧ. Кроме того, в целях снижения риска развития рака печени еще в 1981 году была одобрена вакцина от вируса гепатита В. Однако все эти вакцины являются по своей сути противовирусными. Это связано с тем, что подобрать специфичный для опухоли, но при этом характерный хотя бы для 80–90 % пациентов маркер чрезвычайно сложно.
Терапевтические виды вакцин являются более перспективными. Так, в 2010-м первой одобренной терапевтической вакциной стала Sipuleucel-T против рака простаты на основе аутологичных дендритных клеток. Еще лучше показала себя вакцина T-VEC на основе вируса герпеса против меланомы, зарегистрированная FDA в 2015 году. Сотни вакцин находятся на этапе доклинических испытаний.
Персонализированные вакцины, в свою очередь, основываются на идентификации уникальных мутаций в клетках опухоли конкретного пациента, которые и будут выступать в качестве мишени. Мутированные белки называются неоантигенами и служат опознавательным знаком для иммунных клеток.

Белорусский опыт
Специалисты РНПЦ детской онкологии, гематологии и иммунологии занимаются разработкой противоопухолевых вакцин с 2010 года. С 2010-го по 2012-й под руководством заведующей лабораторией клеточных биотехнологий и цитотерапии, кандидата биол. наук Янины Исайкиной был разработан метод вакцинотерапии для лечения химиорезистентных опухолей, включающий создание индивидуальной противоопухолевой вакцины на основе дендритных клеток пациента.
Клиническая апробация эффективности созданной противоопухолевой вакцины была проведена с участием пациентов с глиобластомой, которые получали курс (от 6 до 9 инъекций) функционально активных аутологичных дендритных клеток, нагруженных опухолевым лизатом. В Беларуси это был первый подход к применению иммунотерапии на фоне проведения химиотерапии в программе комплексного лечения пациентов с глиобластомой. Результатом такого лечения стало усиление у пациентов противоопухолевого иммунитета и как следствие — увеличение общей выживаемости в 1,5 раза по сравнению с пациентами, получившими стандартную послеоперационную терапию.
Также с 2010 года под руководством заведующего лабораторией генетических биотехнологий, кандидата биол. наук Александра Мелешко началась разработка антиидиотипических ДНК-вакцин против лимфом, предназначенных для предупреждения рецидива заболевания после достижения ремиссии в результате первой линии лечения. Совместно с РНПЦ онкологии и медрадиологии им. Н. Н. Александрова в 2014 году было начато пилотное клиническое испытание, в котором отработана форма вакцины и режим вакцинации на 5 пациентах.
С 2017 года начато клиническое испытание первой ступени, в которое включены на данный момент 17 пациентов с разными неходжкинскими лимфомами: мелкоклеточной, фолликулярной, диффузно-В-крупноклеточной и мантийноклеточной. Вакцина хорошо переносится пациентами, около 50 % развили выраженный иммунный ответ на антиген вакцины, четверо имеют стабилизацию болезни, 13 находятся в ремиссии.
Усовершенствование вакцины и набор пациентов продолжается совместно с Витебским областным клиническим онкодиспансером. Несмотря на то что испытание первой фазы не позволяет статистически доказать терапевтический эффект вакцины, его можно зафиксировать по снижению минимальной остаточной болезни, измеряемой методом ПЦР в крови и костном мозге.
Клинический случай. Пациент с хроническим лимфолейкозом получил два курса химиотерапии, после которых вышел в ремиссию с сохранением минимальной остаточной болезни в крови на уровне 0,01 % опухолевых клеток. После курса вакцинации уровень МОБ снизился до 0,001 %, и через 5 месяцев после вакцинации достиг 0, т. е. молекулярной ремиссии. Подобная динамика нехарактерна для хронического лимфолейкоза, при котором в отсутствие лечения опухолевая нагрузка плавно растет.
Отрицательное значение МОБ было выявлено у всех пациентов, прошедших вакцинацию и имеющих детектируемый иммунный ответ.
Вакцина против нейробластомы
В 2014 году в РНПЦ ДОГИ началось создание ДНК-вакцины против нейробластомы — одной из самых распространенных детских опухолей. В 2019-м окончены доклинические испытания препаратов вакцины на лабораторных животных, на основании которых был разработан пилотный протокол клинических испытаний на пациентах из группы высокого риска. Проводимые исследования ДНК-вакцины против нейробластомы внесены в международную базу клинических испытаний. Ознакомиться с критериями включения пациентов в исследование можно на сайте clinicaltrials.gov (NCT04049864). На январь 2021 года вакцинировано 5 пациентов с рецидивом нейробластомы, у 4 из них выявлен иммунный ответ на вакцину. У двух вакцинированных пациентов были удалены остаточные очаги опухоли, с выраженной инфильтрацией лимфоцитов, что подтверждает развитие иммунного ответа. Все вакцинированные пациенты находятся в ремиссии без признаков прогрессии нейробластомы.
P. S. Несмотря на ряд исследований ДНК-вакцин, на сегодня ни одна из них не зарегистрирована для клинического применения. Дальнейшие клинические испытания второй и третьей ступени покажут терапевтический эффект ДНК-вакцин в онкологии.
Однако множество клинических и научных данных показывают, что значительный прорыв иммунотерапии в онкологии будет связан с комбинированным применением разных противоопухолевых вакцин, клеточной иммунотерапии и адъювантной терапии, что направлено на преодоление иммуносупрессивного микроокружения опухоли и одновременную стимуляцию иммунитета.