Ассоциированные с инфекцией COVID-19 поражения желудочно-кишечного тракта отмечаются у 11,4–61,1 % пациентов. При этом клинические проявления вовлечения ЖКТ в патологический процесс неспецифичны (рвота, боль в животе, диарея), поэтому возникает необходимость в УЗИ органов брюшной полости, поскольку указанные симптомы могут появляться не только в дебюте заболевания, но и после того, как исчезнут респираторные признаки. Но проблема в том, что ультразвуковых диагностических критериев COVID-19-ассоциированных поражений ЖКТ нет. Отсюда следует необходимость сопоставления данных морфологических и ультразвуковых исследований.
Материалы и методы
Целью выполненного пилотного исследования явилось изучение лучевого паттерна COVID-19-ассоциированных изменений ЖКТ на основе сопоставления данных ультразвуковых и морфологических исследований. Было проведено сопоставление результатов секционных и ультразвуковых (in vitro) исследований желудка и кишечника у 11 субъектов группы сравнения (средний возраст 67,2±8,8 года), умерших от различных причин, не связанных с COVID-19, и 11 субъектов опытной группы (средний возраст 64,6±10,1 года), имевших клинические проявления COVID-19 и умерших от указанной инфекции (тип исследования — «случай-контроль»). Вскрытие и забор материала для исследований проводились не позже 3 часов с момента констатации биологической смерти.
Критерии включения в группу сравнения: отсутствие клинических проявлений COVID-19, отрицательная ПЦР, отсутствие в медицинской карте стационарного пациента сведений о наличии заболеваний ЖКТ. Критерии включения в опытную группу: наличие инфекции COVID-19, подтвержденной методом ПЦР в режиме реального времени.
Для визуальной оценки площади поражения ЖКТ желудок и кишечник вскрывались продольно по противобрыжеечному краю, промывались от содержимого. Для оценки распространенности процесса на слизистую оболочку накладывалась прозрачная пленка с нанесенной миллиметровой сеткой и проводилось фотографирование объектов c помощью цифрового фотоаппарата. Далее с помощью компьютерной программы ImageJ определялись площадь всего исследуемого объекта, площадь пораженных участков (очаги гиперемии с мелкоточечными кровоизлияниями) и процент поражения слизистой органа.
После определения площади пораженных участков образцы тканей (желудка, тонкой и толстой кишок) помещались в латексный контейнер со стерильным гелем для УЗИ, обеспечивающим надежный акустический контакт между ультразвуковым преобразователем и исследуемым объектом.
Исследование морфологического материала желудка и кишечника проводилось параллельно (для оценки вероятности потери диагностически значимой информации) на ультразвуковых цифровых диагностических системах высокого и экспертного класса с использованием линейных электронных датчиков (диапазон рабочих частот от 8–16 МГц). Сканирование стенки желудка и кишечника проводилось как со стороны слизистой, так и со стороны серозной оболочки (использовался В-режим).
Для оценки состояния стенки желудка и кишечника использовались следующие критерии: отсутствие/наличие утолщения стенки (локального/распространенного), отсутствие/наличие нарушения дифференцировки слоев (локального/распространенного), отсутствие/наличие в стенке участков лимфоидной инфильтрации (гипоэхогенных участков), отсутствие/наличие эрозий слизистой. Исследование проводилось двумя специалистами отдельно друг от друга («ослепленное исследование»).
На заключительном этапе приготовляли гистологические препараты: исследуемые кусочки тканей фиксировали в 10 % нейтральном забуференном формалине и подвергали стандартной проводке с заливкой в парафин; далее из парафиновых блоков готовили гистологические срезы толщиной 4 мкм, окрашивали гематоксилином и эозином и использовали для обзорной микроскопии.
Кроме того, выполнялось иммуногистохимическое исследование препаратов желудка, при котором изучалась экспрессия маркеров Т-лимфоцитов c использованием моноклональных антител СD3 (клон LN10), CD4 (клон 4B12), CD8 (клон 4B11); маркера В-лимфоцитов CD20 (клон L26), маркера NK-лимфоцитов CD57 (клон NK-1), маркера макрофагов CD68 (клон 514H12), маркера лаброцитов CD117 (клон EP10). Оценка экспрессии ИГХ-маркеров проводилась в 6 случайных полях зрения (объектив 40), исходя из 1 000 обследованных клеток.
Статистический анализ проводился с применением пакета прикладных программ Statistica 10.0. В случае распределения количественных показателей, отличного от нормального, данные представлялись в виде медианы 25-го и 75-го перцентилей: Me [25; 75], при нормальном распределении признака — в виде среднего арифметического и стандартного отклонения среднего арифметического (M±SD). Для оценки статистической значимости различий сравниваемых показателей использовался t-критерий Стьюдента и U-тест Манна — Уитни.
Результаты
У исследованных субъектов в 5 случаях (45,5 %) был выявлен хронический антральный гастрит, в 6 случаях (54,5 %) — пангастрит. Выраженность изменений была умеренной в 4 случаях (36,4 %), значительной — в 7 случаях (63,6 %).
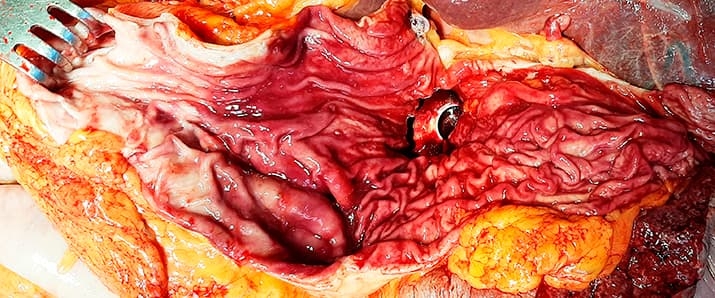
При значительно выраженных изменениях выявлялись очаги микроэрозий в антральном отделе (у 4 субъектов) и по малой кривизне в нижней трети желудка (у 3 субъектов). Во всех случаях имело место нарушение микроциркуляции по типу формирования эритроцитарных сладжей и микротромбов (см. рис. 1).
Рисунок 1. Макропрепарат желудка при COVID-19-ассоциированном поражении ЖКТ: выраженное полнокровие слизистой оболочки с мелкоточечными (местами) кровоизлияниями.
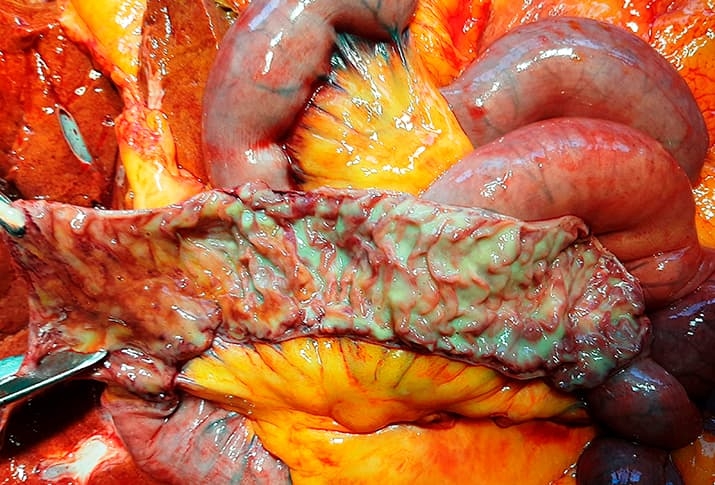
Умеренная степень активности процесса была выявлена у 5 субъектов (45,5 %), выраженная — у 6 субъектов (54,5 %). У 2 субъектов обнаружен Helicobacter pylori. У 4 субъектов (36,4 %) была выявлена полная кишечная метаплазия. Аналогичные, хотя и менее выраженные изменения были отмечены в тонкой и толстой кишках (см. рис. 2).
Рисунок 2. Макропрепарат тонкой кишки при COVID-19-ассоциированном поражении ЖКТ: очаговое полнокровие слизистой оболочки и мелкоточечные кровоизлияния.
У всех обследованных субъектов опытной группы в толще слизистой оболочки выявлялись участки пониженной эхогенности с нечеткими и неровными контурами. Встречаемость указанных изменений, а также площадь поражения различных отделов ЖКТ у субъектов, умерших от инфекции COVID-19, представлены в табл. 1, 2.
Таблица 1. Встречаемость поражений различных отделов ЖКТ при COVID-19.
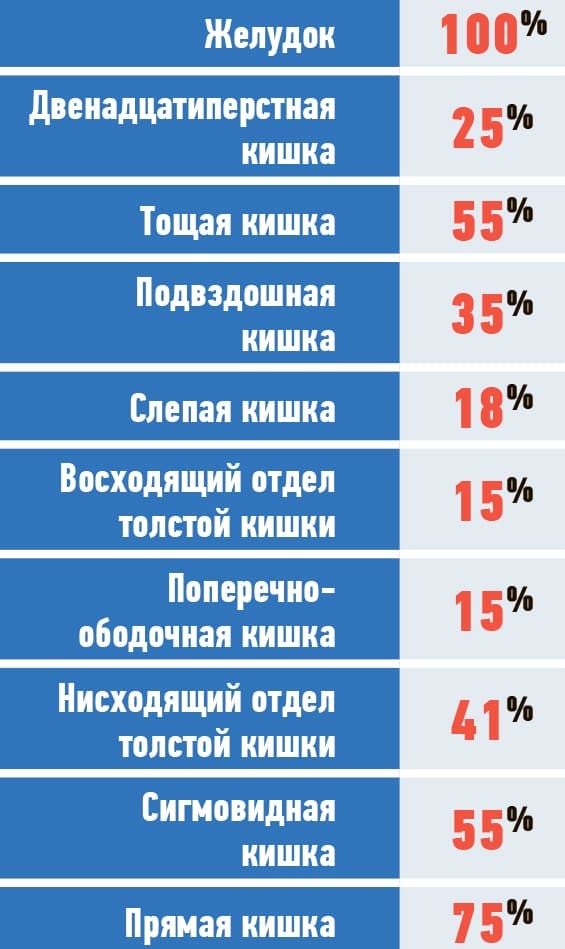
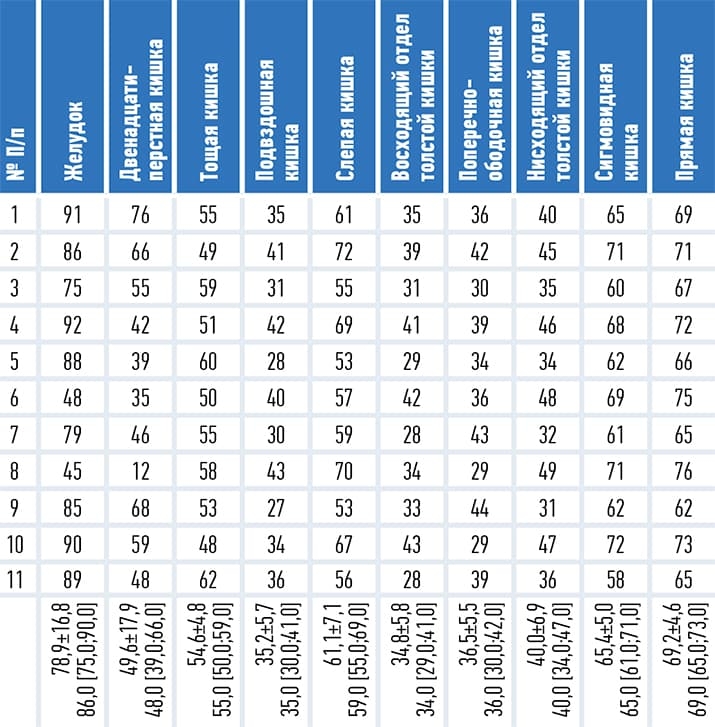
Таблица 2. Площадь поражения различных отделов ЖКТ при COVID-19.
В отличие от опытной группы в группе сравнения ни в одном случае вышеописанные участки пониженной эхогенности в стенке желудка и кишечника не выявлялись. При гистологическом исследовании материала, взятого из участков пониженной эхогенности, выяснилось, что их патоморфологическим субстратом являются зоны лимфоидной инфильтрации (см. рис. 3, 4).
Рисунок 3. COVID-19-ассоциированные изменения ЖКТ (желудок): А1 — неизмененная стенка (слои четко разграничены); А2 — ультразвуковой паттерн участка лимфоидной инфильтрации; Б — гистологический паттерн (микрофотография) слизистой с очаговой и диффузной лимфоидной инфильтрацией, с формированием лимфоидных скоплений (В-лимфоциты — СD20). Контрокраска гематоксилином Майера. Увеличение: объектив 40.
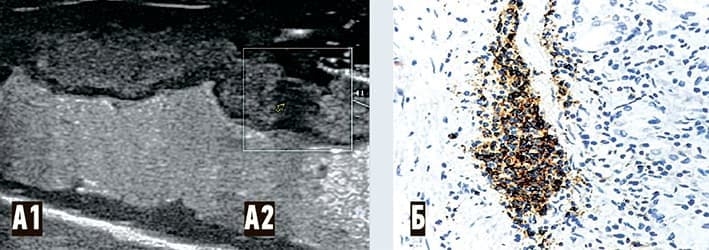
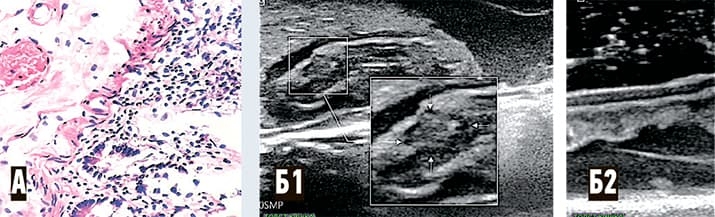
Рисунок 4. COVID-19-ассоциированные изменения ЖКТ (толстая кишка): А — гистологический паттерн (микрофотография) слизистой с полнокровием сосудов и умеренной лимфоплазмоцитарной инфильтрацией слизистой оболочки. Окраска: гематоксилин и эозин. Увеличение: объектив 60; Б1 — ультразвуковой паттерн зоны лимфоплазмоцитарной инфильтрации; Б2 — ультразвуковой паттерн неизмененной стенки кишки (стенка не утолщена, все слои четко дифференцируются).
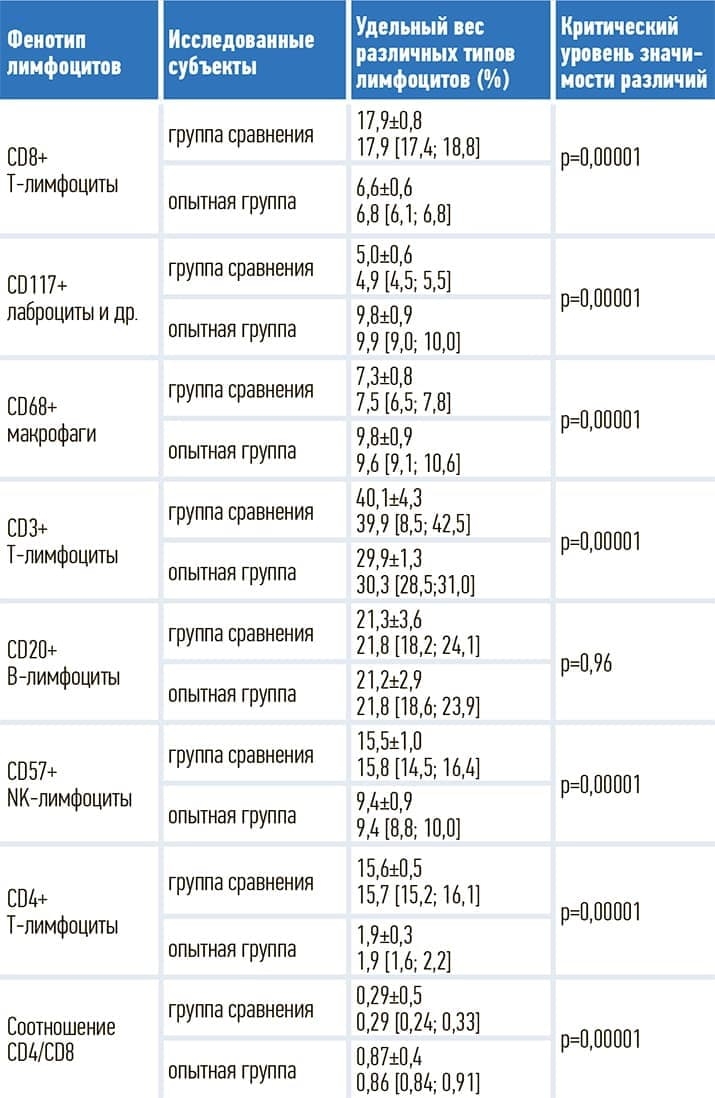
С целью получения более четкого представления о характере патоморфологических изменений в участках пониженной эхогенности, выявленных в стенке желудка и кишечника у субъектов с COVID-19, была проведена оценка экспрессии маркеров Т-лимфоцитов (СD3, CD4, CD8), В-лимфоцитов (CD20), NK-лимфоцитов (CD57), макрофагов (CD68) и лаброцитов (CD117). Полученные данные представлены в табл. 3.
Таблица 3. Экспрессия маркеров Т-лимфоцитов, В-лимфоцитов, NK-лимфоцитов, макрофагов и лаброцитов в группе сравнения и опытной группе.
Судя по данным таблицы 1, при боли в животе у пациентов с COVID-19 вероятность выявления изменений, о которых речь шла выше, будет наиболее высокой в желудке и ректосигмоидном отделе толстой кишки. Последнее объяснимо, поскольку вирус SARS-CoV-2 способен непосредственно действовать на эпителиоциты ЖКТ, имеющие рецепторы АПФ2. Впрочем, нельзя исключить и косвенное нейротропное влияние на механизмы нейрорегуляции кишечника.
Примечательно, что у всех обследованных из опытной группы (в отличие от группы сравнения) в толще слизистой оболочки выявлялись участки пониженной эхогенности с нечеткими и неровными контурами (участки лимфоидной инфильтрации). Причем у субъектов с COVID-19-ассоциированным поражением желудка в участках лимфоидной инфильтрации статистически значимо реже определялась гиперэкспрессия общего маркера Т-лимфоцитов CD3 (р=0,00001), маркера субпопуляции регуляторных Т-лимфоцитов CD4 (р=0,00001), маркера субпопуляции цитотоксических Т-лимфоцитов CD8 (р=0,00001), маркера NK-лимфоцитов CD57 (р=0,00001), маркера макрофагов CD68 (р=0,00001), маркера тучных клеток CD117 (р=0,00001).
При этом не было выявлено значимых различий в показателях, отражающих экспрессию маркера В-лимфоцитов CD20 между группой сравнения и опытной группой (р=0,96). Есть основания полагать, что снижение (в сравнении с данными группы сравнения) экспрессии СD8, СD3, СD57, СD4 и повышение экспрессии СD117, СD68 является признаком функционального истощения Т-лимфоцитов и естественных киллеров (с неизбежным в таком случае подавлением эффективности как врожденного, так и адаптивного иммунитета) с параллельным повышением активности лаброцитов, макрофагов и смещением цитокинового баланса в сторону провоспалительного ответа, локальным проявлением которого, судя по всему, и являются вышеописанные гипоэхогенные участки в пределах слизистой оболочки и подслизистого слоя.
В опытной группе было отмечено (сопоставляя с группой сравнения) статистически значимое снижение показателя CD4/СD8, который является биомаркером иммунной активации. Ранее такой феномен отмечали у пациентов с ВИЧ-инфекцией и даже находили статистически значимую взаимосвязь между снижением показателя CD4/CD8 и повышением риска неблагоприятного исхода.
Последнее наталкивает на мысль, что у пациентов с COVID-19 показатель CD4/CD8 тоже может оказаться полезным для прогнозирования исхода заболевания. Однако этот вопрос требует отдельного обсуждения.
Что касается изменений в сосудах микроциркуляторного русла слизистой оболочки желудка у субъектов опытной группы, то они (у 10 из 11) представляли собой множественные эритроцитарные сладжи, микротромбы, изменения эндотелиальных клеток венул (набухание ядер, хроматолиз, наличие увеличенных ядер неправильной формы). На ультразвуковых сканах этим изменениям соответствовали мелкие участки неоднородного снижения эхогенности и прерывистость контуров слизистой (в местах эрозий) (см. рис. 5).
Рисунок 5. Слизистая желудка. А1 — гистологический паттерн (микрофотография, опытная группа): эндотелий, выстилающий венулу слизистой оболочки желудка с полиморфными ядрами (указано стрелкой), в просвете сосуда эритроцитарные сладжи и пристеночные микротромбы (окраска гематоксилином и эозином, увеличение ґ60); А2 — гистологический паттерн (микрофотография): эндотелий, выстилающий венулу слизистой оболочки желудка с вытянутыми ядрами обычного строения (указано стрелкой), в просвете сосуда скопления эритроцитов. Окраска гематоксилином и эозином, увеличение ґ60. Б — ультразвуковой паттерн: зона неоднородного понижения эхогенности с прерыванием (эрозия) контура слизистой (указано стрелкой).
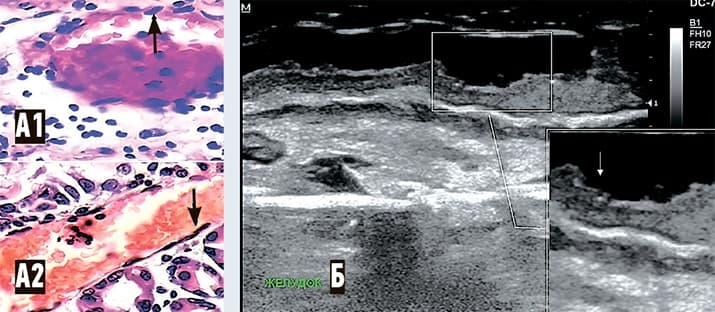
В группе сравнения (n=11) картина, подобная приведенной, была выявлена у 2 субъектов c пангастритом.
Подводя итог, следует отметить, что ограничением данного исследования является небольшое количество наблюдений и отсутствие полной уверенности в том, что у субъектов опытной группы не было «фоновых» заболеваний ЖКТ, которые не нашли своего отражения в картах амбулаторного и стационарного пациента. Тем не менее полученные в ходе исследования данные позволяют сделать предварительные выводы.
Выводы
При УЗИ изменения, ассоциированные c COVID-19, будут выявляться во всех отделах ЖКТ, однако наиболее выраженные и доступные для УЗ-сканирования изменения будут, скорее всего, выявляться в сигмовидной (65 %) и прямой кишках (69 %), поскольку они наиболее доступны для УЗИ. Ультразвуковым признаком поражения желудка и кишечника при COVID-19 являются гипоэхогенные участки (локально расположенные или распространенные) в толще слизистой оболочки (эпителиальной, собственной и мышечной пластинок) и подслизистой основы.
Патоморфологическим субстратом указанных гипоэхогенных участков является лимфоидный инфильтрат, состоящий из скоплений Т-лимфоцитов (СD3, CD4, CD8), В-лимфоцитов (CD20), NK-лимфоцитов (CD57), макрофагов (CD68) и лаброцитов (CD117).
Основными отличиями иммуногистохимического паттерна гипоэхогенных участков в толще слизистой оболочки и подслизистой основы являются снижение экспрессии СD8, СD3, СD57, СD4 и повышение экспрессии СD117, СD68 при сопоставлении с показателями группы сравнения, что свидетельствует о функциональном истощении Т-лимфоцитов и естественных киллеров и подавлении эффективности как врожденного, так и адаптивного иммунитета с одновременным повышением активности лаброцитов, макрофагов.
