Первое описание больного, погибшего от инфекционного эндокардита (ИЭ), было сделано в 1646 году Лазаром Ривьере. До появления антибиотиков большинство умирало от неконтролируемой инфекции и только 12 % — от сердечной недостаточности.
От пенициллина до хирургии
Термин «эндокардит» был введен в 1834 году французским терапевтом Жаном-Батистом Буйо. Клапанные вегетации впервые описал патолог Рудольф Вирхов в 1846-м, а в 1872-м норвежский патологоанатом Винга Джалмар Хейберг доказал микробную этиологию эндокардита. Симптоматику, клиническое течение и морфологические особенности этого заболевания описал американский терапевт Уильям Ослер в 1885 году.
Применение сульфаниламидов в 1937 году привело к ощутимым результатам и излечению 15 % больных. Революцию в лечении бактериальных инфекций, в том числе ИЭ, произвело открытие пенициллина, полученного из мицелия грибов. Благодаря усилиям нобелевских лауреатов Александра Флеминга, Говарда Флори и Эрнста Чейна началась эра эффективной терапии ИЭ. В 1945 году Доусон и Хантер пришли к выводу, что ИЭ, вызванный зеленящим стрептококком, может быть с успехом вылечен пенициллином.
Авторы использовали данный препарат в дозировке от 80 000 до 500 000 Ед в сутки внутривенно или внутримышечно каждые 3 часа от 10 до 62 дней совместно с гепарином. Через 3 месяца после завершения лечения у 14 (70 %) из 20 пациентов отсутствовали признаки инфекции. Стало понятно, что ИЭ может быть излечимым заболеванием. Однако отмечались и случаи неконтролируемой инфекции, не отвечающей на лечение антибактериальными препаратами.
Впервые парентеральное введение пенициллина у больного с ИЭ применил в 1940 году Генри Доусон. Он излечил инфекционный процесс на клапанах сердца подкожными инъекциями в течение 2 дней. А в 1944-м удалось применить внутривенное введение пенициллина, добившись 100 % выздоровления всех отобранных для исследования пациентов с ИЭ.
Сегодня около 80 % пациентов могут быть успешно излечены с помощью антибиотикотерапии. Однако у оставшихся 20 % лекарственная терапия не приводит к успеху, так как основной причиной смерти становится развитие сердечной недостаточности вследствие наличия пороков клапанов сердца. Поэтому следующей вехой истории ИЭ явилось применение хирургического метода, который берет свое начало с 1962 года, когда удалось «очистить» от вегетаций трехстворчатый клапан.
В 1963-м Эндрю Дж. Уоллос произвел первое успешное протезирование аортального клапана в неактивную фазу заболевания, а в 1965-м — митральное протезирование у больного с активным инфекционным процессом. Хирургическое лечение в дальнейшем получило широкое распространение во всем мире.
Патогенез
Наличие в организме инородного тела, а именно искусственного клапана, является фактором риска развития ПЭ. Инфекционный процесс при эндокардите может поражать как механические, так и биологические протезированные клапаны независимо от времени, которое прошло с момента выполнения операции.
Для развития протезного инфекционного эндокардита необходимо наличие источника инфекции в организме — это могут быть непролеченные кариозные зубы, заболевания лор-органов, хроническая патология урогенитального тракта, снижение иммунитета и изменение внутрисердечного кровотока после имплантации клапанного протеза.
При ИЭ формируются микробные вегетации, которые представляют собой образования, состоящие из микроорганизмов, элементов крови и нитей фибрина. Размеры их могут колебаться от миллиметров до нескольких сантиметров. Вегетации больших размеров часто создают препятствия для нормального внутрисердечного кровотока. Кроме того, от них могут отрываться небольшие частички и с током крови разноситься к жизненно важным органам (головной мозг, сердце, сосуды) с развитием инсульта, инфаркта миокарда, острой ишемии конечностей.
Также при ИЭ могут быть длительная лихорадка с ознобами, слабость, недомогание, потливость, иногда снижение массы тела и появление или усугубление проявлений сердечной недостаточности, развиваются осложнения или проявления нарушений функций других органов (поражения печени, почек, кровотечения и т. д.).
Выбор метода диагностики
Диагностика ИЭ представляет собой значительную проблему из-за разнородной клинической картины, множества вариантов возбудителей и особенностей ведения кардиохирургических пациентов. Таким образом, диагностика и ведение пациентов с ИЭ требуют командного подхода кардиологов, инфекционистов, специалистов по УЗД, лучевой диагностике, кардиохирургов и микробиологов.
Уровень заболеваемости и смертности от инфекционного эндокардита не уменьшился за последние 30 лет.
ИЭ остается трудно диагностируемым заболеванием и связан с плохим прогнозом. Еще более сложную проблему для диагностики представляет собой инфекция протезированного клапана сердца. Применение традиционных модифицированных критериев Дюка у этих пациентов ограничено в связи со стертой клинической картиной и недостаточным количеством доказательств присутствия воспалительного процесса из-за своеобразного течения инфекции протезированных клапанов сердца.
Наличие у пациентов эхокардиографических критериев протезного эндокардита (ПЭ) — отрыв протеза, фистулы, абсцессы — является признаком далеко зашедшего процесса, а диагностика требует установления диагноза на более ранних сроках для дифференцированного подхода и определения дальнейшей тактики лечения. Следовательно, разработка новых методов диагностики ПЭ является клинически важной задачей.
Своевременная и качественная диагностика воспалительных поражений сердца сегодня невозможна без использования лучевых методов исследования, которые обладают высокой информативностью, позволяя оценить морфофункциональные изменения в органах и тканях. В частности, одним из перспективных способов неинвазивной диагностики воспалительных заболеваний сердца, получающим все большее распространение, является МРТ сердца. К сожалению, при выполнении исследования на сроках, превышающих 2 недели от начала заболевания, чувствительность его значительно снижается.
К числу других лучевых методов, используемых для диагностики сердечно-сосудистых заболеваний, относятся УЗ-сканирование и рентгеновская КТ. К сожалению, обладая высокой разрешающей способностью, они тем не менее не позволяют выявить воспалительные изменения в сердце, а признаки эндокардита определяются только на стадии выраженных анатомических изменений в тканях.
Одним из путей решения данной проблемы может служить использование ядерной медицины, которая дает возможность оценить патофизиологические процессы, происходящие в пораженном органе, и выявлять воспалительный процесс на ранних стадиях заболевания.
Достигается это за счет использования радиофармпрепаратов, способных накапливаться в очаге флогогенного поражения.
За последние годы молекулярная визуализация в виде позитронно-эмиссионной томографии (ПЭТ) в сочетании с КТ успешно начала применяться в диагностике ПЭ. В первую очередь данный диагностический метод используется в онкологии, но также нашел свое применение и в кардиохирургии, в возможности выявить очаги воспаления и инфекции в различных органах и тканях.
Применение ФДГ ПЭТ/КТ сердца в случае диагностики ПЭ используется в Беларуси у пациентов с подозрением на инфекцию протезированного клапана сердца. В настоящее время отмечается важное значение данного метода в диагностике и оценке осложнений, таких как эмболия и метастатическая инфекция, а также в мониторинге эффективности лечения ПЭ. Кроме того, более новые системы КТ сочетают высокую чувствительность ФДГ ПЭТ/КТ с 18F-фтордезоксиглюкозой (18F-ФДГ) к обнаружению источника инфекции с высоким пространственным разрешением, чтобы определить структурное повреждение органов и тканей.
ПЭТ/КТ с 18F-ФДГ является методом обнаружения инфекции, поскольку в лейкоцитах экспрессируется высокая плотность транспортеров глюкозы, а их высокая метаболическая активность позволяет выявить инфекцию после протезирования клапанов сердца. Использование данного диагностического метода позволяет дифференцировать пациентов для отбора тактики лечения. Часть пациентов с грубыми нарушениями, в частности, отрывом протеза, фистулами, ухудшением клинико-лабораторных данных, требует агрессивного подхода в виде повторного хирургического лечения (замена на механический или биологический протез, аллографт).
Однако в настоящее время наметилась тенденция к кардинально новому подходу лечения ПЭ. Стабилизация состояния, наличие уже дренированного абсцесса в области протеза без его гемодинамически значимых нарушений, нормализация маркеров воспаления позволили определить пациентов с данной патологией в группу консервативного лечения.
Длительность антибактериальной терапии определяется с учетом множества факторов и тщательного отбора таких пациентов с последующим их контролем с использованием ПЭТ/КТ в определенные сроки лечения.
При незначительном гемодинамическом нарушении (фистулы небольшого диаметра) и полном излечении от инфекции возможно их эндоваскулярное закрытие. Поэтому возрастающая роль ПЭТ/КТ имеет большое значение в диагностике и мониторинге ПЭ после кардиохирургических операций.
Случай из практики
Пациент Н., 72 года, поступил в РНПЦ «Кардиология» с жалобами на выраженную одышку при ходьбе на расстояние более 20 метров, отеки, повышение температуры тела до 38 °С, ощущение жара в правой стопе, кашель с отхождением светлой мокроты, потливость.
В 2002 году он перенес ИЭ с формированием порока сердца. В ноябре 2020-го выполнено биопротезирование аортального клапана, экзопротезирование восходящей аорты.
Состояние больного: средней тяжести, поведение адекватное, температура 36,3 °С. Телосложение гиперстеническое, кожные покровы сухие, бледные. Опорно-двигательная система: пастозность голеней и стоп. Периферические лимфоузлы не пальпируются.
Сердце и крупные сосуды: тоны ритмичные, приглушенные, ЧСС 100 уд./мин, АД 134/60 мм рт. ст., границы сердца увеличены влево.
Легкие: одышка при разговоре, при снятии одежды; дыхание везикулярное, ослабленное в нижних отделах, в боковых отделах, ЧД 18–20 в мин.
ЖКТ и мочевыделительная система: живот несколько увеличен в размере, безболезненный при пальпации; симптом поколачивания отрицательный; дефекация затруднена; мочеиспускание без особенностей.
ЭхоКГ: состояние после биопротезирования и экзопротезирования восходящей аорты. Аорта расширена в восходящем отделе 41 мм. В аортальной позиции биопротез. Створки биопротеза разрушены. Девиация кольца (?) протеза.
Со стороны правого и некоронарного синусов Вальсальвы регистрируется парапротезная регургитация 3-й ст. размером по потоку около 5–6 мм, со сбросом в выводной тракт левого желудочка (ВТЛЖ) — парапротезная фистула (?). Признаки отрыва кольца протеза. SAK(D) = 1,5 см2. Регургитация с аортального клапана 4-й ст., ширина AR к ширине LVOT = 100 % — тяжелая аортальная регургитация. Дисфункция биопротеза в виде недостаточности.
Коронароангиография: коронарные артерии без значимого стенозирования.
Компьютерная ангиография: выраженные дегенеративные изменения протеза аортального клапана. Створки протеза не определяются. Кольцо аортального клапана не замкнуто — дефект 6 мм по задней стенке. Кольцо смещено к центру корня аорты. Определяется парапротезная фистула у основания левого коронарного синуса размером 9×6 мм (сообщение с ВТЛЖ).
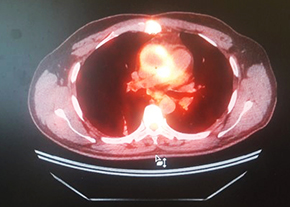
ПЭТ с 18F-ФДГ: ПЭТ/КТ-картина в пользу протезного эндокардита аортального клапана.
Выполнено: пациенту проведено оперативное вмешательство — рестернотомия, репротезирование аортального клапана в условиях искусственного кровообращения. Интраоперационно: на 2/3 окружности кольца аортального клапана определяется отрыв протеза, взят бакпосев. Протез аортального клапана отделился при небольшом потягивании без приложения усилий, створки изменены, частично разрушены с вегетациями, взят на гистологическое исследование, фиброзное кольцо аортального клапана сохранено.
По данным патогистологического исследования, в послеоперационном периоде определяется ПЭ биологического протеза аортального клапана бактериальной природы с деструкцией и фибриново-тромботическими изменениями.
Вывод. Случай демонстрирует возможность и эффективность использования ПЭТ/КТ для ранней диагностики инфекции протезированного клапана сердца.