По показателям лечения острого лимфобластного лейкоза у детей Беларусь вышла на 8-е место в мире, опередив такие страны, как США, Израиль, Япония, Финляндия и др. (по данным The Lancet 2017 года). На сегодняшний день более 90 % пациентов детского возраста с данным видом лейкоза удается излечить. Однако существуют злокачественные заболевания гемопоэтической ткани, которые протекают более агрессивно и сложнее поддаются терапии. К таким заболеваниям относится острый миелоидный лейкоз у детей.
Уровень заболеваемости
 Острый миелоидный лейкоз (ОМЛ) представляет собой гетерогенную группу злокачественных заболеваний гемопоэтической ткани, при которой происходит клональная экспансия аномальных предшественников миелопоэза в костном мозге, крови, печени, селезенке, реже в некроветворных органах.
Острый миелоидный лейкоз (ОМЛ) представляет собой гетерогенную группу злокачественных заболеваний гемопоэтической ткани, при которой происходит клональная экспансия аномальных предшественников миелопоэза в костном мозге, крови, печени, селезенке, реже в некроветворных органах.
ОМЛ — относительно редко встречающееся злокачественное заболевание. Уровень заболеваемости ОМЛ увеличивается с возрастом, средний возраст выявления составляет 63 года. На долю ОМЛ приходится до 90 % всех острых лейкозов у взрослых, тогда как в детском возрасте этот показатель составляет около 20 %.
По данным республиканского канцер-регистра, заболеваемость ОМЛ у детей в Беларуси составляет 0,6–0,8 на 100 тысяч детского населения. Ежегодно в нашей стране насчитывается около 10–12 случаев впервые выявленного ОМЛ среди детей в возрасте от 0 до 18 лет. Чаще всего ОМЛ выявляется в первые 2 года жизни и в подростковом возрасте.
ОМЛ отличается чрезвычайно тяжелым и агрессивным течением. Эффективность лечения детей с ОМЛ значительно ниже, чем детей с острым лимфобластным лейкозом.
Этиология и патогенез
ОМЛ является следствием повреждения (мутации) в генетическом материале кроветворной клетки-предшественницы, что приводит к потере способности к нормальной дифференцировке и избыточной пролиферации патологических клеток. Мутантный клон достаточно быстро вытесняет нормальные кроветворные клетки, замещая собой весь гемопоэз. Лейкемические клетки покидают костный мозг и инфильтрируют различные органы и ткани (селезенку, печень, лимфоузлы, ЦНС, кожу и др.). Тот факт, что патогенез ОМЛ связан с генетическими поломками, подтверждается обнаружением различных хромосомных аберраций (транслокаций, делеций, инверсий и т. д.) в лейкемических клетках.
В большинстве случаев конкретная причина возникновения ОМЛ остается неизвестной. Однако существует несколько предрасполагающих факторов, которые значительно увеличивают риск развития этого заболевания. К ним относятся ионизирующая радиация, химические мутагены, предшествующая химио- и лучевая терапия по поводу злокачественного новообразования.
Ряд врожденных и наследственных синдромов могут повышать вероятность развития ОМЛ. Прежде всего это наследственные болезни, сопровождающиеся нестабильностью генотипа, — со спонтанными разрывами хромосом, нерасхождением соматических или половых хромосом (болезни Дауна, Фанкони и др.), и болезни, связанные с дефектами иммунитета (болезни Луи-Бар, Брутона и др.). Так, например, при синдроме Дауна вероятность развития ОМЛ повышается в 10–18 раз.
Клиническая картина
В основном клинические проявления связаны с замещением нормальной гемопоэтической ткани лейкемическими клетками (анемия, тромбоцитопения, нейтропения) и инфильтрацией ими различных органов. Чаще всего болезнь проявляется c анемического и геморрагического синдромов, возможны интоксикация и лихорадка, связанные со вторичными инфекциями. Геморрагический синдром может быть различной степени тяжести, — от петехиальных высыпаний до тяжелых кровотечений (см. рис. 1).
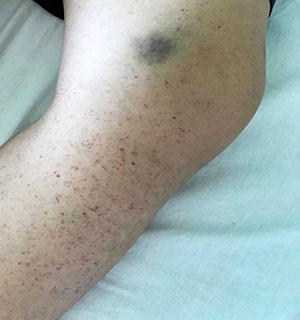
Увеличение печени, селезенки и лимфатических узлов регистрируется у 30–50 % пациентов. Для детей первого года жизни характерно быстрое развитие органомегалии и лимфаденопатии. Возможны симптомы, обусловленные экстрамедуллярным поражением различной локализации, — боли в костях и суставах, инфильтрация кожи и слизистых. У 5–10 % детей могут быть проявления со стороны ЦНС в виде нарушения функции черепно-мозговых нервов или общемозговой симптоматики.
Диагностика
В анализе крови может быть как лейкопения, нормальное количество лейкоцитов, так и лейкоцитоз, вплоть до экстремально высоких цифр (200–300×109/л). Бластные клетки могут не определяться в анализе или, наоборот, составлять 90–95 % всех лейкоцитов. Тромбоцитопения встречается часто, но ее отсутствие не исключает диагноза ОМЛ.
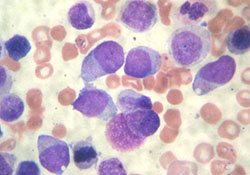 Для диагностики ОМЛ необходимо проведение костномозговой пункции. Субстратом опухоли являются миелобласты (см. рис. 2).
Для диагностики ОМЛ необходимо проведение костномозговой пункции. Субстратом опухоли являются миелобласты (см. рис. 2).
Диагноз ОМЛ ставится на основании обнаружения в пунктате костного мозга не менее 20 % бластных клеток.
Обязательным является проведение цитохимического исследования, иммунофенотипирования, молекулярно-генетического и цитогенетического исследований бластных клеток.
Для установления вовлечения ЦНС проводится люмбальная пункция.
Согласно современной классификации опухолей гемопоэтической и лимфоидной ткани, предложенной ВОЗ, в диагностический алгоритм при ОМЛ обязательно включено определение генетических аберраций.
Выделяют категории ОМЛ:
→ ОМЛ с повторяющимися генетическими аномалиями;
→ ОМЛ с изменениями, связанными с миелодисплазией;
→ миелоидные новообразования, связанные с терапией;
→ ОМЛ неуточненные;
→ миелоидная саркома;
→ миелоидные пролиферации, связанные с синдромом Дауна.
Прогноз и лечение
Одним из важнейших факторов прогноза при ОМЛ являются молекулярно-генетические изменения в лейкемических клетках. На основании обнаружения различных генетических аберраций возможно стратифицировать пациентов на группы риска: благоприятного, промежуточного и неблагоприятного прогноза. Подразделение пациентов с ОМЛ на эти группы целесообразно с точки зрения установления вероятности развития рецидива и выбора тактики терапии.
Лечение ОМЛ у детей основано на интенсивной полихимиотерапии, которая должна быть дополнена трансплантацией гемопоэтических стволовых клеток (ГСК) от полностью совместимого родственного (брат/сестра) или альтернативного (неродственного, гаплоидентичного) донора у пациентов с неблагоприятным прогнозом.
Вторым важным фактором прогноза при ОМЛ является ответ на терапию, который в настоящее время оценивается не только морфологически, но и с применением более высокочувствительных молекулярно-генетических и иммунологических методов, позволяющих обнаружить 1 лейкемическую клетку среди 104–106 исследуемых.
Опыт РНПЦ ДОГИ в лечении ОМЛ
В Беларуси в лечение пациентов детского возраста с ОМЛ интенсивная полихимиотерапия по протоколу AML-BFM-87 была внедрена в 1990 году. Восьмилетняя бессобытийная и общая выживаемость пациентов, получивших лечение по данному протоколу, составила 24 % и 25 % соответственно.
Введение в 1992 году программы терапии «ОМЛ-Минск-92» позволило улучшить результаты лечения и достичь семилетней бессобытийной и общей выживаемости 36 % и 48 % соответственно. Дальнейшие успехи в лечении ОМЛ у детей в нашей стране связаны с внедрением нового протокола «ОМЛ-ММ-2000», разработанного кооперативной группой Москва/Минск, предусматривающего дифференцированную терапию пациентам различных прогностических групп в зависимости от молекулярно-генетических изменений в бластных клетках (пятилетняя бессобытийная выживаемость 42 %). Анализ результатов лечения по протоколу «ОМЛ-ММ-2000» позволил провести более детальную стратификацию пациентов на группы риска и разработать последующие протоколы лечения «ОМЛ-ММ-2006» (2006–2014 гг.) и «ОМЛ-ММ-2014» (с 2014 г.).
Улучшение результатов лечения в последние десятилетия связано с достижениями в области молекулярной генетики и детализацией алгоритмов стратификации пациентов детского возраста с ОМЛ по группам риска, оптимизацией режимов полихимиотерапии, применением таргетной терапии, усовершенствованием сопроводительного лечения, расширением показаний для трансплантации ГСК, а также внедрением клеточной иммунотерапии.
При проведении протокола «ОМЛ-ММ-2014» вероятность общей выживаемости пациентов составляет 56 % (период наблюдения 7 лет). В благоприятной прогностической группе этот показатель достигает 72 %, в промежуточной — 50 %, а в неблагоприятной — 45 %. Общая выживаемость пациентов детского возраста после проведения трансплантации ГСК составляет 90 %. Основными причинами неудач в лечении ОМЛ являются рецидив заболевания (развивается у 12,3 % пациентов) и смерть в ремиссии от инфекционно-токсических осложнений (14,8 %).
С 2014 года в РНПЦ ДОГИ в лечение ОМЛ включена иммунотерапия натуральными киллерными клетками. Это клетки врожденного иммунитета, которые оказывают цитотоксическое действие на трансформированные, злокачественные клетки. Донором натуральных киллерных клеток обычно выступает мать или отец ребенка. В лабораторных условиях полученные от донора натуральные киллеры культивируют вместе со специальной линией фидерных клеток, что обеспечивает их активацию и многократный прирост. Затем полученный клеточный продукт вводят пациенту. Данный метод показал себя как безопасный и эффективный в отношении ОМЛ.
В настоящее время продолжается разработка методов лечения, с помощью которых возможно дальнейшее снижение количества рецидивов и одновременное уменьшение токсичности терапии ОМЛ.
Клинические случаи
Пациентка Щ., 15 лет. Считает себя больной в течение двух недель, когда появились признаки острого респираторного заболевания (повышение температуры до 38 °С, боль в горле, кашель). Обратилась к педиатру, получала лечение амбулаторно. Отмечалась положительная динамика состояния, но девочка обратила внимание на увеличение подчелюстных лимфоузлов. Направлена на консультацию к хирургу, который назначил ОАК и антибактериальную терапию. В ОАК обнаружены лейкоцитоз и бласты. Направлена в РНПЦ ДОГИ.
При поступлении в центр (26.03.2020) состояние тяжелое, компенсированное. Температура тела 37,5 °С. Кожные покровы бледные, геморрагическая сыпь на нижних конечностях. Видимые слизистые чистые. Пальпируются заднешейные лимфоузлы размером 1,5–2 см, подчелюстные — 1,5–2 см, плотные, безболезненные. Тоны сердца ясные, ритмичные. ЧСС 100 уд/мин. Дыхание везикулярное, хрипов нет. ЧД 16 в минуту. Живот мягкий, безболезненный. Печень не пальпируется, селезенка +2,0 см из-под края реберной дуги.
ОАК: Hb 96 г/л, эритроциты 2,73×109/л, тромбоциты 34×109/л, лейкоциты 105×109/л, бласты 84 %, базофилы 1 %, эозинофилы 2 %, палочкоядерные нейтрофилы 3 %, сегментоядерные нейтрофилы 5 %, лимфоциты 4 %, моноциты 1 %.
БАК: ЛДГ 908 МЕ/л (норма 130–250 МЕ/л), остальные показатели не изменены.
Миелограмма: пунктат костного мозга очень богат клеточными элементами, бласты составляют 78 % от общего количества. Мегакариоциты снижены, не функционируют. Бластные клетки средних размеров, с вариабельной цитоплазмой, умеренно базофильного цвета, в некоторых присутствуют немногочисленные азурофильные гранулы. Ядра с нежной структурой хроматина, содержащие 1–2 ядрышка.
Цитохимические реакции: миелопероксидаза — реакция слабоположительная в 10 % бластных клеток, липиды — реакция положительная в 26 % бластов,
PAS-реакция на гликоген положительная в 10 % бластных клеток в гранулярной и диффузной форме. Исходя из морфологических особенностей бластных клеток и цитохимических реакций, бласты можно отнести к ОМЛ М1 по FAB-классификации.
Иммунофенотипирование костного мозга: выделена популяция атипичных клеток с фенотипом миелобластов ранней стадии дифференцировки.
Молекулярно-генетическое исследование костного мозга: обнаружена мутация FLT3-ITD (англ. fms-like tyrosine kinase 3 (FLT3)).
Цитогенетическое исследование костного мозга: 46, XX [20].
Исследование спинномозговой жидкости: белок 0,22 г/л, цитоз 1×106/л, моноциты — 2 в препарате.
УЗИ ОБП: увеличение селезенки (+2,5–3 см); диффузные изменения печени; гиперплазия лимфоузлов у ворот печени, в проекции поджелудочной железы, подвздошных лимфоузлов.
КТ ОГК: без видимых патологических изменений.
Выставлен диагноз: острый миелоидный лейкоз, М1 по FAB-классификации, ранней стадии дифференцировки, ЦНС I. Период разгара.
Учитывая гиперлейкоцитоз, пациентка была госпитализирована в ОРИТ для проведения циторедуктивной профазы (вепезид, даунорубицин).
После получения результатов молекулярно-генетического анализа (мутация FLT3-ITD) установлена неблагоприятная группа прогноза по развитию рецидива. Пациентке показано проведение трансплантации ГСК.
Для достижения ремиссии проведено два блока полихимиотерапии. Ремиссия констатирована 14.04.2020. Далее пациентке проведен блок консолидирующей полихимиотерапии. В межкурсовой период с учетом наличия мутации в гене FLT3 пациентка получала таргетный препарат сорафениб (мультикиназный ингибитор).
Учитывая отсутствие братьев и сестер, был выполнен поиск неродственного донора. 15.09.2020 пациентке выполнена аллогенная неродственная HLA-совместимая трансплантация ГСК. Донором явилась женщина-волонтер (Центральный реестр доноров гемопоэтических стволовых клеток Беларуси), 45 лет.
В настоящее время пациентка находится в ремиссии, наблюдается у гематолога.
Пациент Ш., 8 лет. За месяц до обращения появились признаки острого респираторного заболевания. Получал лечение амбулаторно. Через две недели возобновились фебрильные подъемы температуры, появилась слабость. Выполнен ОАК, обнаружены изменения, направлен в РНПЦ ДОГИ.
При поступлении в центр (23.11.2016) состояние тяжелое, компенсированное. На момент осмотра с правой половины носа скудное кровянистое отделяемое. Температура тела 36,6 °С. Кожные покровы бледные, геморрагическая сыпь на коже груди и нижних конечностей. Периферические лимфоузлы не увеличены. Тоны сердца ясные, ритмичные. ЧСС 102 уд/мин. Дыхание везикулярное, хрипов нет. ЧД 19 в минуту. Живот мягкий, безболезненный. Печень +1,0 см из-под края реберной дуги, селезенка не увеличена.
ОАК: Hb 114 г/л, эритроциты 4,36×109/л, тромбоциты 20×109/л, лейкоциты 25×109/л, бласты 50 %, эозинофилы 14 %, юные нейтрофилы 1 %, палочкоядерные нейтрофилы 1 %, сегментоядерные нейтрофилы 3 %, лимфоциты 28 %, моноциты 3 %.
БАК: ЛДГ 1149 МЕ/л (норма 130–250 МЕ/л), остальные показатели не изменены.
Миелограмма: пунктат костного мозга гиперклеточный, бласты составляют 55 % от общего клеточного состава. Мегакариоциты не найдены. Тромбоцитов мало. Эритрокариоциты составляют 26 % от общего клеточного состава. Нельзя не отметить присутствие в пунктате эозинофилов, которые составляют 9 %. Морфология бластов: клетки среднего размера с узким ободком голубой цитоплазмы; ядра бластов округлые или овальные, содержащие 1 или несколько нуклеол; в цитоплазме некоторых бластов содержатся немногочисленные азурофильные гранулы; встречаются бластные клетки с палочками Ауэра.
Цитохимия: миелопероксидаза 100%, липиды 100 %, гликоген гранулярный 70 %. По морфологическим и цитохимическим признакам картина ОМЛ М2 по FAB-классификации.
Иммунофенотипирование костного мозга: ОМЛ промежуточных стадий дифференцировки.
Молекулярно-генетическое исследование костного мозга: химерные онкогены не обнаружены.
Цитогенетическое исследование костного мозга: 46, XУ,?del(13)(p11) [5]/46, XУ[25].
Исследование спинномозговой жидкости: белок 0,36 г/л, цитоз 2×106/л, лимфоциты — 1 в препарате, моноциты — 2 в препарате.
УЗИ ОБП: диффузные изменения печени, почек; селезенка +1,0–1,5 см.
КТ ОГК: картина невыраженных интерстициальных изменений легких.
Выставлен диагноз: острый миелоидный лейкоз, М2 по FAB-классификации, ЦНС I. Период разгара.
Пациент получил полихимиотерапию согласно промежуточной группе прогноза. Для достижения ремиссии проведены 2 курса индукционной полихимиотерапии. Ремиссия констатирована 28.12.2016. Далее в качестве консолидации ремиссии пациенту проведено два курса высокодозной полихимиотерапии и курс лимфодеплетирующей химиотерапии с последующей трансфузией донорских натуральных киллерных клеток (донором стала мать). Специальное лечение завершено в мае 2017 года.
Пациент до настоящего времени находится в ремиссии.