Ассистент 1-й кафедры хирургических болезней ГрГМУ Аннета Обухович была одним из докладчиков на научно-практической конференции с международным участием «Актуальные проблемы сосудистой хирургии» в Минске на базе 4-й ГКБ имени Н. Е. Савченко. Ее работу, посвященную особенностям патогенеза атеросклероза у пациентов с сахарным диабетом 2-го типа, мы предлагаем вниманию читателей.
Актуальность
 Аннета ОбуховичСахарный диабет (СД) — актуальная проблема современного здравоохранения, согласно данным ВОЗ, он находится на 3-м месте в мире по частоте инвалидности и смертности после сердечно-сосудистых и онкологических заболеваний. Одновременно с этим остается нерешенной проблема облитерирующего атеросклероза (ОА), неуклонное прогрессирование которого приводит не только к развитию гангрены и ампутации нижней конечности, но также увеличивает риск развития инфаркта головного мозга и смерти от коронарной патологии. Крайне негативно складывается ситуация при сочетании СД и ОА. Наличие атеросклероза нижних конечностей у пациентов с СД увеличивает риск высокой ампутации конечности в 10 раз.
Аннета ОбуховичСахарный диабет (СД) — актуальная проблема современного здравоохранения, согласно данным ВОЗ, он находится на 3-м месте в мире по частоте инвалидности и смертности после сердечно-сосудистых и онкологических заболеваний. Одновременно с этим остается нерешенной проблема облитерирующего атеросклероза (ОА), неуклонное прогрессирование которого приводит не только к развитию гангрены и ампутации нижней конечности, но также увеличивает риск развития инфаркта головного мозга и смерти от коронарной патологии. Крайне негативно складывается ситуация при сочетании СД и ОА. Наличие атеросклероза нижних конечностей у пациентов с СД увеличивает риск высокой ампутации конечности в 10 раз.
От заболеваний, обусловленных атеросклерозом, умирает больше пациентов с СД 2-го типа, чем от всех других причин, вместе взятых.
ОА не является непосредственно осложнением диабета, однако СД приводит к раннему развитию, увеличивает тяжесть, ухудшает течение, видоизменяет клинические проявления этого заболевания.
Основные Теории
В литературе приводится множество сведений о вероятных патогенетических механизмах развития этих заболеваний. Ряд авторов считают, что ОА начинает развиваться в детском возрасте с яркой клинической манифестацией у взрослых. Описаны первые признаки атеросклероза в возрастной группе пациентов до 10 лет, к 13–15 годам у них были обнаружены атеросклеротические бляшки.
Изучение патогенеза атеросклероза берет начало в середине 18-го века, когда Альбрехт фон Галлер — швейцарский анатом, физиолог, естествоиспытатель — описал атеросклеротическое поражение и ввел термин «атерома». На сегодняшний день существует более 20 теорий возникновения атеросклеротической бляшки. Самая распространенная и подробно описанная — липидно-инфильтративная, или холестериновая теория, появившаяся в начале 20-го века. Наличие гиперхолестеринемии у половины пациентов с ОА, а также обнаружение холестерина в атеросклеротических бляшках во время вскрытий обосновывает вероятность холестериновой теории развития. Однако, опираясь на эту теорию, невозможно объяснить происхождение атеросклеротических бляшек у пациентов с нормальным уровнем липидов крови.
Наряду с липидно-инфильтративной широкое распространение получила теория реакции на повреждение. Здоровый эндотелий обладает антитромбогенными и антиадгезивными свойствами. Основные регуляторы функций эндотелия — простагландины, эндотелин и оксид азота. Атеросклеротический процесс развивается в ситуации, когда наблюдается первичное повреждение эндотелия, называемое эндотелиальной дисфункцией.
Кроме описанных выше предложены еще несколько теорий происхождения облитерирующего атеросклероза: воспалительная, мутагенная моноклональная, тромбогенная и тромболипидная, генетическая, эпигенетическая, перекисная, мембранная, инфекционная, аутоиммунная и многие другие. Такое количество теорий только подтверждает тот факт, что, несмотря на многочисленные исследования, точные причины развития заболевания до сих пор не установлены.
В последние годы растет заинтересованность в изучении взаимосвязи атеросклероза и костного метаболизма.
Диабетическая ангиопатия
Диабетическую ангиопатию связывают с гипергликемией — таким же фактором риска, как курение, артериальная гипертензия и гиперхолестеринемия. Считают, что повышенный уровень глюкозы в крови вызывает окислительный стресс, вследствие чего растет количество свободных радикалов и развивается дисфункция эндотелия. Гипергликемия снижает продукцию оксида азота эндотелиальными и гладкомышечными клетками сосудов, блокируя работу NO-синтазы и активируя генерацию активных форм кислорода. Вместе с тем следует иметь в виду, что глюкоза оказывает токсическое действие не только при гипергликемии, но и при гипогликемии, так как в ответ на это состояние симпатическая нервная система выделяет повышенное содержание катехоламинов, активизирующих тромбоциты и лейкоциты.
Инсулин крови воздействует на липогенные ферменты, стимулирует пролиферацию клеток и увеличивает продукцию эндогенного холестерина и триглицеридов, то есть влияет на все компоненты атеросклеротической бляшки — липидное ядро, коллаген, пенистые и гладкомышечные клетки.
Немаловажную роль играют также нарушения гемостаза у пациентов с СД 2-го типа. Для них характерна повышенная склонность эритроцитов и тромбоцитов к агрегации, отмечаются нарушения структуры и функции эритроцитов. Эти клетки деформируются, становятся менее гибкими, в результате чего снижается скорость кровотока и повреждается интима сосуда.
В контексте эндотелиальной дисфункции (ЭД) стоит сказать про эндотелин-1 (ЭТ-1), открытый в 1988 году. Это мощнейший вазоконстриктор и митоген. Продуцируется не только эндотелиальными клетками, но также эпителиальными клетками легких и кератиноцитами. Несмотря на многолетние исследования, его роль в развитии ЭД продолжает изучаться. Отмечена связь эндотелина-1 с тяжестью коронарного атеросклероза. Исследователь из России, кандидат мед. наук Александр Паршаков (Пермь) с соавторами выявили снижение лабораторных маркеров ЭД, в том числе и эндотелина-1, после выполнения реваскуляризирующей операции на артериях нижней конечности, отмечая при этом, что у пациентов с СД некоторые показатели ЭД (например, фактор Виллебранда) увеличиваются в первую неделю после вмешательства.
Говоря про костный метаболизм, стоит отметить остеопротегерин (ОПГ). Это гликопротеин, представитель суперсемейства рецепторов aльфа-фактора некроза опухоли. Это растворимый рецептор для RANKL (лиганда активатора рецептора ядерного фактора каппа-бета), синтезируемый остеобластами, клетками стромы, эндотелиоцитами и В-лимфоцитами. Действует как рецептор-ловушка для RANKL, блокируя его взаимодействие с собственным рецептором (RANK). В физиологическом состоянии его содержание в плазме достаточно низкое. Существует мнение, что концентрация увеличивается с возрастом. Есть исследования, подтверждающие связь ОПГ с атеросклерозом и сахарным диабетом. Однако данные эти достаточно противоречивы. В экспериментальных же исследованиях ОПГ выступает в качестве протектора развития кальциноза сосудов.
Результаты исследования
На базе отделения гнойной хирургии Гродненской университетской клиники обследованы 202 пациента с ОА. Пациенты были разделены на 2 группы. Группа 1 — 77 пациентов с ОА без нарушения углеводного обмена. Группа 2 — 125 пациентов с ОА и СД 2-го типа. Группу контроля составили 42 относительно здоровых добровольца. Все пациенты были сопоставимы по полу, возрасту, стадии ишемии.
Справочно: исследование выполнено в рамках гранта БРФФИ «Наука М-23» № М23М-098 от 02.05.2023 (№ гос. регистрации 20231274) по теме: «Роль остеопротегерина, эндотелина-1 и полиморфизма их генов в развитии хронической критической ишемии нижних конечностей при облитерирующем атеросклерозе, сочетающемся с сахарным диабетом, и исходах артериальных реконструкций».
У пациентов с сопутствующим СД чаще встречались инфаркт миокарда в анамнезе, оперативные вмешательства на коронарных артериях и заболевания почек, а у пациентов без нарушения углеводного обмена — нарушения ритма и проводимости.
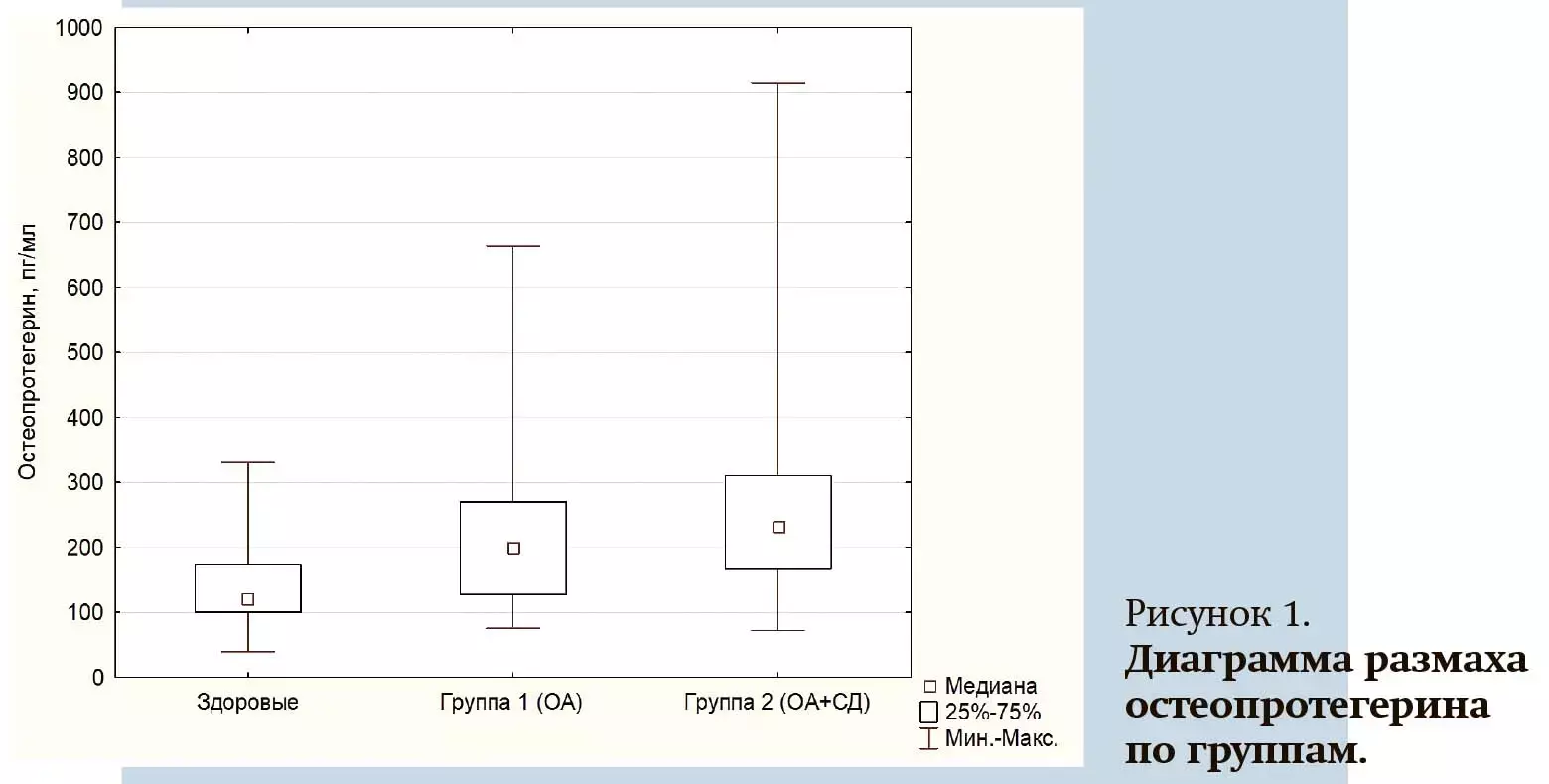
Получены следующие результаты: у здоровых пациентов уровень ОПГ оказался достоверно ниже, чем в группе пациентов с ОА; в группе пациентов с ОА и сопутствующим СД 2-го типа уровень ОПГ был выше, чем в группе 1 (группа 1 — 218,54±109,59 пг/мл, группа 2 — 324,81±99,35 пг/мл, группа контроля — 137,52±62,41 пг/мл).
Достоверные различия были получены при сравнении всех групп пациентов (см. рис. 1).
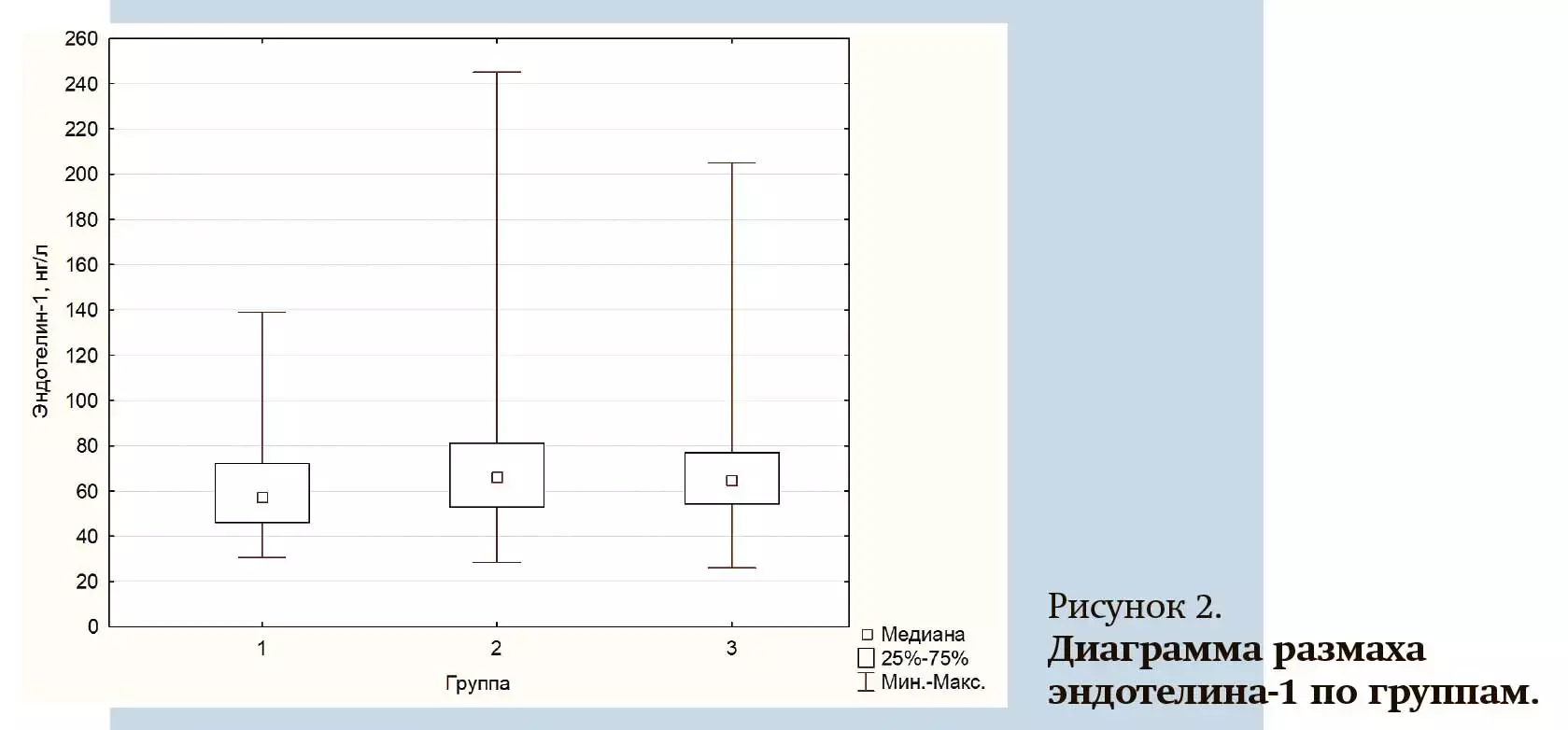
Уровень ЭТ-1 в группе контроля оказался достоверно ниже по сравнению с пациентами с ОА (группа 1 — 78,65±30,48 нг/л, группа 2 — 80,87±23,42 нг/л, группа контроля — 61,06±19,19 нг/л) (см. рис. 2).
78 пациентам из группы 2 выполнена реваскуляризирующая операция. Через 14 дней и 3 месяца после операции производился осмотр с повторным забором крови. Срок наблюдения за пациентами составил 24 месяца. Суммарно выполнено 48 рентгенэндоваскулярных вмешательств (58,97 %) и 30 открытых реконструктивных операций (41,03 %). За время наблюдения пациентам потребовалось 13 повторных оперативных вмешательств. 18 пациентам выполнена высокая ампутация (23,08 %): 6 на уровне голени и 12 на уровне бедра. Медиана срока ампутации составила 2 месяца (0,75; 5).
В зависимости от результата оперативного вмешательства пациенты были разделены на две группы: группа 2А — пациенты с благоприятным исходом (сохраненной нижней конечностью) и группа 2Б — пациенты с прогрессированием ОА, в случае которых потребовалось выполнение высокой ампутации в послеоперационном периоде. Обе группы были сравнимы по полу, возрасту, характеру выполненной операции, гликированному гемоглобину и стадии ишемии (р >0,05).
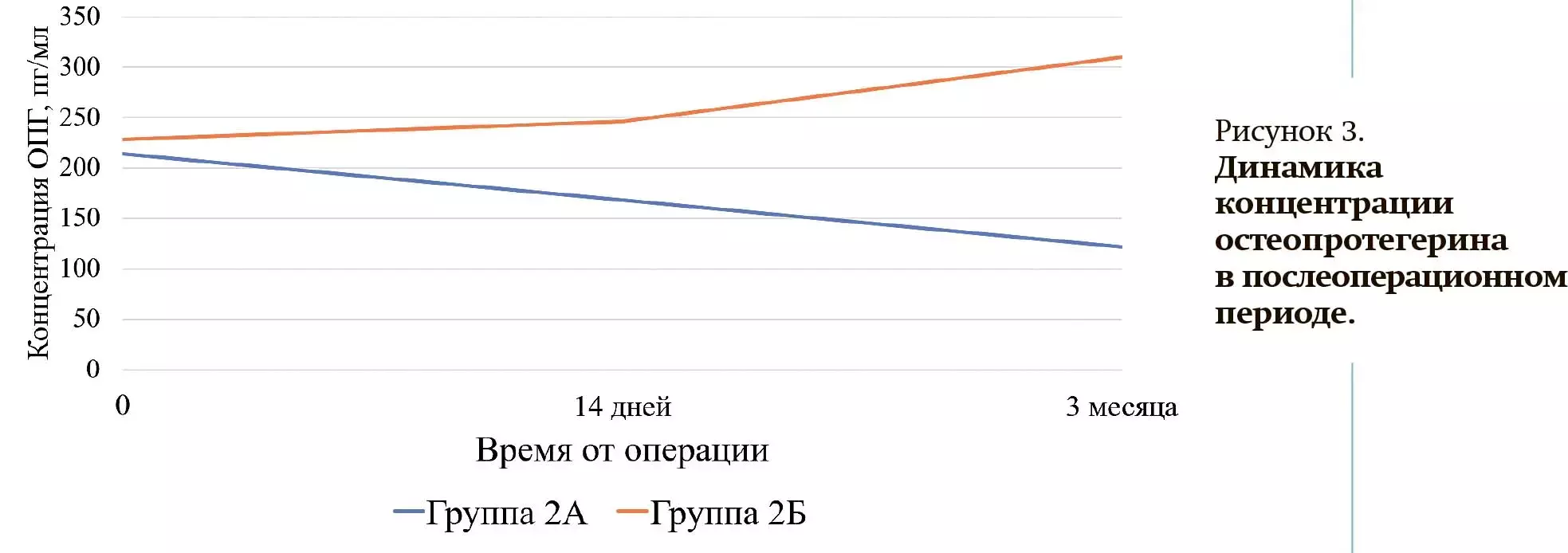
В обеих группах отмечено, что исходные показатели были сравнимы между собой. Однако у пациентов группы 2А концентрация ОПГ постепенно снижалась через 14 дней и 3 месяца, в то время как у пациентов группы 2Б показатель этот увеличивался в вышеуказанные сроки (см. рис. 3).
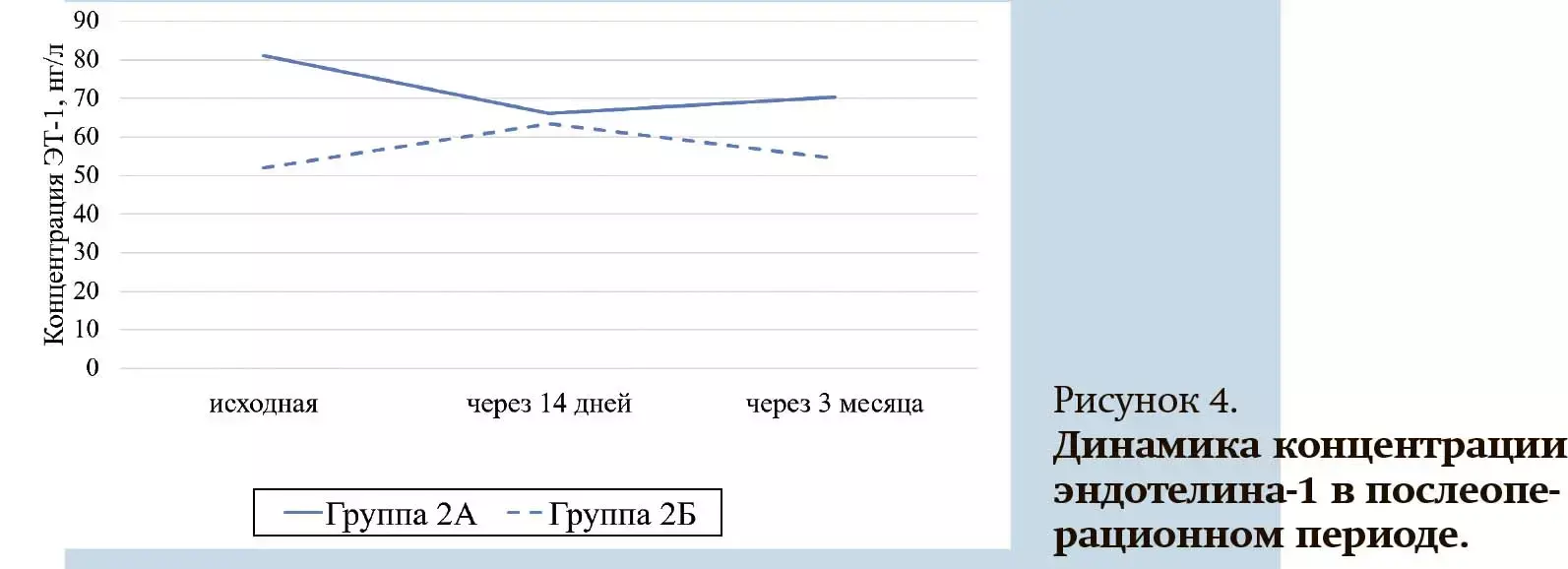
При сравнении показателя ЭТ-1 в обеих группах отмечено, что исходные показатели были выше в группе 2А. Однако в послеоперационном периоде концентрация ЭТ-1 снизилась, и разница к концу 3-го месяца составила 17 % от исходной. У пациентов же группы 2, наоборот, содержание ЭТ-1 в плазме после операции постепенно увеличивалось и к концу 3-го месяца стало выше на 17,5 % от исходного (см. рис. 4).
Выводы
1. У пациентов с облитерирующим атеросклерозом нижних конечностей уровень остеопротегерина достоверно превышает его значения у здоровых лиц.
2. При наличии сопутствующего СД 2-го типа у пациентов с облитерирующим атеросклерозом уровень остеопротегерина оказывается достоверно выше его величин как у здоровых лиц, так и пациентов с ОА без нарушения углеводного обмена.
3. Остеопротегерин может быть одним из новых маркеров диагностики как облитерирующего атеросклероза, так и СД 2-го типа.
4. У пациентов с облитерирующим атеросклерозом нижних конечностей, в том числе при наличии сопутствующего СД 2-го типа, уровень эндотелина-1 достоверно превышает его значения у здоровых лиц.
5. Динамика остеопротегерина и эндотелина-1 в послеоперационном периоде может быть использована в предупреждении неблагоприятного исхода реваскуляризации у пациентов с ОА при наличии сопутствующего СД 2-го типа.
