Лучевая терапия (радиотерапия) продолжает оставаться одним из трех наиболее эффективных средств в лечении рака (наряду с хирургическим и лекарственным), в котором нуждаются около 70 % онкологических пациентов. Более подробную информацию об этом виде терапии для «Медвестника» подготовила Анна Скерсь, ассистент кафедры онкологии ГрГМУ, врач — радиационный онколог.
Альтернатива хирургии
 Анна СкерсьЛучевая терапия (ЛТ) представляет собой вариант доставки к опухоли ионизирующего излучения, которое генерирует специальное устройство. В современных реалиях этот вид лечения выглядит как хорошая альтернатива хирургии, поскольку может быть использован даже в качестве самостоятельного метода (к примеру, для лечения опухолей кожи, предстательной и молочной желез, легкого, органов женской репродуктивной сферы), но с определенными оговорками.
Анна СкерсьЛучевая терапия (ЛТ) представляет собой вариант доставки к опухоли ионизирующего излучения, которое генерирует специальное устройство. В современных реалиях этот вид лечения выглядит как хорошая альтернатива хирургии, поскольку может быть использован даже в качестве самостоятельного метода (к примеру, для лечения опухолей кожи, предстательной и молочной желез, легкого, органов женской репродуктивной сферы), но с определенными оговорками.
ЛТ стала неотъемлемой частью лечения низко расположенных опухолей прямой кишки, гигантских опухолей анального канала на том этапе, когда предложить хирургическое вмешательство не представляется возможным из-за распространенности процесса либо когда операция неминуемо закончится выведением части кишки на переднюю брюшную стенку (формированием стомы), на что может быть не согласен пациент.
При достаточном уровне радио-чувствительности опухоли после проведения курса ЛТ на ранней стадии (1–2-я) возможно полное излечение от злокачественного новообразования, при местно-распространенных процессах — регрессия опухоли либо ее стабилизация или увеличение периода времени до прогрессирования.
Использовать ЛТ можно на предоперационном этапе, а также интра- и послеоперационно, преследуя различные лечебные цели. К достоинствам терапии следует отнести хорошие косметические результаты при лечении опухолей, находящихся в местах, сложных для сохранения эстетики при проведении хирургического лечения (крыло носа, угол глаза, губа).
Еще одна функция ЛТ — проведение паллиативного и симптоматического лечения, которое не излечит пациента, однако улучшит качество жизни либо замедлит рост опухоли (к примеру, облучение метастазов в костях скелета, наличие которых сопряжено с развитием хронической боли, трудно купируемой медикаментозно).
Виды лучевой терапии
По расположению источника ионизирующего излучения от поверхности тела пациента выделяют дистанционную лучевую терапию (ДЛТ) и контактную. При этом для каждого варианта лечения существуют еще более детальные подходы, связанные как с физическими свойствами применяемого аппарата, так и с целями радиотерапии.
Чаще всего для глубоко залегающих опухолей используется дистанционное облучение, которое проводится на гамма-терапевтической установке либо на линейном ускорителе (современное устройство для проведения высокотехнологичной конформной, или 3D-лучевой, терапии). Лечение на таком аппарате — сложный процесс, который реализуется благодаря совместной кропотливой работе команды в составе радиационных онкологов, медицинских физиков, операторов ускорителя, врачей-рентгенологов и рентгенолаборантов.
Ускорители оснащены мультилепестковыми коллиматорами, представляющими собой систему подвижных пластин, положение которых регулируется с помощью команд медицинских физиков при планировании облучения в специально разработанном программном обеспечении.
Коллиматор дает возможность создать фигурное поле облучения, максимально приближенное к форме опухоли, и исключить из объема облучения здоровые ткани либо снизить дозу попадающей на них радиации.
Реализация облучения
Для реализации 3D-облучения (можем называть такое облучение объемным) крайне важно расположить пациента на лечебном столе с точностью до миллиметра, чтобы он не смещался во время облучения, ведь поля, созданные физиками при планировании, строго индивидуальны. Достичь нужного расположения можно благодаря специальным фиксирующим и позиционирующим устройствам в виде масок, матрасов, опорных пластин и др. Кроме того, чтобы повысить точность ЛТ, для контроля положения пациента используется «приставка» к линейному ускорителю — компьютерный томограф в конусном пучке. Она позволяет определить, насколько точно положили больного, и при необходимости внести корректировки.
Использование многолепестковых коллиматоров, планирующих систем и фиксирующих устройств дает возможность разделить высокую дозу на опухоль и низкую лучевую нагрузку на окружающие нормальные ткани. Возможно обеспечить еще более тонкие настройки, например, синхронизировать облучение с дыханием. Это важно при облучении метастазов в печени или в легких, которые движутся вместе с органами, меняя свое положение со вдохом/выдохом. Современные технологии позволяют воздействовать на эти очаги только в определенной фазе дыхания.
Следует понимать, что применение высокотехнологичных методик облучения неминуемо ведет к существенному увеличению времени сеанса и подготовки пациентов к нему.
В представленных схемах кратко описан путь пациента, который будет проходить лечение на линейном ускорителе (см. рис. 1, 2).


Таким образом, за счет увеличения числа полей, введения рентгеновского контроля за положением пациентов на лечебных столах ускорителей, обязательной дозиметрической проверки настройки ускорителя на каждый вид облучения, фиксации пациентов на лечебном столе можно осознать важность тщательного выполнения каждого шага на пути к разработке максимально подходящего плана облучения для каждого пациента.
Преимущества и риски
Пациенты переносят ЛТ легче, чем химиотерапию. Однако и при ее проведении возможно развитие осложнений и побочных эффектов (мукозиты, эзофагиты, дерматиты, циститы, проктиты, вагиниты и др.). Разумеется, чем лучше спланирована терапия, тем меньше риск развития нежелательных реакций со стороны окружающих опухоль здоровых органов.
Однако зачастую возникновение осложнений может быть связано с индивидуальной непереносимостью ионизирующего излучения либо наличием сопутствующей патологии, которая проявляется в виде обострения имеющихся хронических заболеваний.
Проведение лучевой терапии не представляется возможным при декомпенсированных состояниях системы кровообращения, эндокринной системы, неудовлетворительных биохимических показателях работы печени и почек, имеющейся инфекционной патологии в острый период. Абсолютное противопоказание к проведению ЛТ — беременность.
Решение о начале радиотерапии после перенесенного инфаркта миокарда, тромбоэмболии либо нарушения мозгового кровообращения в каждом случае должно определяться индивидуально с учетом анамнеза пациента, однако после окончания сроков реабилитации. Кровотечение из опухоли следует расценивать как относительное противопоказание к радиотерапии. По собственному клиническому опыту могу отметить, что нередко после начала лучевой терапии кровотечение из гигантских опухолей кожи останавливается.
Клинический случай
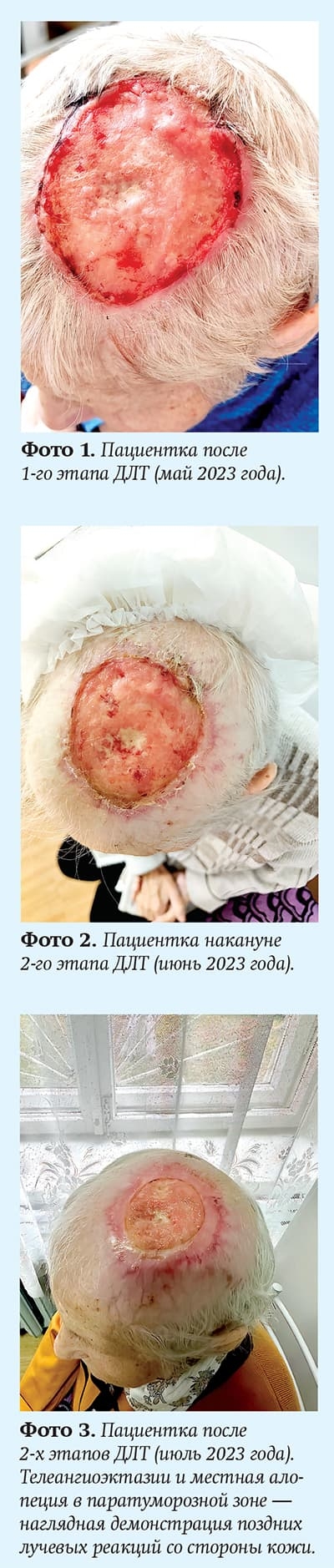 Диагноз. Пациентка Н., 1943 г. р., в мае 2023 года поступила на консультацию к радиационному онкологу по направлению онколога-хирурга с верифицированной цитологическим методом базалиомой правой теменной области размерами 12х12 см.
Диагноз. Пациентка Н., 1943 г. р., в мае 2023 года поступила на консультацию к радиационному онкологу по направлению онколога-хирурга с верифицированной цитологическим методом базалиомой правой теменной области размерами 12х12 см.
За медицинской помощью не обращалась более 5 лет, пока не стали беспокоить эпизоды профузных кровотечений из опухоли головы и резкие падения артериального давления. Хирургическое лечение не показано. Запланировано проведение паллиативного расщепленного курса дистанционной лучевой терапии на гамма-терапевтическом аппарате (1-й курс — 10 фракций в разовой очаговой дозе 3 Грея; через 3 недели 2-й курс — 20 фракций в разовой очаговой дозе 2 Грея).
Лечение. Гемоглобин в общем анализе крови на момент начала лечения — 70 г/л. При первой перевязке — края раны рыхлые, обильно кровоточат при снятии повязок, определяются множественные сформировавшиеся сгустки, расположенные диффузно по поверхности опухоли. Первый этап проводился с ежедневным контролем опухолевой поверхности в перевязочной, обработкой зоны опухоли хлоргексидином и аминокапроновой кислотой. Кровянистые выделения значительно уменьшились уже после проведения первого сеанса лучевой терапии и окончательно прекратились после 7-й фракции первого этапа. Незначительное сукровичное отделяемое после 10-й фракции.
Результат. Через 3 недели на фоне противоанемической терапии и ЛТ проведен контроль уровня гемоглобина в общем анализе крови — 95 г/л. Во время второго этапа — серозные выделения из раны, размеры опухоли уменьшились (10х9 см). Курс терапии завершился в июле 2023 года.
Фотографии 1, 2 и 3 отражают динамику опухолевого процесса. Заметим, что целью этого лечения не было достижение полной регрессии первичного опухолевого очага, а лишь стабилизация процесса. Успех в лечении достигнут, учитывая то, что на момент окончания терапии размер опухоли составил 8х7 см. В октябре 2023 года запланирован плановый контроль для оценки динамики процесса.
Выводы
Радиационная терапия в первую очередь является вариантом локального лечения опухолевого процесса. Если речь идет о множественном поражении нескольких органов, ее использование не всегда целесообразно или нужно именно в первую очередь. Окончательное решение о выборе подходящей программы лечения с вариантом подведения дозы ионизирующего излучения принимается на мультидисциплинарном консилиуме, в состав которого входят онколог-хирург, врач-химиотерапевт и радиационный онколог.
В онкологии, как ни в одной другой отрасли медицины, работают принципы «лечи пациента, а не болезнь» и «не навреди». Выбор способа доставки ионизирующего излучения к опухоли — ответственное и серьезное мероприятие, которое повлияет на качество жизни пациента. Перед началом сеансов радиационный онколог анализирует медицинскую карту пациента, данные лабораторной и инструментальной диагностики, предупреждает пациента о возможных побочных эффектах.
Также важна приверженность пациента к радиотерапии, способность беспрекословно следовать рекомендациям врача, корректировать привычки и образ жизни. К сожалению, без должных усилий и доверительных взаимоотношений между доктором и пациентом не получится одержать победу в тяжелой борьбе за жизнь человека.