Болезнь Кушинга — это нейроэндокринная патология, которая обусловлена хронической гиперпродукцией адренокортикотропного гормона (АКТГ) опухолью гипофиза, сопровождается последующей двусторонней (реже односторонней) гиперплазией и гиперфункцией коры надпочечников. Заболеваемость составляет примерно 1 случай на 1 млн детского населения в год.
Аденома гипофиза, продуцирующая АКТГ, является причиной 75–80 % случаев эндогенного гиперкортицизма у детей и чаще встречается у мальчиков (63 % всех случаев) с дебютом старше 7 лет. Клиническая симптоматика варьирует по частоте встречаемости и степени выраженности, что определяет особенности диагностики и необходимость обязательного обследования при сочетании прогрессирующего увеличения массы тела, задержки роста и полового развития.
Этиопатогенез
 Анжелика СолнцеваГиперфункция коры надпочечников бывает АКТГ-зависимой и АКТГ-независимой. У детей младше 7 лет в структуре причин гиперкортицизма преобладают АКТГ-независимые формы: аденома, карцинома, узелковая гиперплазия коры надпочечников, синдром Мак-Кьюна — Олбрайта. У пациентов старше 7 лет чаще диагностируют АКТГ-секретирующие опухоли гипофиза (75 % случаев заболевания). Эктопическая секреция АКТГ (при карциноидных опухолях бронхов, тимуса, медуллярном раке щитовидной железы, феохромоцитоме, мелкоклеточном раке легких) составляет не более 1 % случаев гиперкортицизма у детей.
Анжелика СолнцеваГиперфункция коры надпочечников бывает АКТГ-зависимой и АКТГ-независимой. У детей младше 7 лет в структуре причин гиперкортицизма преобладают АКТГ-независимые формы: аденома, карцинома, узелковая гиперплазия коры надпочечников, синдром Мак-Кьюна — Олбрайта. У пациентов старше 7 лет чаще диагностируют АКТГ-секретирующие опухоли гипофиза (75 % случаев заболевания). Эктопическая секреция АКТГ (при карциноидных опухолях бронхов, тимуса, медуллярном раке щитовидной железы, феохромоцитоме, мелкоклеточном раке легких) составляет не более 1 % случаев гиперкортицизма у детей.
 Людмила ВязоваВыделяют экзогенные и эндогенные факторы риска развития болезни Кушинга (БК).
Людмила ВязоваВыделяют экзогенные и эндогенные факторы риска развития болезни Кушинга (БК).
К экзогенным факторам относят травматическое поражение головного мозга, стрессы, нейроинфекции, к эндогенным — пубертат, беременность, роды, лактацию.
Указанные факторы могут вызывать нарушение механизма регуляции в системе «гипофиз — гипоталамус» со снижением уровня дофамина и повышением серотонина в гипоталамусе. Это приводит к увеличению стимуляции АКТГ гипофизом с последующим ростом секреции глюкокортикоидов (пучковая зона коры надпочечников), в меньшей степени — минералокортикоидов (клубочковая зона коры надпочечников) и половых стероидов (сетчатая зона коры надпочечников).
Длительная стимуляция АКТГ связана с развитием АКТГ-продуцирующих аденом гипофиза или диффузной гиперплазией кортикотропных клеток (гипоталамо-гипофизарная дисфункция).
Патологический процесс сопровождается гиперплазией (узелковой или диффузной) коры надпочечников с развитием клинической картины заболевания.
Значительно реже в детском возрасте гиперкортицизм является следствием АКТГ-независимой автономной продукции стероидных гормонов корой надпочечников при развитии в ней первичного автономного образования (опухоли или макроузелковой гиперплазии).
Клиническая симптоматика
Основные клинические проявления болезни Кушинга в детском возрасте — это задержка (остановка) роста и прогрессирующий набор массы тела.
Отмечается перераспределение жировой ткани по абдоминальному типу. Типично ее отложение на животе, груди, в височных ямках и щеках, формирование жировых подушек над ключицами и в области VII шейного позвонка.
Несмотря на то что наиболее распространенным классическим симптомом болезни Кушинга у детей является изменение внешнего вида и формы лица (в 63–100 % случаев), которое определяется при сравнении фотографий разных периодов жизни ребенка, родители и педиатры часто не связывают наблюдаемые симптомы с заболеванием.
Перераспределение жировой ткани в височных ямках и щеках («лунообразное лицо») при манифестации заболевания может быть недостаточно выраженным и часто не расценивается как патологическое, приводя к увеличению времени между появлением первых симптомов и постановкой диагноза от 2,5 до 3 лет.
Задержка роста — это один из наиболее значимых и ранних признаков гиперпродукции кортизола в детском возрасте. Низкорослость диагностируется в 42–56 % случаев, скорость роста резко снижена. Для детей с болезнью Кушинга характерны также задержка костного созревания, отставание костного возраста от паспортного, хотя у некоторых пациентов отмечается соответствие костного возраста паспортному и его опережение.
Кожные проявления: акне, гипертрихоз, гирсутизм. Один из симптомов гиперкортицизма — лицевая плетора: гиперемия щек в сочетании с одутловатостью.
Проксимальная мышечная слабость отмечается у большинства пациентов с БК.
Остеопения. У 23 % детей с БК отмечается остеопения поясничного отдела позвоночника, у 38 % — шейки бедра.
Половое развитие. Для детей допубертатного возраста характерно преждевременное адренархе. У подростков отмечается задержка полового развития.
Артериальная гипертензия. Отмечается повышение преимущественно диастолического артериального давления.
У детей младшего возраста единственными клиническими проявлениями болезни Кушинга могут быть снижение скорости роста и прогрессирующее ожирение. Отмечается феномен «ножниц» — несоответствие между SDS роста и SDS индекса массы тела, что отсутствует у детей с алиментарным ожирением, у которых SDS роста обычно выше среднего.
Обследование пациента с гиперкортицизмом
Лабораторную диагностику болезни Кушинга можно разделить на 3 этапа.
Первым этапом проводят подтверждение гиперкортицизма следующими методами:
- исследование суточной экскреции свободного кортизола с мочой;
- определение концентрации свободного кортизола в образце слюны, собранной пациентом в 23:00;
- исследование циркадности продукции кортизола (уровень кортизола в крови в 8:00 и 23:00). В норме утренний показатель кортизола более чем на 50 % выше вечернего.
Важно! При проведении малой пробы с дексаметазоном (ночной дексаметазоновый тест) определяют уровень кортизола в сыворотке крови в 8:00 после приема 1 мг препарата в 23:00, в норме его показатель не превышает 50 нмоль/л (в ответ на введение экзогенных глюкокортикоидов по принципу отрицательной обратной связи происходит подавление секреции АКТГ и кортизола). В связи с высокой вариабельностью физиологической секреции кортизола рекомендуется использовать как минимум два теста первого этапа.
Вторым этапом диагностики является выявление причины гиперкортицизма посредством определения концентраций кортизола и АКТГ в суточном ритме. Если утренний показатель АКТГ ниже 5 пг/мл на фоне высокого уровня кортизола, диагностируют АКТГ-независимый синдром Кушинга. При отсутствии подавления выработки АКТГ по принципу отрицательной обратной связи (нормальные или повышенные показатели этого гормона) верифицируют АКТГ-зависимый гиперкортицизм.
Третий этап (при необходимости) направлен на дифференциальную диагностику БК и АКТГ-эктопированного синдрома.
Для АКТГ-эктопированного синдрома характерны высокие уровни АКТГ в вечернее время. Тесты для дифференциальной диагностики АКТГ-зависимых форм гиперкортицизма основаны на допущении, что аденома гипофиза продолжает хотя бы частично подчиняться регуляторным механизмам, свойственным здоровой ткани гипофиза. При кортикотропиноме с большей вероятностью произойдет подавление секреции АКТГ в ответ на высокие дозы глюкокортикоидов. Эктопическая опухоль, секретирующая АКТГ, не обладает такими свойствами.
Большая проба с дексаметазоном проводится следующим образом: прием 8 мг дексаметазона в 23:00 и определение уровня кортизола в 8:00. У детей младше 15 лет целесообразно проводить двухдневный тест: прием 2 мг дексаметазона каждые 6 часов в течение 48 часов (пациентам с массой тела <40 кг — 120 мкг/кг/сут) с последующим определением концентрации кортизола крови на третий день в 8:00. Проба считается положительной, если происходит снижение уровня кортизола более чем на 50 % от исходного. При БК в большинстве случаев проба положительная. Но иногда секреция АКТГ аденомой гипофиза, в особенности макроаденомой, не подавляется большими дозами дексаметазона.
В последние годы большая проба с дексаметазоном реже используется в клинической практике. Вместо нее в европейских руководствах по диагностике болезни Кушинга рекомендован тест с кортикотропин-рилизинг-гормоном (КРГ). Препарат КРГ вводится внутривенно в дозе 1 мкг/кг, но не более 200 мкг. На 15, 30, 60, 90, 120, 180 и 210 минутах производят забор крови для определения уровня АКТГ и кортизола. Для БК характерно повышение концентрации АКТГ относительно базальной более чем на 35 % и кортизола — более 20 %. Для детей с болезнью Кушинга характерен более высокий подъем уровня кортизола в ответ на стимуляцию КРГ по сравнению со взрослыми, что повышает чувствительность этого метода в педиатрической практике.
Важно! Всем пациентам с подозрением на АКТГ-зависимый синдром Кушинга показано проведение МРТ головного мозга с контрастированием.
Большинство кортикотропином у детей — микроаденомы диаметром до 5 мм. АКТГ-секретирующие макроаденомы в детском возрасте встречаются реже, чем у взрослых. Аденомы обычно имеют гипоэхогенный сигнал на фоне интактной ткани гипофиза и плохо накапливают контраст. С другой стороны, выявление микроаденомы не всегда означает, что найдена причина заболевания, т. к. инциденталомы гипофиза выявляются у 10 % здоровых людей в популяции.
В случаях, когда результат МРТ головного мозга не позволяет верифицировать диагноз, рекомендовано проведение одномоментного двухстороннего селективного забора крови из нижних каменистых синусов на фоне стимуляции аналогом кортиколиберина. Отношение концентрации АКТГ в крови из каменистого синуса к его уровню в периферической крови более 3,0 после введения КРГ (положительный градиент АКТГ) свидетельствует в пользу болезни Кушинга. Так как вероятность АКТГ-эктопического синдрома у детей очень низка, основной целью этого исследования в педиатрической практике является уточнение локализации аденомы путем выявления срединной или односторонней повышенной секреции АКТГ.
Лечение
В настоящее время методом выбора у детей является эндоскопическое трансназальное удаление аденом гипофиза. В качестве метода лечения второй линии применяется лучевая терапия, решение о ее необходимости обычно принимают в течение 2–4 недель после операции, если не достигнута ремиссия заболевания. Согласно протоколам, доза облучения составляет 45 Гр за 25 фракций на протяжении 35 дней. После лучевой терапии ремиссия болезни Кушинга наступает у 92 % детей в среднем через 9–10 месяцев (от 1,5 месяца до 2,8 года) после завершения облучения. В течение 1 года у большинства пациентов развивается дефицит гормона роста, преимущественно транзиторного характера. Недостаточность гонадотропных гормонов и вторичный гипотиреоз после лучевой терапии встречаются редко.
Пациент Д., 15 лет, поступил в Республиканский детский эндокринологический центр (2-я ГДКБ Минска) с жалобами на ускоренную прибавку массы тела (около 30 кг/1,5 года), изменение внешнего вида, лунообразное лицо, эпизоды повышения АД до 140/80 мм рт. ст.
При поступлении состояние средней тяжести. Рост 176 см (SDS роста +0,88), избыток массы тела (79 кг, +1,71 SDS, ИМТ 25,5 кг/м2, SDS ИМТ +1,7) с абдоминальным распределением подкожно-жировой клетчатки, «лунообразное лицо», визуализируется слабовыраженный черный акантоз в подмышечной области, акне на лице, бледно-розовые стрии на бедрах и ягодицах.
По результатам суточного мониторирования АД подтверждена диастолическая артериальная гипертензия в дневные часы (95-я перцентиль для возраста, роста и пола).
Выявлено замедление темпов роста за последние 1,5 года с остановкой скорости роста в течение 9 месяцев, скорость роста 0 см за 9 месяцев (см. рис. 1) при опережении костного возраста на 4 месяца по сравнению с хронологическим возрастом ребенка.
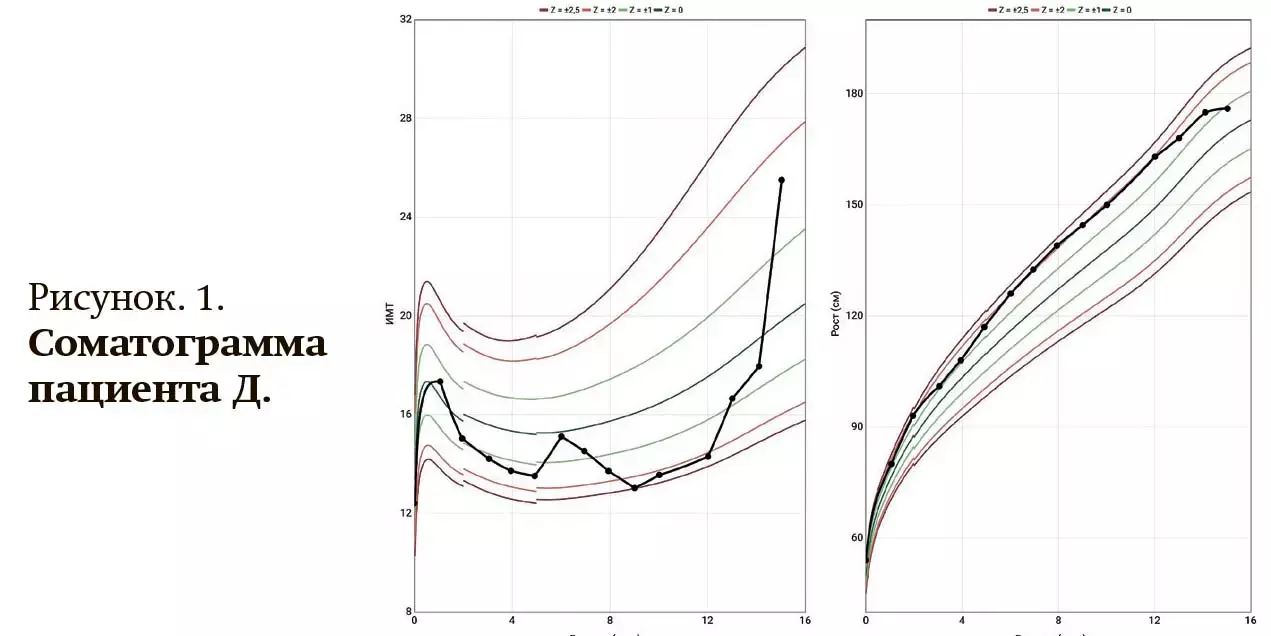
Анамнез жизни: мальчик от первой нормально протекавшей беременности, первых срочных родов с массой 3 560 г, ростом 54 см. Перенес ветряную оспу, острую пневмонию, ковидную и ВЭБ инфекции, ОРЗ. При осмотре педиатра в 15 лет установлен диагноз артериальной гипертензии (предположительно эндокринного генеза). Семейный анамнез по эндокринной патологии не отягощен. Целевой (генетический) рост 184,7±12,0 см, SDS целевого роста +1,12.
Анамнез заболевания: с возраста 12,5 года отмечена прогрессирующая прибавка массы тела со скоростью 1–2 кг в месяц (около 20 кг в год) при отсутствии изменений количества, качества и калорийности принимаемой пищи. В возрасте 14,4 года ребенок обследован амбулаторно. Рост 176 см (+1,34 SDS), масса тела 65 кг (+0,97 SDS), ИМТ 21 кг/м2 (+0,64 SDS). Стадия пубертата 4 по Таннеру. Диагностирован избыток жировой массы (биоимпедансным методом), выявлено увеличение уровней гемоглобина и гематокрита, гиперинсулинемия, повышенный индекс инсулинорезистентности НОМА и нормальные показатели глюкозы крови и гликированного гемоглобина (НbА1с). Уровни тиреотропного гормона (ТТГ) и свободного тироксина (Т4св.) находились на нижних границах нормы. Эндокринологом были даны рекомендации по питанию и питьевому режиму, осмотр через 6 месяцев.
В течение последующих 6 месяцев пациент прибавил дополнительно 15 кг массы, появились жалобы на утомляемость, нарушение сна, повышение САД до 150 мм рт. ст. Скорость роста составила 0 см за 6 месяцев. Отсутствие прогрессии полового развития за 6 месяцев после предыдущего осмотра (стадия пубертата 4 по Таннеру).
Ребенок был обследован согласно клиническому протоколу диагностики и лечения пациентов с эндокринологическими заболеваниями (детское население), утвержденному постановлением Министерства здравоохранения № 90 от 23.08.2019.
Диагностический поиск
По результатам общего анализа крови выявлены умеренный эритроцитоз и повышение уровня гемоглобина. Биохимический анализ крови (натрий, калий, аспартатаминотрансфераза, аланинаминотрансфераза, глюкоза, холестерин) — без патологии, нормальный уровень НbА1с, гиперинсулинемия натощак, повышение индекса инсулинорезистентности НОМА до 8,1 (<3,2).
Гормональное обследование
1. Выявлены: нарушения циркадного ритма секреции кортизола крови (двукратно); повышение концентрации кортизола в пробах слюны, собранных в 23:00 с временным интервалом 2 недели; увеличение уровня свободного кортизола в суточной моче при трехкратном сборе анализа в течение недели.
Таким образом, по результатам проведенных тестов у пациента был подтвержден эндогенный гиперкортицизм.
2. Отмечено повышение уровня утреннего АКТГ крови, что свидетельствовало о наличии АКТГ-зависимого гиперкортицизма.
3. При проведении ночного дексаметазонового теста выявлено подавление уровня кортизола на 30 % относительно исходного уровня гормона — до 395,8 нмоль/л. Подавление концентрации кортизола позволило предположить, что отрицательная обратная связь в гипоталамо-гипофизарно-надпочечниковой оси частично сохранена и источником повышенной секреции АКТГ являлась опухоль гипофиза.
4. Зарегистрирована повышенная для стадии полового развития концентрация дегидроэпиандростерона (андрогена надпочечникового происхождения).
5. Установлены нормальные показатели тиреоидного статуса, уровень половых гормонов соответствовал допубертатным значениям.
Учитывая повышенные утренние уровни АКТГ и кортизола, нарушение их циркадного ритма секреции, высокий уровень свободного кортизола в суточной моче, выраженную прибавку массы тела и остановку в скорости роста, отсутствие прогрессии полового развития, наличие артериальной гипертензии у ребенка был установлен АКТГ-зависимый эндогенный гиперкортицизм.
Далее предстояло определить источник секреции АКТГ.
Инструментальное обследование
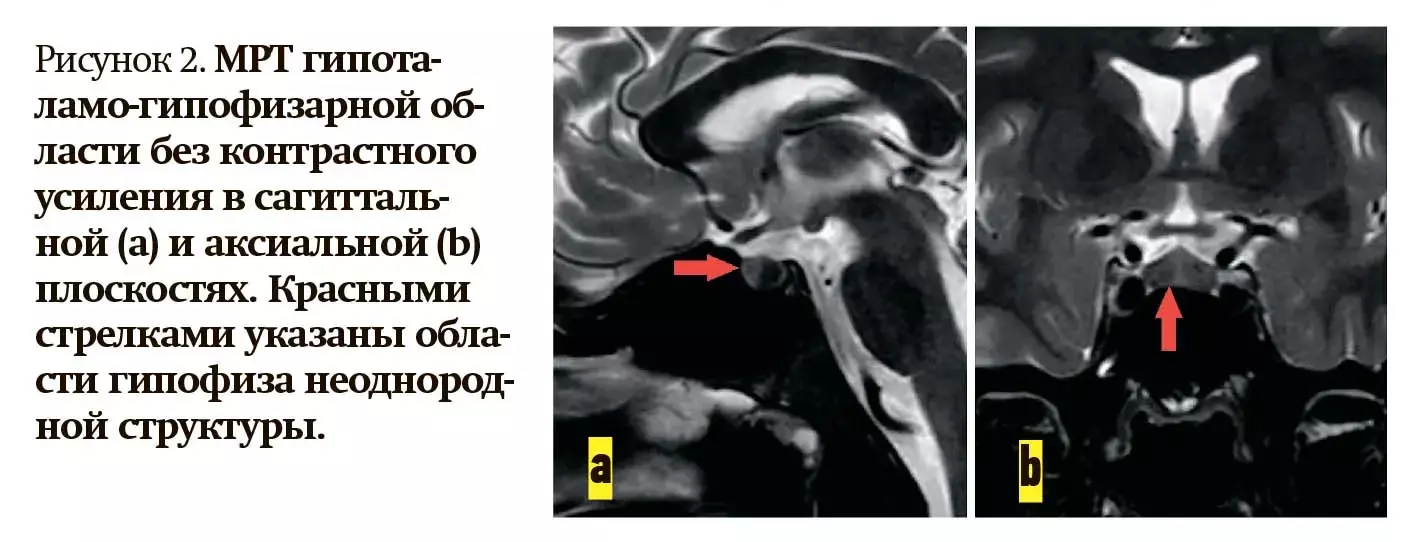 1. По результатам МРТ головного мозга без контрастного усиления гипофиз имел нормальные размеры (15×10×8 мм), неоднородность структуры (см. рис. 2a, 2b). В правой лобной доле обнаружены участки кортикальной дисплазии.
1. По результатам МРТ головного мозга без контрастного усиления гипофиз имел нормальные размеры (15×10×8 мм), неоднородность структуры (см. рис. 2a, 2b). В правой лобной доле обнаружены участки кортикальной дисплазии.
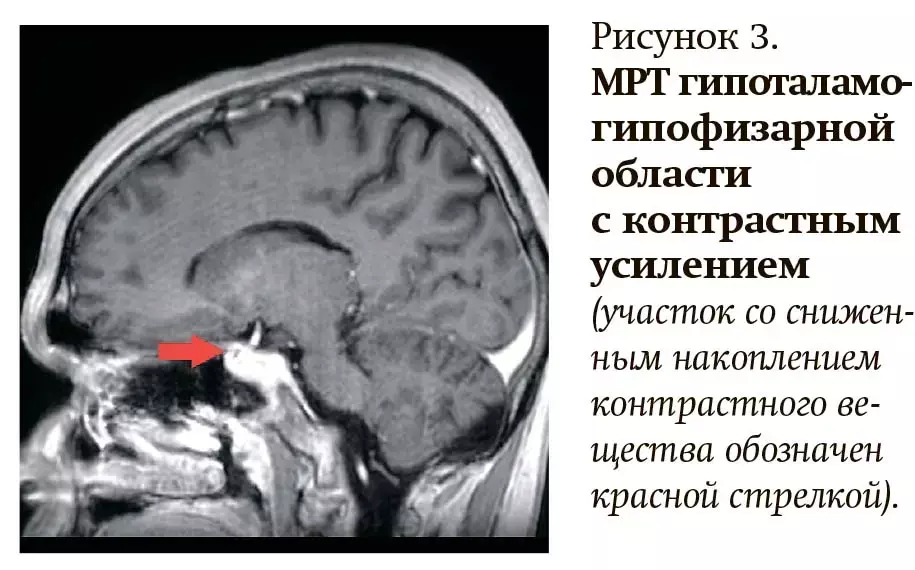 По результатам МРТ гипоталамо-гипофизарной области при динамическом контрастном усилении установлено наличие в аденогипофизе слева участка со сниженным накоплением контрастного вещества по сравнению с остальной частью аденогипофиза размерами 4,5×4 мм в коронарной плоскости (см. рис. 3).
По результатам МРТ гипоталамо-гипофизарной области при динамическом контрастном усилении установлено наличие в аденогипофизе слева участка со сниженным накоплением контрастного вещества по сравнению с остальной частью аденогипофиза размерами 4,5×4 мм в коронарной плоскости (см. рис. 3).
2. Компьютерная томография надпочечников: оба надпочечника не изменены.
Поскольку в трех лабораторных тестах был подтвержден АКТГ-зависимый гиперкортицизм и по результатам МРТ выявлен участок ткани гипофиза со сниженным накоплением контрастного вещества, установлен диагноз: болезнь Кушинга на фоне кортикотропин-секретирующей микроаденомы гипофиза.
Пациент был направлен на оперативное лечение в РНПЦ неврологии и нейрохирургии, где успешно проведено удаление опухоли транссфеноидальным эндоскопическим методом.
Заключение патолого-гистологического исследования (микроскопическое описание): аденома гипофиза.
