Лейкопения и нейтропения представляют собой количественные изменения в общем анализе крови — уменьшение числа лейкоцитов и нейтрофилов в единице объема крови. С подобными изменениями часто сталкиваются врачи широкого спектра специальностей. При этом далеко не всегда нейтропения и лейкопения являются заболеванием. Чаще это реактивные изменения состава крови в ответ как на патологические, так и на физиологические процессы.
 Хотя проблема гиподиагностики нейтропений при наличии инфекционных осложнений в настоящее время остро не стоит, существует проблема гиперопеки пациентов с нейтропенией.
Хотя проблема гиподиагностики нейтропений при наличии инфекционных осложнений в настоящее время остро не стоит, существует проблема гиперопеки пациентов с нейтропенией.
Как правило, обнаружение лейкопении и нейтропении, особенно у ребенка, нередко сопровождается назначением множества лабораторных анализов, различными ненужными ограничениями (отказ от прививок, запрет на посещение детских коллективов) и бесконтрольным назначением антибиотиков, что закономерно порождает серьезное беспокойство родителей.
В связи с этим понимание основных механизмов развития и причин нейтропений, принципы их дифференциальной диагностики, подходы к наблюдению пациентов важны для медицинских работников как первичного звена, так и узких специалистов, оказывающих профильную медицинскую помощь.
Распределение в организме и функции нейтрофилов
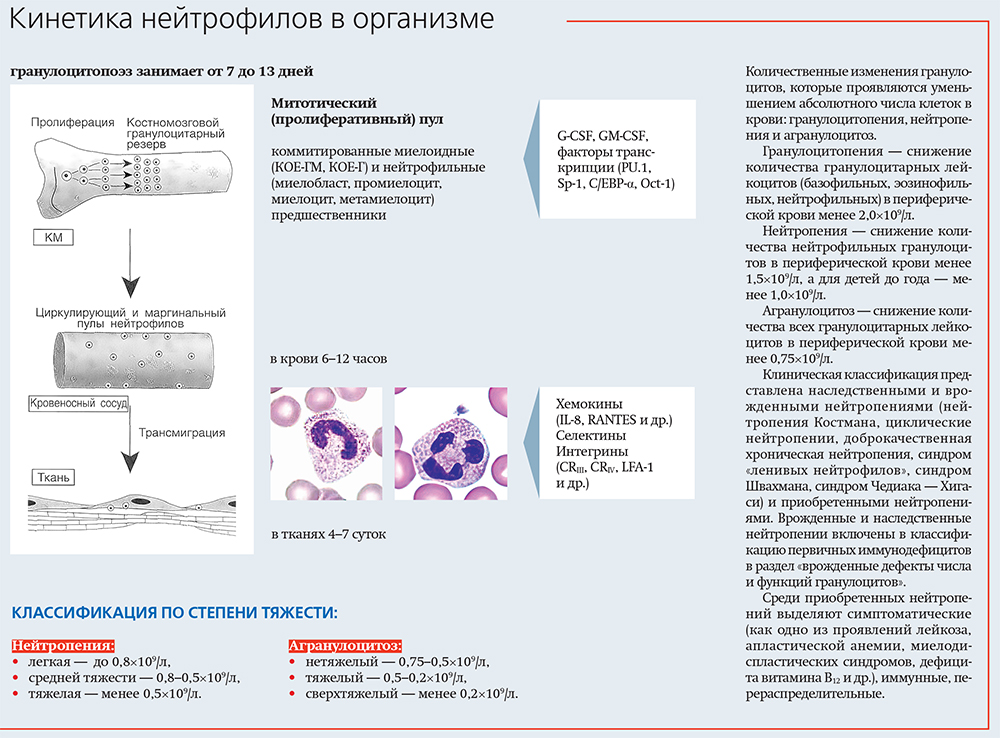
Нейтрофильные гранулоциты являются наиболее многочисленными (ежегодная продукция — около 60 млрд) и коротко живущими клетками лейкоцитарной системы, активируются под действием иммунных и инфекционных медиаторов. Их функции: циркуляция в крови, направленная миграция (хемотаксис), фагоцитоз, эффекторы воспаления, дегрануляция и секреция содержимого гранул, синтез биологически активных веществ.
Нейтрофилы — одни из наиболее быстрых и чувствительных клеток, обладающих функцией хемотаксиса. В покое нейтрофилы не поляризованы: они неактивны и неподвижны; их хемотаксис полностью зависит от внешних воздействий. В остальном движение этих клеток типично: активность ориентируется в сторону высокой концентрации хемоаттрактанта. Чем круче градиент, тем более эффективна ориентация клеток в пространстве и их направленное движение.
Нейтрофилы способны одновременно распознавать несколько градиентов различных хемоаттрактантов. Они избирательно направляются в различные уча-стки инфекций и воспаления в организме под действием сложной гаммы более чем 50 хемокинов. Для того чтобы успешно достичь цели, эти клетки преимущественно реагируют на так называемые целевые факторы и в меньшей степени на промежуточные хемоаттрактанты.
Эффективность хемотаксиса нейтрофилов возрастает с увеличением концентрации хемоаттрактанта до определенного уровня, после достижения которого она падает. Поэтому градиенты вторичных факторов могут по-прежнему направлять миграцию нейтрофилов тогда, когда концентрация первичного фактора достигает насыщения. Этот механизм, известный как последовательная навигация, позволяет лейкоцитам направленно проходить значительные расстояния до нужных мест в организме.
На мембране нейтрофилов установлено значительное количество рецепторов, позволяющих клетке осуществлять хемотаксис, адгезию, дегрануляцию и поглощение. Нейтрофилы формируют внеклеточное пространство в виде сетеподобных структур — нейтрофильные внеклеточные ловушки (Neutrophil extracellular traps, NETs), в которых количество бактерий гораздо больше, чем в самом фагоците.
Гранулы нейтрофилов содержат более 20 протеолитических ферментов, миелопероксидазу, бактерицидные белки (лактоферрин, дефенсины, катионные белки), лизоцим, щелочную фосфатазу, способные переварить различные микроорганизмы. Экспрессия CD40, CD80, CD86 и HLA-DR определяет способность нейтрофилов выступать в роли антигенпрезентирующих клеток для Т-лимфоцитов.
Рецепторы для Fc-фрагмента иммуноглобулинов, CD64, CD32, CD16, (FcγR I, II и III), компонентов системы комплемента (C3, C5a, CRI), интегрины обеспечивают взаимодействие с эндотелиальными клетками и последующую миграцию из кровеносного русла в ткани. Кроме того, нейтрофилы секретируют широкий спектр цитокинов, поэтому они способны модулировать функциональную активность других клеток.
В организме нейтрофилы условно формируют несколько пулов: циркулирующий (4–30 часов, 3–5 %), тканевой (4–5 суток, 50–70 %), маргинальный (4–30 часов, 15–20 %), костномозговой (3–4 дня, 30 %).
Перераспределительные лейкопении
Существование костномозгового резерва, краевого резерва позволяет нейтрофилам обладать уникальной способностью к изменению своей численности, когда это необходимо организму, как за счет пула пролиферирующих, так и за счет «рекрутирования» зрелых клеток. Эта особенность и лежит в основе перераспределительного механизма развития как лейкоцитозов, так и лейкопений.
В основе перераспределительных лейкопений и нейтропений лежит уменьшение внутрисосудистого пула свободно циркулирующих и увеличение количества депонированных нейтрофилов в местах физиологического и патологического депонирования крови. В связи с этим очевидна возможность развития нейтропений при шоке различного происхождения, воспалительных заболеваниях, при спленомегалии.
Перераспределительная нейтропения может быть обусловлена интенсивной миграцией нейтрофилов, усилением их элиминации из системного кровотока в зону хронического воспалительного процесса. Такая ситуация сопровождает хронические энтериты, гастриты, холециститы, воспалительные процессы верхних дыхательных путей, мочевыделительной и половой систем инфекционной и неинфекционной природы. Мигрировавшие в зону воспаления нейтрофилы подвергаются дегенерации в зоне альтерации.
В связи с этим вторично развивается недостаточность внутрисосудистого пула циркулирующих лейкоцитов. Сигналом для активизации миграционных процессов в физиологических условиях могут быть фактически любые признаки тканевого неблагополучия (изменение кислотно-щелочного баланса, тканевая гипоксия, накопление продуктов метаболизма), требующие повышения активизации аутофагии, фагоцитоза, микроциркуляции и системы протон-управляемых ионных каналов клеточной мембраны.
Наличие нейтропении в данных обстоятельствах, вероятно, можно считать критерием напряжения механизмов сохранения постоянства внеклеточной среды. Подобная разновидность лейкопении и нейтропении не выделяется как самостоятельная форма патологии, а трактуется как реактивные изменения.
Виды иммунных нейтропений
Неонатальные иммунные нейтропении
- Материнские антитела к нейтрофильным антигенам плода.
- Идентично развитию Rh-конфликта.
- Спонтанно разрешается в течение нескольких недель-месяцев по мере катаболизма материнских антигранулоцитарных антител.
Аутоиммунные нейтропении
Вторичные:
- на фоне аутоиммунного заболевания
- СКВ
- гранулематоз Вегенера
- ревматоидный артрит
Первичные:
Аутоантитела к поверхностным антигенам нейтрофилов:
- FcgRIIIb (CD16b)
- LCAMb (CD11b/CD18)
- C3b комплементарному рецептору (CD35)
- FcgRII (CD32)
Иммунные нейтропении — результат повышенной деструкции нейтрофилов под воздействием ауто- или алло-антигранулоцитарных антител.
Клинические проявления нейтропений характеризуются инфекционным синдромом в виде локальных или генерализованных инфекций: отиты, стоматиты, лимфадениты, флегмоны, пневмонии, плевриты, сепсис и т. д. Инфекционные осложнения при нейтропениях имеют свои особенности: слабый локальный ответ, язвенно-некротические поражения кожи и слизистых, преобладание общих симптомов над местными, затяжное течение, рецидивирующие инфекции, анатомическое распространение инфекционного процесса.
Слабая местная воспалительная реакция связана с уменьшением количества нейтрофилов, которые являются клетками, обеспечивающими выраженность воспалительных проявлений. Характерен интоксикационный синдром в виде повышения температуры тела, артралгий, миалгий, слабости, повышенной утомляемости и т. п. Частое проявление нейтропении — лихорадка неясного генеза.
Дифференциальная диагностика приобретенных нейтропений проводится с апластическими анемиям, миелодиспластическими синдромами, острыми лейкозами, В12-, фолиеводефицитными анемиями, первичными иммунодефицитами, синдромом гиперспленизма, злокачественными новообразованиями с лейкемизацией, болезнями накопления.
Методы и принципы лечения
Лечение симптоматических нейтропений проводится согласно программе терапии основного заболевания.
При иммунных нейтропениях в период нейтропенического криза используется консервативное лечение: глюкокортикостероиды (усиливают пролиферацию и дифференцировку клеток-предшественниц гемопоэза, в т. ч. гранулоцитопоэза, снижают выработку антител); внутривенный иммуноглобулин (активизирует фагоцитоз, восстанавливает функцию Т-лимфоцитов, блокирует поверхность нейтрофилов, предохраняя их от повреждающего действия антител, угнетает синтез антигранулоцитарных антител, усиливает активность гуморальных факторов защиты).
При циклических и ятрогенных нейтропениях используют гемопоэтические факторы роста (усиливают пролиферацию и дифференцировку клеток, стимулируют ростки кроветворения по определенным линиям).
При наследственных и врожденных нейтропениях радикальным методом лечения является аллогенная трансплантация гемопоэтических стволовых клеток.
Сопроводительная терапия складывается из общих режимных мероприятий (изоляция пациента с созданием максимально возможных условий стерильности, строжайшее соблюдение личной гигиены, механическая и термическая обработка пищи) и медикаментозной терапии (антибактериальная, противовирусная, инфузионная терапия, препараты, улучшающие клеточный метаболизм).
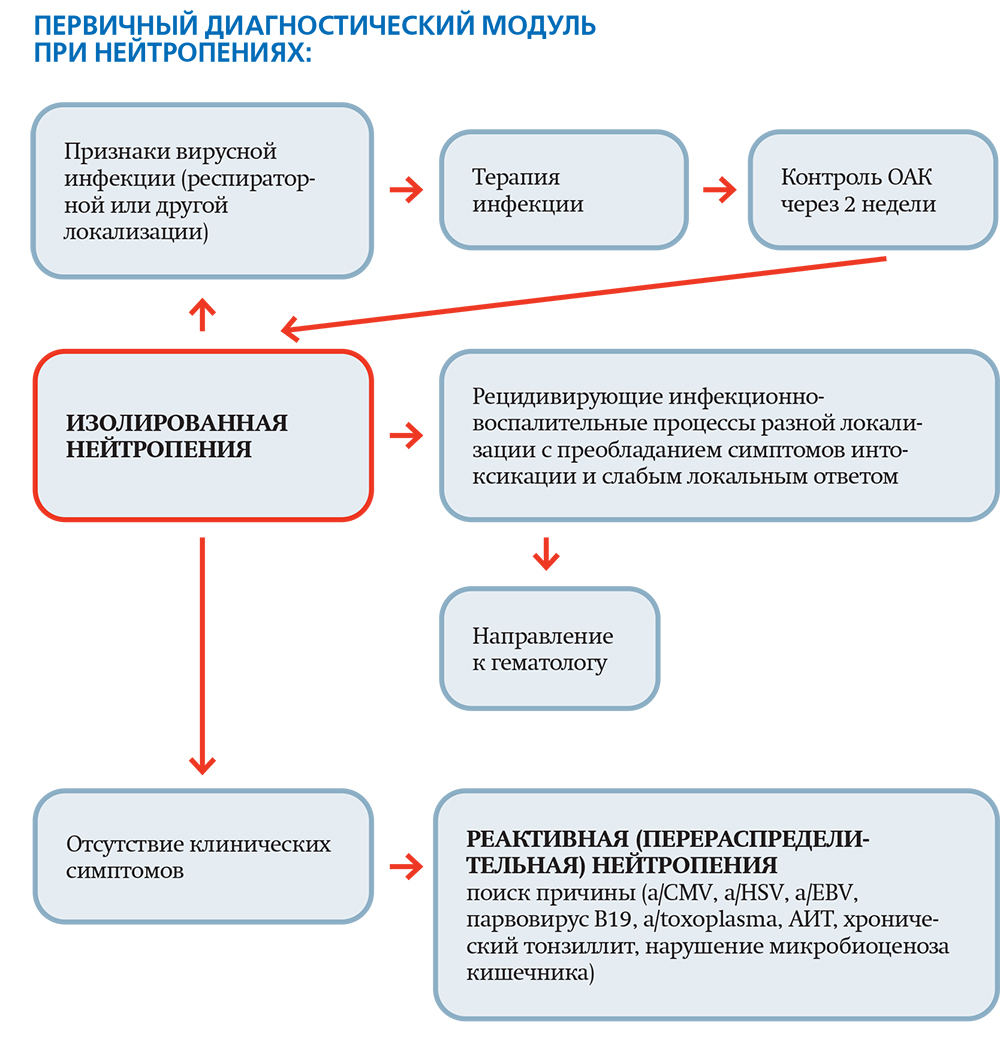
Нейтропения: причина или следствие?
Что следует анализировать:
- показатели абсолютного количества нейтрофилов в предшествующих клинических анализах крови;
- динамику показателей общего числа лейкоцитов и абсолютного количества нейтрофилов после перенесенного заболевания и между новыми инфекционно-воспалительными эпизодами;
- частоту и характер инфекционно-воспалительных эпизодов.
Клинические случаи
Мальчик, 1,5 года. Родился в срок от 1-й беременности, масса тела при рождении 3 750 г. Беременность протекала без особенностей. Привит в роддоме, реакций и осложнений не было. Родители здоровы. С возраста 7 месяцев в гемограмме нейтропения средней степени тяжести. Инфекционных эпизодов в анамнезе не было.
При осмотре ребенок активный, периферические лимфатические узлы не увеличены, органы и системы без особенностей. В общем анализе крови изолированная нейтропения средней степени тяжести (количество нейтрофилов 0,82ґ109/л). Мониторинг ОАК в течение 11 месяцев — нейтропения от тяжелой до легкой степени тяжести. За период наблюдения в течение года два инфекционных эпизода: ОРИ, острый ринофарингит и острый ринит; оба инфекционных эпизода протекали типично, подъем температуры тела до 38 °С в течение 2-х дней, выздоровление в течение 5–7 дней.
Наличие изолированной нейтропении при отсутствии тяжелых инфекционных осложнений может указывать на ее реактивный характер.
При проведении лабораторного обследования пациента установлено наличие в сыворотке крови антител к цитомегаловирусу IgG, парвовирусу В19 IgM (сомнит.) и IgG.
Диагноз: латентное носительство цитомегаловируса, парвовируса В19; реактивная нейтропения средней степени тяжести.
Рекомендации:
- специфическое лечение нейтропении не показано,
- наблюдение педиатра,
- контроль ОАК 1 раз в 3 месяца в течение года, затем 1 раз в 6 месяцев,
- профилактические прививки разрешены.
В результате динамического наблюдения в течение 2-х лет инфекционные эпизоды в виде легкого течения ОРИ, острый ринофарингит регистрировались 3 раза; на фоне острой инфекции и повышения температуры тела до 38,5 °С количество нейтрофилов достигало нормальных значений (1,98–3,4ґ109/л), но после выздоровления снижалось до прежних значений; при мониторинге ОАК вне инфекционных эпизодов сохранялась нейтропения от средней до легкой степени тяжести (количество нейтрофилов 0,67–0,92ґ109/л).
К 4-летнему возрасту ребенка показатель количества нейтрофилов в ОАК установился в пределах нормальных значений.
Девочка, 2,5 года. От 2-й беременности, 2-х родов, доношенная, масса тела при рождении 3 320 г. Родители здоровы. Беременность протекала без особенностей. Профилактические прививки отсрочены и по индивидуальному календарю в связи с частыми инфекционно-воспалительными заболеваниями.
С возраста 5 месяцев до 2,5 года зарегистрированы инфекционные эпизоды: абсцесс правой ягодицы (в 5 месяцев), абсцесс щечной области слева (в 7 месяцев), гнойный шейный лимфаденит (в 8 месяцев), острый пиелонефрит (в 10 месяцев), рецидивирующие язвенно-некротические стоматиты, активная CMV-инфекция (в 1 год и 8 месяцев), пневмонии (в 1 год, в 1,5 года, в 2 года). Все инфекционные эпизоды имели затяжное течение, протекали с длительными эпизодами фебрильной температуры, требовали назначения сочетанной антибактериальной терапии. Нейтропения от средней до тяжелой степени тяжести (количество нейтрофилов 0,2–0,07ґ109/л) регистрировалась в гемограмме с трехмесячного возраста. С возраста 1 год присоединилась анемия легкой степени тяжести — гипохромная микроцитарная.
По причине наличия тяжелой нейтропении в возрасте 2,5 года ребенок был направлен на консультацию гематолога. Наличие тяжелой нейтропении в сочетании с частыми затяжными рецидивирующими тяжелыми инфекционными осложнениями различной локализации указывает на истинный характер нейтропении. По результатам проведенного в гематологическом отделении обследования установлено снижение количества нейтрофильных гранулоцитов в костном мозге и наличие мутации в гене ELANE.
Диагноз: первичный иммунодефицит: врожденная нейтропения с высоким обрывом созревания, ELANE положительная.
В возрасте 6 лет ребенку проведена аллогенная неродственная HLA-совместимая трансплантация гемопоэтических стволовых клеток костного мозга, в результате чего достигнуто восстановление гематологических показателей.