Проблема антибиотикорезистентности приобрела особую значимость во всем мире и особенно обострилась в период пандемии COVID-19 по причине массового, зачастую необоснованного применения антибиотиков (АБ) широкого спектра действия. В настоящее время появились штаммы бактерий, резистентные практически к каждому АБ, а создать новый препарат намного сложнее, чем раньше.
Резистентность к АБ в развитых странах мира рассматривается как угроза национальной безопасности. Согласно оценкам международных экспертов, антимикробная резистентность являлась причиной более 700 тысяч смертельных случаев ежегодно (в т. ч. 22 тысячи в Европе) в допандемийный период. Предполагалось, что к 2050 году эта цифра может возрасти до 10 млн человек с увеличением сопутствующих затрат системы здравоохранения до 1 трлн долларов. За годы пандемии негативные тенденции только усилились.
Одним из действенных инструментов управления антимикробной терапией в учреждениях здравоохранения является DDD-анализ потребления антибиотиков резерва. В основе системы лежит мониторинг универсальной единицы измерения потребления лекарственного средства Defined Daily Dose (DDD).
Оптимальная фармакотерапия
 Управление антимикробной терапией (АМТ) представляет собой совокупность продолжительных по времени многоплановых мероприятий по улучшению практики назначения АБ с целью повысить клиническую и экономическую эффективность, а также безопасность лечения.
Управление антимикробной терапией (АМТ) представляет собой совокупность продолжительных по времени многоплановых мероприятий по улучшению практики назначения АБ с целью повысить клиническую и экономическую эффективность, а также безопасность лечения.
В понятие оптимальной фармакотерапии входит выбор наиболее подходящего в конкретной клинической ситуации препарата, режима его дозирования, пути введения и длительности лечения.
В зависимости от диагноза, состояния пациента и свойств препарата может рассматриваться необходимость использования комбинированной, ступенчатой и/или деэскалационной терапии. При этом основной целью большинства программ управления АМТ является обеспечение эффективного лечения пациентов с инфекционными заболеваниями с минимизацией нежелательных последствий применения АБ.
Количественные показатели
Краеугольным камнем любой программы контроля АМТ является количественное измерение использования АБ. Это требует единой системы классификации лекарственных средств (ЛС) и единиц измерения их потребления. Стандартизированной единицей измерения для использования ЛС является установленная суточная доза.
Согласно определению ВОЗ, DDD — это основная международная единица использования ЛС, представляющая собой среднюю поддерживающую дозу ЛС при его применении у 80 % пролеченных взрослых пациентов по основному показанию. Проще говоря, DDD — это количество лекарственного средства, которое каждый взрослый пациент будет получать ежедневно для лечения инфекции.
DDD — формализованная единица измерения и поэтому не всегда отражает рекомендуемую или назначенную ежедневную дозу препарата. Установленные суточные дозы не являются клиническими дозами. Реальные лечебные дозы у отдельных больных или групп пациентов часто отличны от DDD, так как основаны на индивидуальных характеристиках (возраст, вес, особенности фармакокинетики и пр.).
Для ряда ЛС (сыворотки, вакцины, противоопухолевые препараты, аллергены) DDD не установлена. Информацию по величине DDD конкретного ЛС можно найти на сайте whocc.no.
Данные о потреблении ЛС могут представляться в виде ряда показателей, которые позволяют проводить сравнения потребления ЛС между регионами, отдельными УЗ или отделениями. Количество установленных поддерживающих доз на 100 пролеченных пациентов за определенный период времени (NDDD/100 пролеченных пациентов/год) рассчитывается как частное от произведения NDDD ЛС в год на 100 и числа госпитализированных пациентов (100 койко-дней) в течение года.
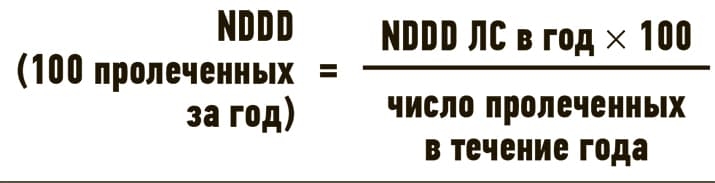
В Республике Беларусь в соответствии с требованием приказа Минздрава «Об организации работы врача-клинического фармаколога организации здравоохранения» от 30.10.2017 № 1246 проводится ежегодно DDD-анализ потребления антибактериальных препаратов резерва на 100 пролеченных пациентов в учреждениях здравоохранения, проводящих закупки антибактериальных препаратов резерва.
Проведение DDD-мониторинга антибиотиков дает возможность получать реальные данные об их потреблении, рассчитывать лекарственную нагрузку на пациента и оценивать тенденции использования этой группы препаратов в определенном стационаре или его подразделении с течением времени.
Разработка и внедрение алгоритмов АМТ с учетом данных микробиологического мониторинга помогает оптимизировать применение антибиотиков, что сдерживает рост резистентности микроорганизмов в конкретном стационаре и снижает необоснованные затраты на антимикробные препараты.
Опыт Брестской областной клинической больницы
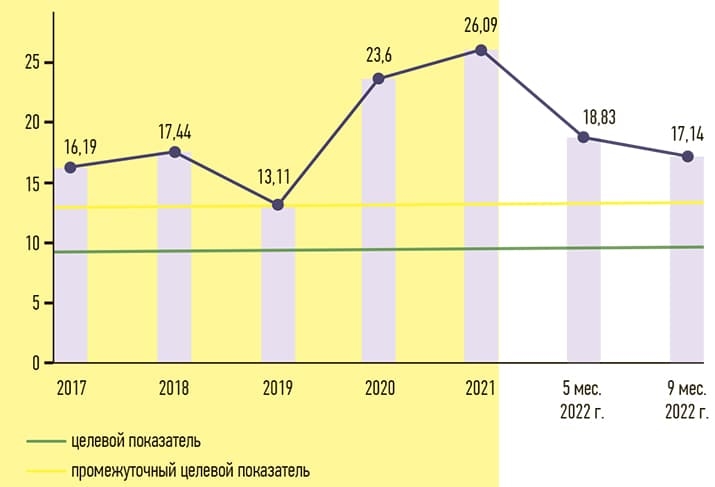
Затраты на закупку антибиотиков резерва в Брестской ОКБ в 2020 году, по данным АВС/VEN-анализа, составили 20,93 % от общей суммы затрат на ЛС, в 2021-м — 15,97 %. Лидером по затратам среди антибиотиков резерва на протяжении последних пяти лет остается меропенем. Динамика DDD меропенема на 100 пролеченных пациентов достигала максимума в 2021 году (см. рис. 1).
Рисунок 1. Сравнительный DDD-анализ потребления меропенема на 100 пролеченных пациентов Брестской ОКБ.
Анализ потребления АБ резерва выполняем с помощью программы Excel по данным расхода ЛС (см. табл. 1). (Столбцы «Количество расходованного антибактериального ЛС в г», «NDDD» и «Количество пролеченных пациентов» в статье не привожу ввиду вероятного конфликта интересов производителей. — Прим. авт.)
Таблица 1. DDD-анализ потребления антибактериальных препаратов резерва в Брестской областной клинической больнице.

Микробиологический пейзаж
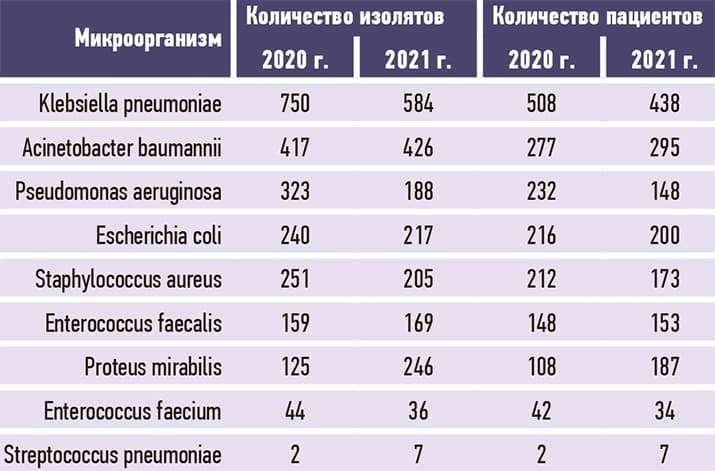
По данным WHONET бактериологической лаборатории Брестского областного противотуберкулезного диспансера, микробиологический пейзаж Брестской ОКБ в сравнении с 2020 годом несколько изменился: Klebsiella pneumoniae, несмотря на снижение выделения, остается лидером среди клинически значимых микроорганизмов, повысилось выделение грамотрицательных микроорганизмов за счет увеличения частоты Acinetobacter baumannii и Proteus mirabilis, со снижением выделения Pseudomonas aeruginosa и незначительным снижением Escherichia coli (см. рис. 2 и табл. 2). Proteus mirabilis дополнительно включен в микробиологический мониторинг БОКБ приказом главного врача как клинически значимый микроорганизм для больницы.
Рисунок 2. Частота выделения микроорганизмов согласно WHONET (01.01.2021 – 31.12.2021)
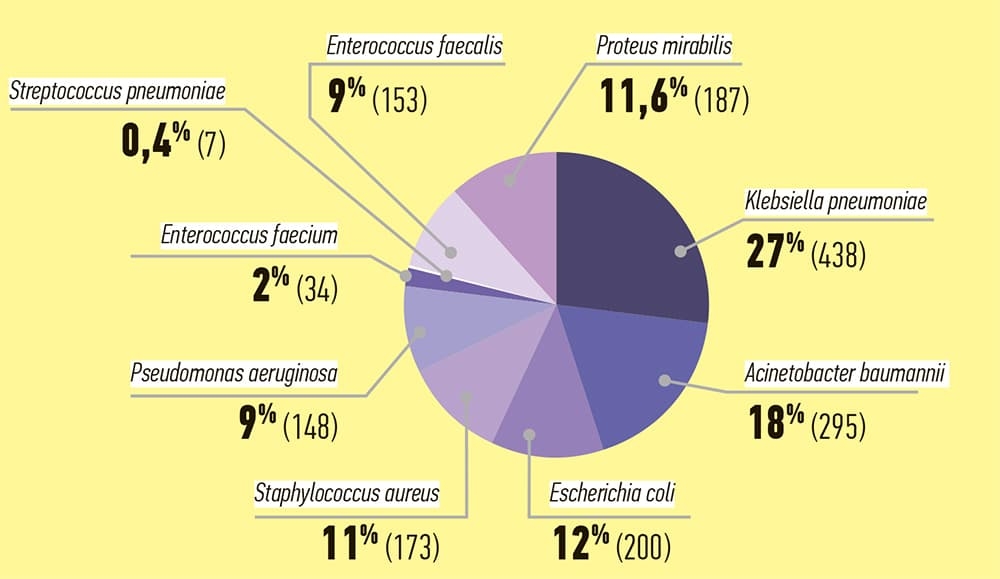
Таблица 2. Микробиологический пейзаж в 2020 и 2021 годах.
Устойчивость микроорганизмов к изучаемым антибиотикам
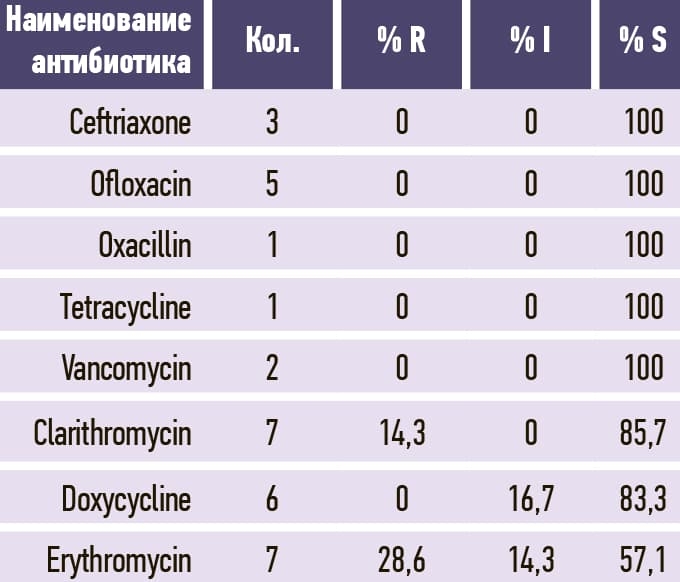
В табл. 3–11 приведено соотношение долей чувствительных (S), устойчивых (R) и промежуточных (I; умеренно чувствительных) микроорганизмов к изучаемым антибиотикам.
Таблица 3. Klebsiella pneumoniae.
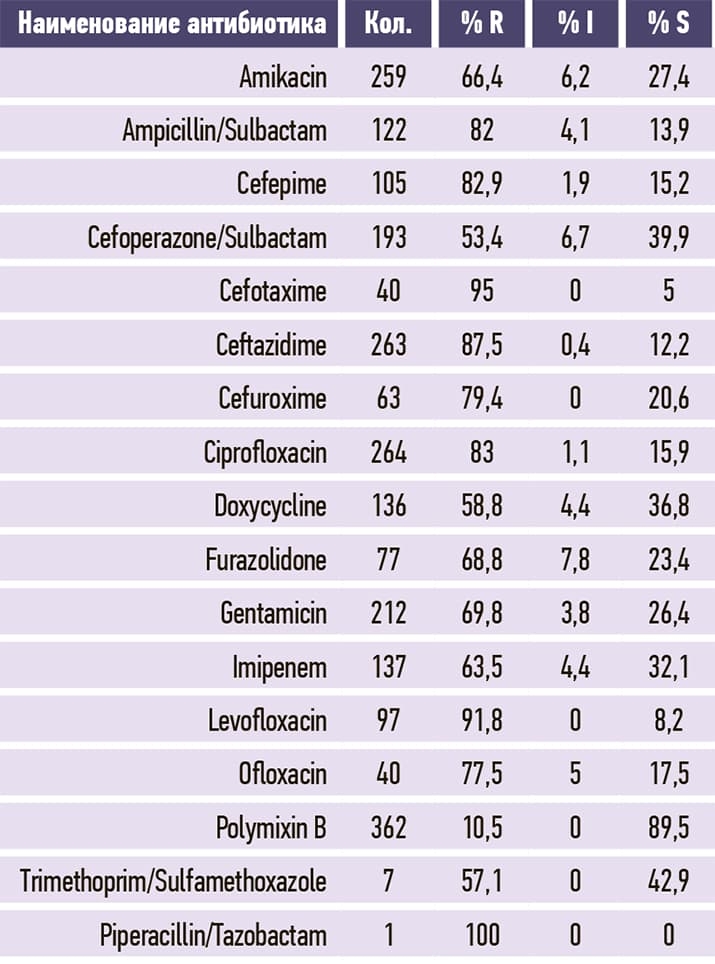
Таблица 4. Pseudomonas aeruginosa.
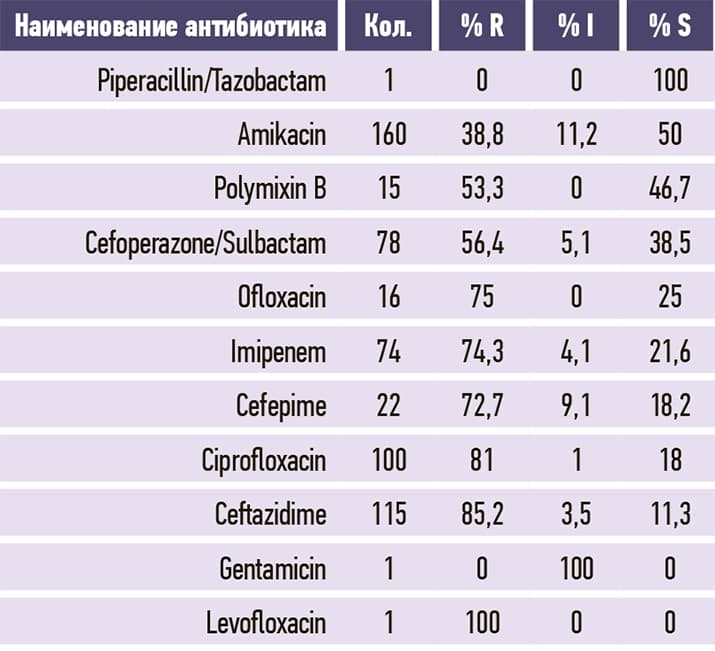
Таблица 5. Acinetobacter baumannii.
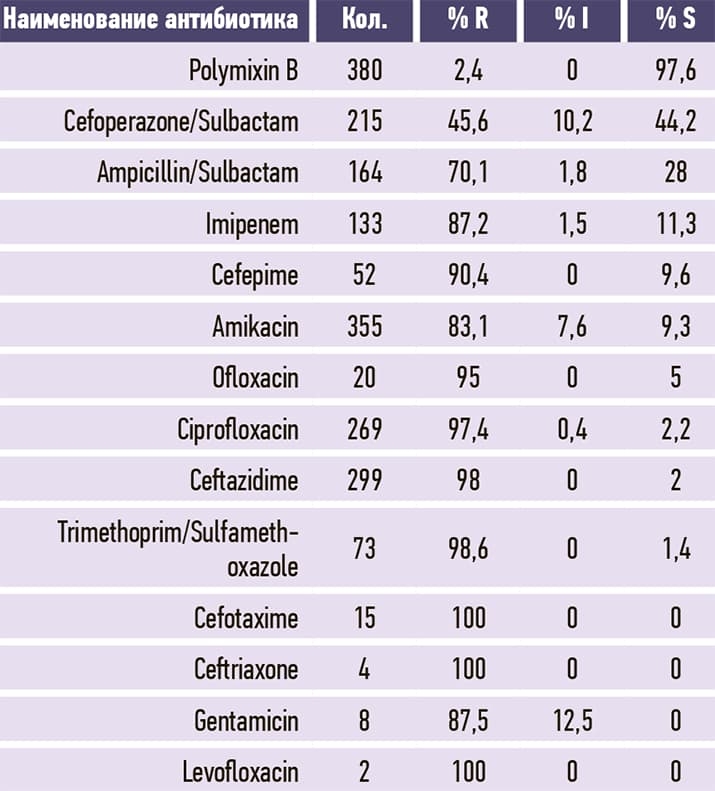
Таблица 6. Escherichia coli.
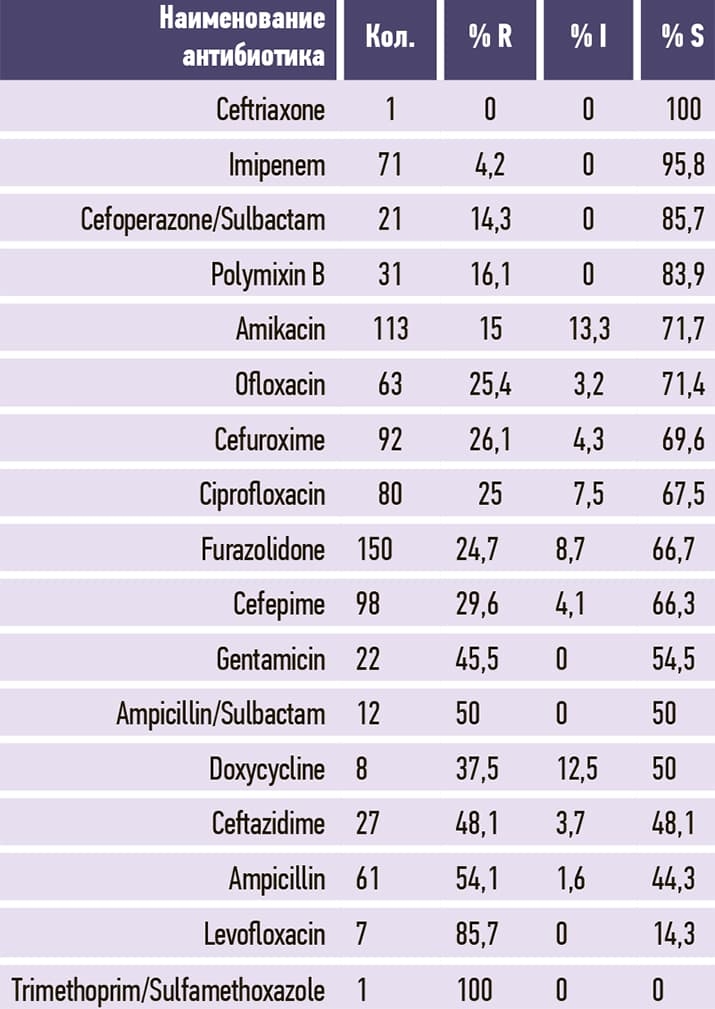
Таблица 7. Staphylococcus aureus.
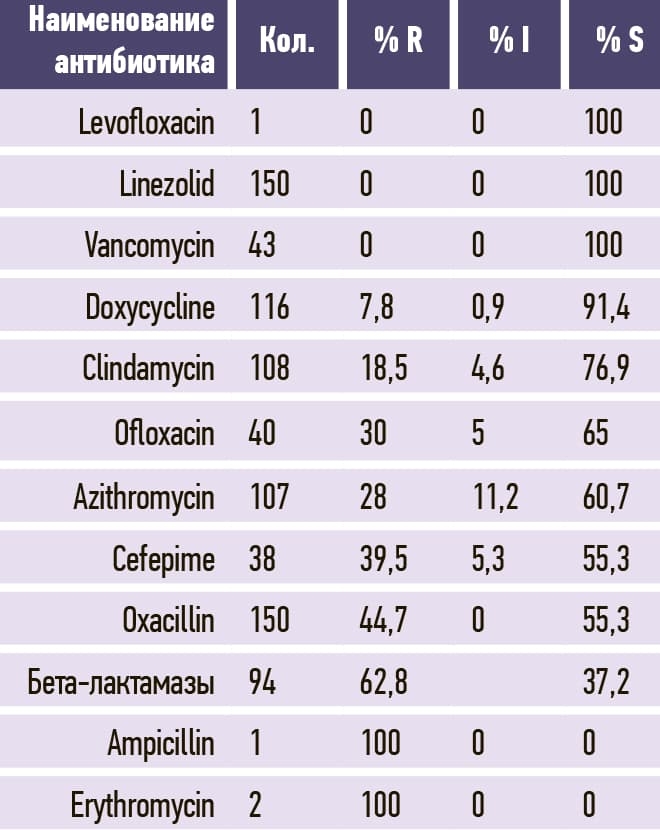
Таблица 8. Enterococcus faecium.
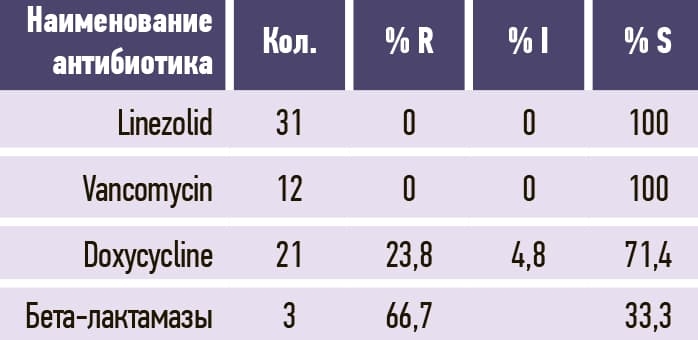
Таблица 9. Enterococcus faecalis.
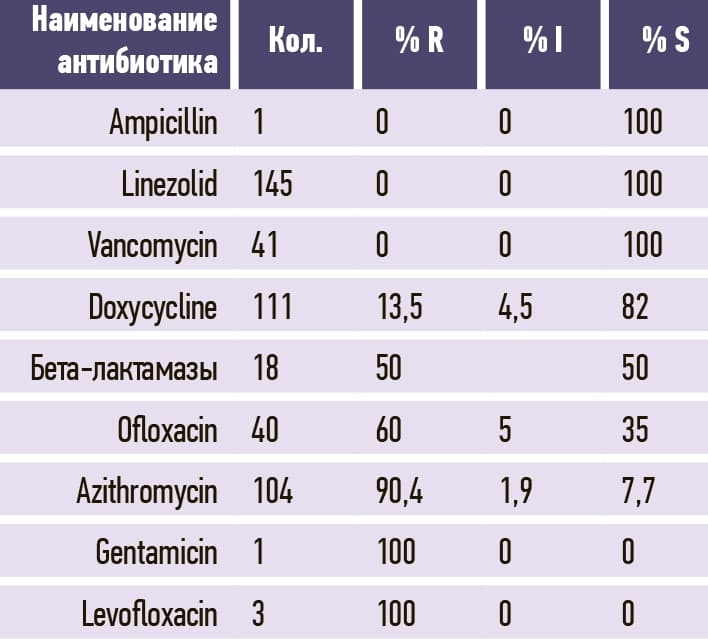
Таблица 10. Proteus mirabilis.
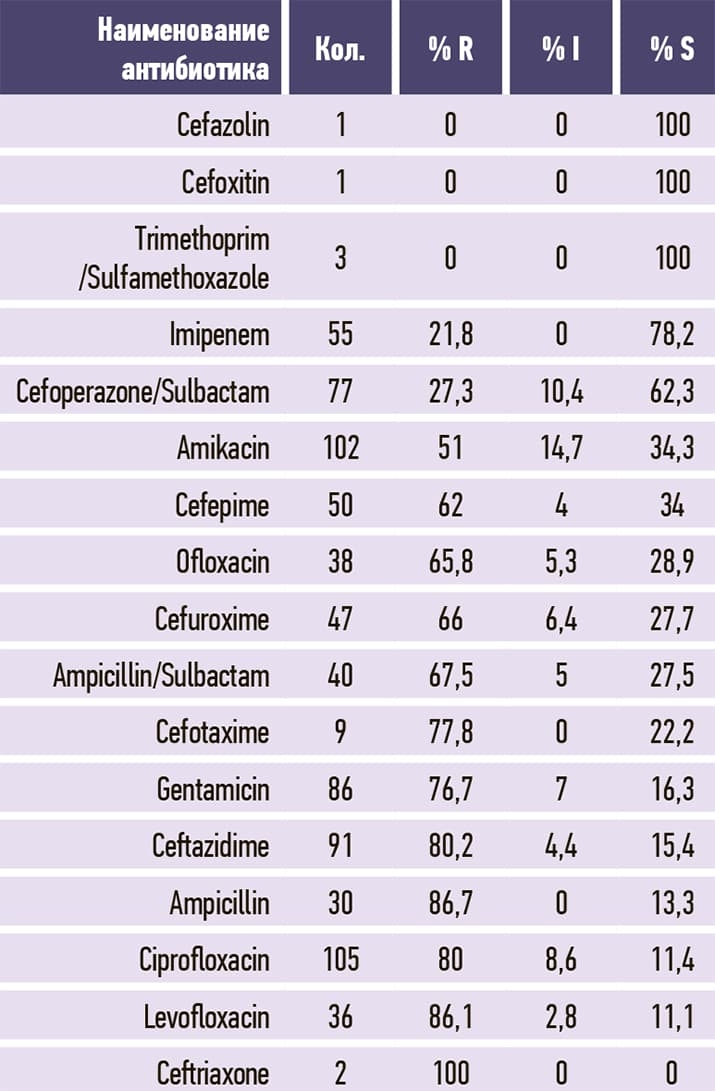
Таблица 11. Streptococcus pneumoniae.
Выводы
1. Произошло незначительное увеличение потребления АБ резерва в связи с преимущественным лечением крайне тяжелых пациентов, в т. ч. с осложнениями инфекции SARS-CoV-2 в реанимационных отделениях ОКБ.
2. Микробиологический пейзаж Брестской ОКБ в сравнении с 2020 годом несколько изменился. Наиболее часто из биологического материала пациентов выделялись Klebsiella pneumoniae, Acinetobacter baumannii и Proteus mirabilis (584, 426, 246 изолятов и, соответственно, 28,1 %, 20,5 %, 11,8 3%) среди клинически значимых микроорганизмов. Среди грамположительных микроорганизмов уменьшилась распространенность Staphylococcus aureus и Enterococcus faecium с небольшим ростом Enterococcus faecalis и незначительным — Streptococcus pneumoniae.
3. Распространенность MRSA (метициллин-резистентный золотистый стафилококк) — 44,7 %. Достоверность показателя MRSA высокая на основании регулярного использования маркера оксациллин бактериологической лабораторией в 100 % исследований.
4. Снижение частоты выделения микроорганизмов по WHONET обусловлено внедрением в клиническую практику мультиплексной ПЦР-диагностики генов антибиотикорезистентности.
5. В сравнении с 2020 годом:
- увеличилась DDD потребления лидера среди антибиотиков резерва меропенема, а также имипенема/циластатина, ампициллин/сульбактама; установлено незначительное увеличение тейкопланина, цефоперазона/ сульбактама, эртапенема;
- уменьшилась DDD потребления линезолида, ванкомицина, колистина, тигециклина, пиперациллин/тазобактама, дорипенема;
- на фоне снижения потребления колистина, тигециклина увеличилась резистентность «проблемных» грамотрицательных микроорганизмов к полимиксину В;
- в связи с внедрением мультиплексной и GeneXpert ПЦР-диагностики генов антибиотикорезистентности с целью эрадикации чрезвычайно резистентных штаммов Klebsiella pneumoniae впервые в клинической практике использовались цефтазидим/авибактам, двойная карбапенем-терапия с увеличением потребления эртапенема;
- даптомицин в 2021 году в клинической практике не использовался.
Результаты данного анализа были представлены на общеврачебной конференции и рассмотрены на заседании фармакотерапевтической комиссии. Внесены следующие предложения по совершенствованию системы инфекционного контроля:
- определить назначение антибактериальных ЛС «глубокого» резерва (тигециклин, колистин, эртапенем) консилиумом с обязательным участием заместителя главного врача по медицинской части или врача — клинического фармаколога, в т. ч. в отделениях интенсивной терапии и реанимации;
- пациентам с генами антибиотикорезистентности штаммов Klebsiella pneumoniae использовать консилиумом приоритетно двойную карбапенем-терапию как наиболее рациональную схему эрадикации чрезвычайно резистентных микроорганизмов;
- заместителям главного врача в курируемых отделениях усилить контроль к назначению антибиотика резерва меропенема.
По этим предложениям с учетом фармакоэкономических исследований принят ряд эффективных управленческих решений. Решением коллегии ГУЗО Брестского облисполкома установлен целевой показатель для УЗ менее 10 DDD на 100 пролеченных пациентов по «лидирующему» антибиотику резерва на 2023 год, а в УЗ с показателями более 20 DDD на 100 пролеченных пациентов по «лидирующему» антибиотику резерва — «допандемийный» уровень (2019) как промежуточный показатель.
Заключение
DDD-анализ — один из действенных инструментов управления антимикробной терапией. NDDD антибиотиков резерва на 100 пролеченных пациентов — это напряженный показатель, отражающий степень выраженности антибиотикорезистентности не только АБ-резерва, но и используемых базовых АБ и эпидемиологического неблагополучия, требующий от специалистов здравоохранения ежедневной работы со сложными пациентами с принятием многофункциональных непростых клинических решений, в т. ч. по сохранению чувствительности микроорганизмов к АБ.
