Пандемия коронавирусной инфекции в какой-то период сдает позиции, но не уходит совсем, проявляясь в новых формах в разных регионах мира, оставляя за собой разнообразные последствия для здоровья переболевших. Евразийская ассоциация терапевтов не так давно провела семь международных вебинаров, посвященных теме «COVID-19: суммация данных двух лет», в том числе вебинар на тему «Коронавирусная инфекция у больных гастроэнтерологического профиля». Доцент кафедры внутренних болезней, клинической фармакологии и нефрологии Северо-Западного госмедуниверситета им. И. И. Мечникова (Россия), кандидат мед. наук Ольга Соловьева свою лекцию посвятила проблемам лечения и профилактики антибиотикоассоциированной диареи при COVID-19.
Частота симптоматики
 COVID-19 часто сопровождается гастроинтестинальными симптомами. Многими исследованиями подтверждается, что такая симптоматика, в частности диарейный синдром, может быть первым признаком инфекции SARS-CоV-2 у 48,5–60 % пациентов с COVID-19. По данным некоторых исследований, синдром даже может быть единственным проявлением заболевания в 10–12 % случаев.
COVID-19 часто сопровождается гастроинтестинальными симптомами. Многими исследованиями подтверждается, что такая симптоматика, в частности диарейный синдром, может быть первым признаком инфекции SARS-CоV-2 у 48,5–60 % пациентов с COVID-19. По данным некоторых исследований, синдром даже может быть единственным проявлением заболевания в 10–12 % случаев.
Вирус SARS-CоV-2 из кишечника выделяется намного дольше, чем из верхних дыхательных путей. Вроде бы уже завершились все клинические проявления со стороны дыхательной системы, пациент выздоравливает, но вирус еще долго может выделяться с фекалиями.
Нежелательные лекарственные реакции
Препараты, рекомендованные для лечения коронавирусной инфекции, способны вызывать нежелательные явления со стороны ЖКТ, в частности в виде диарейного синдрома. Например, частота диареи при применении ритонавира/лопинавира достигает 24 %. Описано возникновение диареи как нежелательного явления при применении хлорохина и гидроксихлорохина как в виде монотерапии, так и в комбинации с азитромицином.
Хорошо известно, что причина 25 % случаев лекарственно-индуцированной диареи (ЛИД) — это антибактериальные препараты. Причем любой такой препарат может быть причиной ЛИД: карбапенемы, цефалоспорины и другие.
Но возникает вопрос: как связаны антибактериальные препараты и COVID-19, ведь это вирусная инфекция? Когда назначение антибиотиков обоснованно?
Во-первых, когда есть признаки бактериальной инфекции — либо это коинфекция, либо вторичная инфекция. Согласно данным метаанализа — 24 исследования, 3 338 пациентов, бактериальная коинфекция наблюдалась у 3,5 % пациентов, вторичная бактериальная инфекция — у 14,3 %. Наиболее часто бактериальная инфекция диагностируется у пациентов в отделениях реанимации и интенсивной терапии. Но по данным тех же метаанализов, 71,9 % пациентов с коронавирусом получали АБТ! Естественно, возникало много побочных эффектов, в том числе со стороны ЖКТ, часть из них в виде антибиотикоассоциированной диареи (ААД).
Первый вопрос, который мы должны задать пациенту с диареей, — не получал ли он антибактериальные препараты по любому поводу на протяжении ближайших к началу диареи 8 недель. Если человек отвечает «да», то первое, о чем мы думаем: «Возможно, это антибиотикоассоциированная диарея».
По данным китайских исследований, у госпитализированных пациентов с COVID-19, получавших затем антибиотики, диарея отмечалась в 18,9 % случаев, у тех, кто ее не получал, — в 1,1%.
Причины развития ААД, СИБР
Эти причины принято делить на две большие группы.
Первая из них — неинфекционные причины, по сути, результат взаимодействия антибактериального препарата либо одного из его компонентов с кишечной стенкой. Это либо прямое действие на рецепторы мотилина, стимуляция моторики ЖКТ (эритромицин, цефтриаксон), либо прямое повреждающее действие на слизистую оболочку кишечника (тетрациклин, неомицин), либо стимуляция моторики ЖКТ (клавулановая кислота и ее метаболиты). Диагностические приемы здесь очень простые: когда отменяется препарат, диарея очень быстро уходит. Как правило, это дозозависимые эффекты.
Выделяют еще большую группу инфекционных причин. К ним относится синдром избыточного бактериального роста (СИБР), диарея, связанная с ростом Clostridium perfringens, Staphylococcus aureus, Klebsiella oxytoca, Candida spp. и Salmonella spp. И, конечно же, это C. difficile-ассоциированная диарея.
Немного больше нужно сказать о СИБР, который встречается гораздо чаще, чем клостридиальная инфекция. Это клинический синдром, характеризующийся значительным увеличением количества бактерий в тонкой кишке и проявляющийся симптомами со стороны ЖКТ: нарушение стула, диарейный синдром, вздутие, абдоминальный болевой синдром и др.
Рекомендации Американской коллегии гастроэнтерологов по ведению пациентов с СИБР были изданы в 2020 году. Основные принципы лечения: воздействие на причину (лечение ассоциированного заболевания, отмена антимикробных препаратов и т. д.); диета с ограничением ферментируемых продуктов (углеводов), алкоголя, подсластителей, инулина; антибактериальные препараты согласно рекомендациям; пробиотики; заместительная терапия (ферменты, витамины и др.); адсорбенты.
Справедливости ради надо сказать, что в рекомендациях для каждого пункта отмечен достаточно низкий уровень доказательности, в т. ч. для антибактериальных препаратов.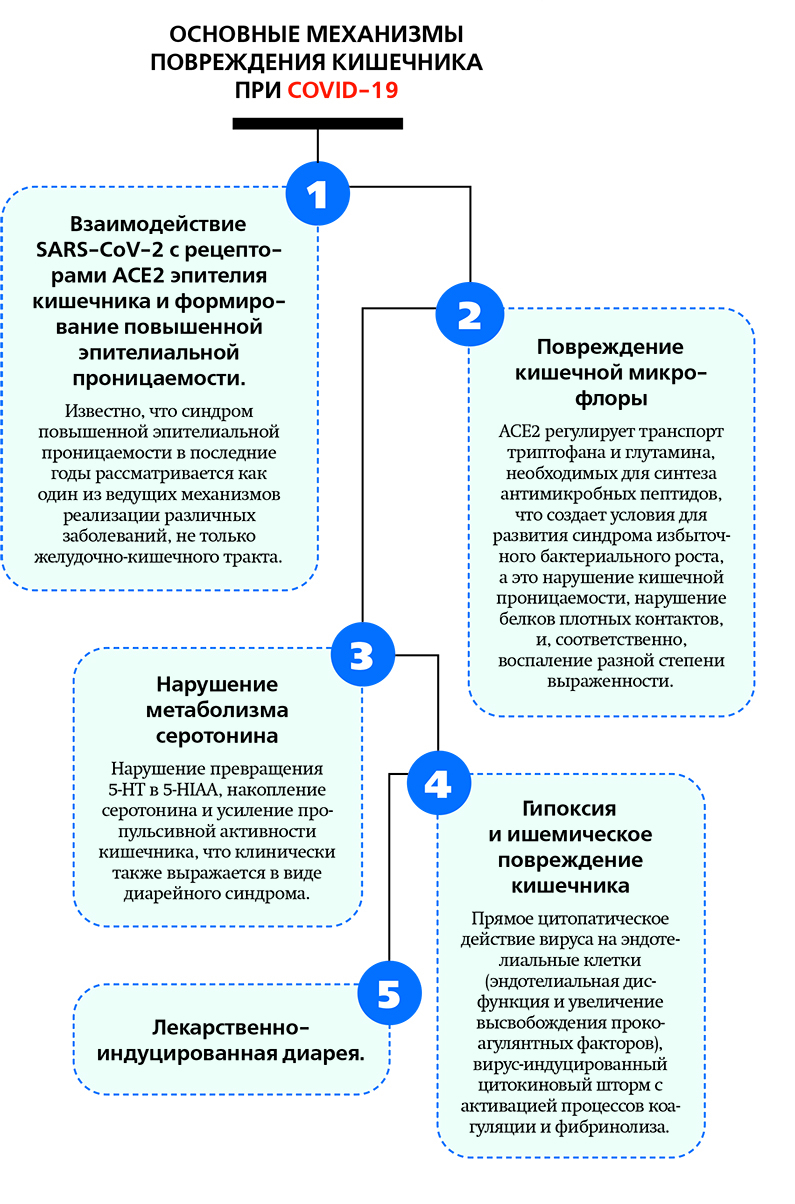
C. difficile-ассоциированная диарея
Представляет собой большую опасность. Этиологический фактор этого вида диареи — Clostridium difficile — облигатно-анаэробная грамположительная, спорообразующая, цитотоксинопродуцирующая бацилла.
По данным CDC (Центров по контролю и профилактике заболеваний США), CDI открывает список инфекций, для которых необходимо срочно создавать какой-то способ лечения, настолько она значима и опасна. Основные факторы патогенности C. difficile хорошо известны: токсин А (энтеротоксин), токсин В (цитотоксин), бинарный токсин (риботип NAP1/BI/027).
Было проведено популяционное исследование (American Journal of Infection Control, 2021 May), которое показало, что C. difficile в эпоху COVID-19 встречается существенно реже. Уменьшение заболеваемости CDI в госпитале Сант-Андреа (Рим, Италия) в пандемию COVID-19 указывает на важную роль санитарно-эпидемиологических факторов в развитии инфекции. Это правильно, если мы говорим о популяции в целом, тем не менее было показано, что заболеваемость CDI в отделениях, оказывающих помощь пациентам с COVID-19, выше, чем в «чистых» отделениях (предположительно сказывается повреждающее действие SARS-CоV-2 на кишечную микрофлору).
Подтверждения этим фактам приведены и в других публикациях, в частности, польские коллеги в декабре 2020 года (Polish Archives of Internal Medicine) привели данные о том, что частота выявления клостридиальной инфекции существенно превышает частоту выявления той же инфекции у пациентов в «доковидные» времена (CDI выявлена в 10,9 % случаев versus 2,6 %, Р <0,001).
Сведения итальянских исследователей не показали большой разницы, но, опять же, это популяционные данные. По информации из восьми крупных больниц, помогавших пациентам с COVID-19 с февраля до июля 2020 года (4 802 пациента, из них 38 — с CDI), заболеваемость CDI находилась в пределах «доковидных» цифр для Италии и Европы. Были выявлены предикторы развития клостридиальной инфекции у больных с SARS-CоV-2. Это сердечно-сосудистые заболевания, иммунодефицит, госпитализации в два предыдущих месяца, прием антибактериальных препаратов в такое же время, использование ингибиторов протонной помпы, стероиды, антибиотики. Все эти выводы основаны на большом уровне доказательности исследования.
C. difficile-ассоциированное поражение кишечника может протекать у пациентов с COVID-19 практически так же, как у пациентов без этого заболевания. Это может быть бессимптомное носительство (оно есть у 15 % здоровой популяции), диарея без колита, колит без псевдомембран, псевдомембранозный колит и крайне тяжелое проявление — фульминантный колит, который, к сожалению, может заканчиваться летально либо вынуждает прибегать к оперативному вмешательству.
Показательные клинические случаи
В Испании пациентка 64 лет находилась в стационаре в течение месяца по поводу COVID-19 с двусторонней пневмонией, через 10 дней после выписки у нее был диагностирован тяжелый колит, вызванный C. difficile, медики выполнили колэктомию.
Были и российские публикации, но их не так много. Одна из них появилась в журнале «Клиническая медицина» в 2021 году. Самарские авторы опубликовали историю 74-летней пациентки, которая перенесла коронавирусную инфекцию, внебольничную двустороннюю полисегментарную пневмонию. У нее также был СД 2-го типа (впервые выявленный), гипертоническая болезнь 2-й степени, язвенная болезнь желудка (впервые выявленная). Наблюдались желудочное кровотечение до госпитализации с рецидивом через 11 дней, постгеморрагическая анемия средней степени тяжести, гастродуоденит, вторичный иммунодефицит.
Женщина была госпитализирована с 15 сентября по 7 октября 2020 года, получала гидроксихлорохин, олокизумаб, азитромицин, дексаметазон, ампициллин+сульбактам, левофлоксацин, фрагмин, омепразол. Пациентка была выписана из стационара в удовлетворительном состоянии, практически без жалоб.
Через неделю вновь появились слабость, диарейный синдром, боли в животе, женщина обратилась к гастроэнтерологу, ей назначили метронидазол, нольпазу. 28 ноября пациентка в тяжелом состоянии (боли в животе, стул до 10 раз в сутки, слабость, одышка, тахикардия, задержка мочи) была госпитализирована. При обследовании у нее выявили полисерозит, инфицированный асцит, признаки миокардита. К сожалению, на пятые сутки пациентка погибла. При вскрытии обнаружен псевдомембранозный панколит. Осложнения — острая почечная недостаточность, двусторонний гидроторакс, спонтанный бактериальный перитонит. Сочетанное заболевание — вторичный миокардит. Кроме того, париетальный тромбоэндокардит.
Современные особенности CDI
В 2021 году были опубликованы рекомендации Американской коллегии гастроэнтерологов по ведению клостридиальной инфекции. Есть в них несколько моментов, о которых следует сказать особо. Это то, что колонизация C. difficile (обнаружение микроорганизма в отсутствие симптомов) выявляется у 4–15 % здоровых, до 21 % госпитализированных взрослых, у 15–30 % тех, кто проживает в учреждениях длительного ухода. Колонизация Clostridium difficile на момент поступления в стационар шестикратно увеличивает риск развития CDI. Большую обеспокоенность вызывает факт роста случаев внебольничной CDI (35–48 %). Факторы риска: АБТ, наличие кардиологической патологии, хроническая болезнь почек и воспалительные заболевания кишечника.
Диагностика и терапия CDI
Особых изменений в алгоритме диагностки CDI в последних рекомендациях не появилось. Это двухшаговая диагностика: сначала определяем наличие глутаматдегидрогеназы, то есть клостридий, затем, если тест позитивный, типируем по наличию токсинов А и В. Если тест отрицательный — анализируем, пытаемся исключить возможность того, что этот тест ложно-негативный. Если тест положительный, то, разумеется, приступаем к лечению.
В этих последних рекомендациях также отмечено: поскольку нет идеального теста для детекции C. difficile, решение о диагнозе и лечении принимается на основе клинических данных. Не следует отказываться от лечения только на основании лабораторных исследований.
Препаратов для лечения CDI немного. Это ванкомицин перорально, фидаксомицин (которого в России нет). В тяжелых случаях, если есть признаки кишечной непроходимости, пероральный прием ванкомицина может сочетаться с введением per rectum. Это также метронидазол, который может назначаться в легких случаях клостридиальной инфекции (внутривенно — в тяжелых, особенно при острой кишечной непроходимости), но в американских рекомендациях написано, что метронидазол может применяться только в тех случаях, когда нет возможности назначить другой препарат. Предлагается рассмотреть возможность фекалотрансплатации у пациентов с тяжелой и фульминантной формами CDI, резистентных к терапии антибиотиками, в частности, при высоком риске оперативного вмешательства.
Терапию рецидивов клостридиальной инфекции предлагается проводить с помощью тех же препаратов. Хочу напомнить, что каждый рецидив повышает риск развития следующего рецидива, который может протекать тяжелее. Поэтому так важно, чтобы пациент выдерживал дозы и длительность терапии.
При нетяжелых формах заболевания пациент начинает принимать препараты, ему быстро становится лучше, и человек прекращает прием лекарств, а это ведет к появлению устойчивости у Clostridium difficile.
Разрабатываются новые варианты терапии, но пока, к сожалению, они для нас недоступны. Например, за рубежом проводится пассивная иммунизация с помощью антител к токсинам А и В. Для нас же в полный рост встает вопрос профилактики ААД, в том числе при COVID-19, и с этой целью мы можем использовать пробиотические препараты, например, для некоторых штаммов — бифидобактерии.
Практически во всех рекомендациях, которые касаются ведения пациентов с антибиотикоассоциированной диареей, ее предупреждения, рассматриваются Saccharomyces boulardii. По сути, S. boulardii напрямую воздействуют на C. difficile, ингибируют связывание токсина А с клетками-мишенями за счет высвобождения протеазы, расщепляющей эзотоксин и место его связывания. S. boulardii не позволяют развиться воспалительному процессу.
Как долго нужно применять пробиотические препараты? И в рекомендациях Российской гастроэнтерологической ассоциации, и в рекомендациях Британского общества гастроэнтерологов, вышедших в 2021 году, говорится о том, что нужно рассматривать длительность назначения пробиотиков до 12 недель.
Выводы
1. Инфекция SARS-CоV-2 сопровождается выраженными изменениями в микробиоценозе.
2. У пациентов на фоне COVID-19 и после выздоровления могут развиваться ААД и клостридиальный колит. Необходимы мониторинг и информирование больных.
3. Пробиотики вместе с антибиотиками — профилактика ААД.
В общем, рациональная антибиотикотерапия (по показаниям, макси-мально возможными короткими курсами) — основа профилактики ААД при COVID-19.