При использовании всего спектра достижений системной полихимиотерапии, хирургии, лучевой терапии и сопроводительного лечения в нашей стране, как и за рубежом, удается избавить от заболевания 60–70% пациентов детского возраста с саркомами опорно-двигательного аппарата. Для 3–4 детей из 10 (как правило, с запущенными процессами и рецидивами) болезнь становится фатальной. Такая ситуация сохраняется на протяжении десятилетий.
Актуальным остается вопрос: какая опухоль успешно ответит на специальное лечение, а для какой необходима интенсификация терапии и поиск новых подходов? Ведь клинические проявления и морфологическая картина во многих случаях очень схожи. В этой связи основные усилия современных ученых и практиков направлены на поиск возможностей «расшифровки» генетического опухолевого кода. Молекулярно-биологические характеристики опухоли могут быть эффективно использованы для более точного прогнозирования клинического исхода заболевания, посттерапевтического мониторинга качества ремиссии, а также генетически направленной терапии.
Рабдомиосаркома у детей
 Леонид КиселевНаиболее часто встречающаяся опухоль мягких тканей у детей, которая представляет собой высокоагрессивное, быстрорастущее злокачественное новообразование, развивающееся из недифференцированных мезенхимальных клеток. Существует несколько гистологических подтипов рабдомиосаркомы (РМС) с различными подходами к лечению и прогнозом: эмбриональная, альвеолярная, плеоморфная и веретеновидная.
Леонид КиселевНаиболее часто встречающаяся опухоль мягких тканей у детей, которая представляет собой высокоагрессивное, быстрорастущее злокачественное новообразование, развивающееся из недифференцированных мезенхимальных клеток. Существует несколько гистологических подтипов рабдомиосаркомы (РМС) с различными подходами к лечению и прогнозом: эмбриональная, альвеолярная, плеоморфная и веретеновидная.
Эмбриональный подтип РМС является наиболее распространенным, на него приходится около 60 % всех случаев. Диагностируется обычно у детей младше 5 лет, локализуется в основном в области головы, шеи и мочеполовых органов. представляет собой гиперклеточную опухоль из типичных рабдомиобластов, расположенных в виде листов и больших гнезд внутри миксоидного матрикса. Клеточные элементы опухоли данного подтипа имеют вытянутую веретеновидную или звездчатую форму.
Альвеолярная РМС проявляется в возрасте 10–25 лет, как правило, в области туловища и конечностей. Гистологическая характеристика отличается фиброзным характером стромы, образующей альвеолярные и псевдоальвеолярные структуры, выстланные опухолевыми клетками, которые в большей степени имеют округлую форму, часто встречаются клеточные элементы с гиперхромными ядрами и признаками повреждения ядра.
Веретеноклеточная РМС — сравнительно недавно описанный подтип. Опухоль локализуется преимущественно в области головы и шеи, а также конечностей. Может возникать в виде безболезненных опухолевых масс или проявлять симптомы из-за сдавления других органов и тканей. Состоит в основном из пучков веретеновидных клеток.
Отдельно выделяемый подтип плеоморфной РМС встречается довольно редко и описывается, как правило, у взрослых. Состоит из полигональных, круглых и веретенообразных клеток. Обычно локализуется в глубоких мягких тканях нижних конечностей, но известно и о иных локализациях. У большинства пациентов наблюдается быстро нарастающая болезненная припухлость. Размер данной опухоли в диапазоне 5–15 см, новообразование хорошо очерчено, часто окружено псевдокапсулой.
Патологическое подтверждение РМС бывает затруднено из-за сходства данного новообразования с другими мелкокруглоклеточными опухолями костей и мягких тканей у детей. Для точного подтверждения диагноза РМС необходимы разработанные стандартные иммуногистохимические, генетические, ультраструктурные методы. Сегодня активно исследуется расширенный спектр молекулярно-биологических характеристик для прогнозирования клинических исходов заболевания и возможностей индивидуализации терапевтического плана.
Молекулярно-генетические исследования у детей с РМС
Традиционно на базе РНПЦ ДОГИ выполнялся поиск следующего перечня генов, ассоциированных с РМС:
- рецепторы инсулиноподобного фактора роста (IGF). Белок IGF кодируют гены IGF1R и IGF2R, высокий уровень экспрессии которых обеспечивает важнейшее свойство опухолевых клеток — независимый рост и деление;
- рецепторы эпидермального фактора роста (EGF). Принимают участие в регуляции клеточного роста и дифференцировки. Белок EGF кодируют гены EGFR1 и EGFR2, высокий уровень экспрессии которых ассоциирован с опухолевой прогрессией;
- TP53, опухолевый супрессор, который активируется при повреждении ДНК;
- белково-мембранный комплекс Ezrin, может выступать в качестве маркера метастатического потенциала при РМС, кодируется геном EZR;
- семейство глютатион-S-трансфераз. Гены MGST1 и сравнительно недавно открытый GSTM4 характеризуются влиянием на механизмы химиорезистентности при злокачественных новообразованиях. Экспрессия этих генов ассоциируется с резистентностью в первую очередь к доксорубицину — компоненту системной терапии рабдомиосарком.
Большинство часто встречаемых мутаций в генах, ассоциированных с РМС, являются мишенями и позволяют осуществлять контроль проводимого лечения, прогнозировать раннее выявление рецидивов и, следовательно, осуществлять своевременное их предотвращение.
Однако около 40–50% пациентов с РМС не имеют рекуррентных мутаций, что создает трудности в прогнозировании и терапии.
Новая расширенная генетическая панель
Разработка и внедрение метода высокопроизводительного секвенирования (секвенирования нового поколения, NGS) позволяет значительно расширить перечень генов, мутации которых участвуют в патогенезе РМС и могут выступать в качестве мишеней для таргетной терапии.
На основании обзора литературных данных на базе РНПЦ ДОГИ была подобрана и применена на опухолевом материале пациентов детского возраста максимально подходящая панель генов (TruSight™️ Tumor 170 powered by SOPHiA™️); при подборе учитывались роль гена в патогенезе РМС, частота встречаемости мутаций при РМС у детей, прогностическое значение для пациентов с РМС.
В панель вошли 170 генов, которые условно делятся на 3 группы:
- однонуклеотидные замены, короткие инсерции и делеции — 153 гена;
- амплификация (увеличение количества копий гена) — 152 гена;
- перестройки генов — 55 генов.
Целью максимально точной характеристики молекулярного патогенеза опухолей мягких тканей является эффективная селекция. Во-первых, выявление случаев с агрессивным поведением новообразования для использования максимально интенсивных терапевтических подходов. Во-вторых, выделение когорт пациентов, которым показано менее интенсивное (и менее токсичное) лечение без ущерба онкологической безопасности.
Клинический случай новой (ранее не описанной при рабдомиосаркомах) транслокации, установленной методом NGS в материале опухоли у педиатрического пациента с альвеолярной рабдомиосаркомой.
В возрасте 3-х лет у Л. мама заметила невыраженный экзофтальм. Девочка была осмотрена офтальмологом и госпитализирована в областную больницу, проконсультирована неврологом, офтальмологом и нейрохирургом. На момент осмотра у пациентки отсутствовали болевой синдром, признаки очаговой симптоматики.
По результатам КТ головного мозга выявлено образование в височной доле, выполнена его биопсия на базе РНПЦ неврологии и нейрохирургии, после чего пациентка была переведена в РНПЦ ДОГИ для дальнейшей диагностики и лечения.
На момент поступления в биохимическом анализе крови инициальный уровень ЛДГ — 866. В пунктате костного мозга атипичные клетки не выявлены. В ликворе: белок 0,21 г/л, цитоз 2,67×109/л, эритроциты — 2–5, лимфоциты — 12, нейтрофилы — 1, моноциты — 4, эозинофилы — 2. При осмотре офтальмологом выявлены начальные проявления застоя диска зрительного нерва на стороне поражения.
По данным сцинтиграфии с Тс99 выявлен участок патологического накопления радиофармпрепарата в проекции костей лицевого черепа, наружной стенки орбиты, подвисочной ямки слева до 230%.
Пациентке проведена МРТ головного мозга. По результатам МРТ-визуализации в области верхнелатеральной стенки левой глазницы определяется объемное образование с интраорбитальным (31×18×23 мм) и интракраниальным (43×21×38 мм) распространением неоднородной структуры в верхних отделах за счет локального жирового вкрапления. Отмечается небольшой экстракраниальный компонент 10×5 мм, параоссальные мягкие ткани левой височной области не резко утолщены, с изменением сигнала на T2 импульсной последовательности, копящие контрастное вещество. Опухоль оказывает масс-эффект на прилежащие височную и лобную доли головного мозга (см. рис. 1).
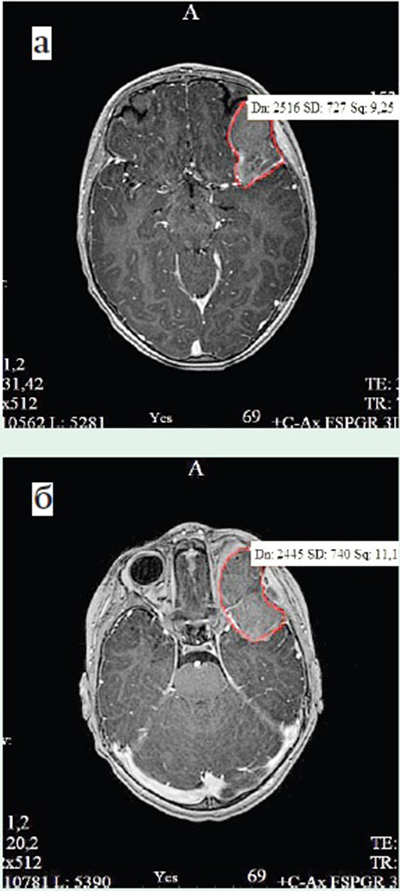 Рисунок 1. Магнитно-резонансная томограмма головного мозга: а) Т2-взвешенное изображение TSE, аксиальная проекция; б) режим FSPGR 3D с контрастным усилением, аксиальная проекция, опухоль мягких тканей глазницы с интракраниальным компонентом с четким краем, умеренно копящая контрастное вещество.
Рисунок 1. Магнитно-резонансная томограмма головного мозга: а) Т2-взвешенное изображение TSE, аксиальная проекция; б) режим FSPGR 3D с контрастным усилением, аксиальная проекция, опухоль мягких тканей глазницы с интракраниальным компонентом с четким краем, умеренно копящая контрастное вещество.
При нативном КТ-исследовании в левой глазнице определяется объемное образование, широким основанием прилежащее к костным структурам на данном уровне с местнодеструирующим ростом. Опухоль гиперденсивная (+47...+55 HU) по отношению к мозговой ткани, с четкими неровными наружными контурами. Костные структуры (левая скуловая, большое крыло клиновидной кости и глазничная часть лобной кости слева) неоднородной структуры за счет деструкции и линейной периостальной реакции. Верхние яремные лимфатические узлы слева до 12×7 мм. При КТ-исследовании органов грудной полости данных о наличии интрапульмонального метастазирования не получено.
Выполнена открытая биопсия новообразования. По результатам гистологического исследования биопсийного материала выявлена злокачественная низкодифференцированная опухоль с очагово-солидным типом роста.
Сосудистая сеть представлена многочисленными сосудами синусоидного типа, признаки классической сосудистой пролиферации отсутствовали. Очаги некроза отсутствовали. Опухолевые клетки преимущественно являлись мономорфными, округлыми, с крупным округлым ядром с диспергированным хроматином без ядрышек и очень тонким ободком цитоплазмы. Встречались единичные гигантские клетки типа симпластов (см. рис. 2). Установлена высокая пролиферативная активность — до 8–9 митозов на HPF.
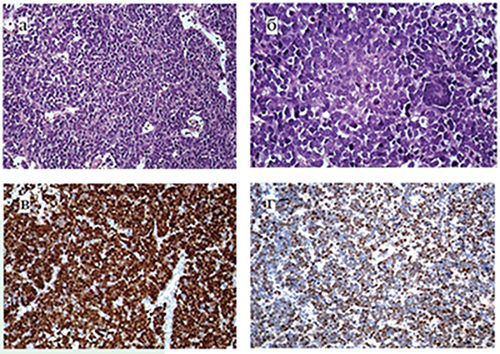 Рисунок 2. Диагностическое гистологическое исследование опухолевой ткани: а) солидные пласты низкодифференцированных клеток, разделенные сосудами синусоидного типа (×100, гематоксилин-эозин); б) среди опухолевых клеток встречаются многоядерные симпласты, частые фигуры митозов (×400, гематоксилин-эозин); в) позитивное ядерное окрашивание в 100 % опухолевых клеток (×200, иммуногистохимическое окрашивание с антителом к Myogenin); г) позитивное ядерное окрашивание в 85 % опухолевых клеток (×200, иммуногистохимическое окрашивание с антителом к Olig2).
Рисунок 2. Диагностическое гистологическое исследование опухолевой ткани: а) солидные пласты низкодифференцированных клеток, разделенные сосудами синусоидного типа (×100, гематоксилин-эозин); б) среди опухолевых клеток встречаются многоядерные симпласты, частые фигуры митозов (×400, гематоксилин-эозин); в) позитивное ядерное окрашивание в 100 % опухолевых клеток (×200, иммуногистохимическое окрашивание с антителом к Myogenin); г) позитивное ядерное окрашивание в 85 % опухолевых клеток (×200, иммуногистохимическое окрашивание с антителом к Olig2).
При проведении иммуногистохимического исследования с широким спектром антител в опухолевых клетках определялась экспрессия LIN28a, Desmin, Synaptophysin, WT1, Myogenin, CCNB3 и Olig2. При этом экспрессия Myogenin носила диффузный характер. Экспрессия GFAP, CD99, Bcl2, S100, LCA, EMA, PanCK, Oct4 и HMB45 отсутствовала, ядерная экспрессия INI1 была сохранена. Примечательно, что опухолевые клетки экспрессировали антигены Olig2 и Synaptophysin, характерные для нейроэпителиальных опухолей головного мозга.
При проведении ПЦР-исследования транскрипты PAX3-FKHR, PAX7-FKHR, SYT-SSX не выявлялись.
По данным первичного диагностического комплекса выставлен диагноз: альвеолярная рабдомиосаркома области верхнелатеральных стенок левой глазницы с интраорбитальным и интракраниальным распространением, местнодеструирующим ростом, масс-эффектом на прилежащие отделы головного мозга с поражением верхнеяремного лимфоузла слева рT3bN1M0 (согласно TNM-классификации 2017 года), 3-я стадия; T4bN1M0, без установления стадии согласно 8 изданию TNM классификации AJCC (American Joint Committee on Cancer). Группа очень высокого риска (на основании гистологического варианта согласно протоколу RMS-2005).
Пациентке выбрана тактика использования системной терапии согласно протоколу RMS-2005 с применением доксорубицина. После 4 блоков полихимиотерапии (IVADo: ифосфамид, винкристин, актиномицин, доксорубицин) зафиксирована регрессия интраорбитального компонента до 24×3×15 мм (регрессия на 52 %). Интракраниальный компонент достоверно не определялся.
Выполнена орбитотомия с целью тотального удаления опухоли в объеме R 0-1 (край отсечения — костная стенка). Гистологическое исследование показало полный патоморфоз (4-я степень по Huvos) опухоли.
Продолжена полихимиотерапия согласно протоколу RMS-2005 (5 блоков IVA). Учитывая неблагоприятный морфологический вариант опухоли, принято решение о проведении 6 блоков IVA и дистанционной лучевой терапии на место первичной локализации опухоли и периферические лимфоузлы (СОД 50 Gr). В качестве завершающего этапа терапии пациентка получила 6 блоков поддерживающей химиотерапии (VNL + CPM). В настоящий момент спустя 9 месяцев пациентка находится в ремиссии.
Обсуждение случая
Для получения NGS-данных было применено секвенирование таргетной панели онкогенов в образцах биопсийного материала рабдомиосаркомы. Из полученных образцов ДНК и РНК приготовлены библиотеки с применением наборов реагентов TruSight™ Tumor 170. На основе анализа данных высокопроизводительного секвенирования были осуществлены поиск и аннотация однонуклеотидных вариантов, коротких инсерций/делеций и перестроек в геноме опухолей. В результате проведенного анализа были обнаружены полиморфизмы в генах, имеющих высокую частоту встречаемости в популяции и не являющихся патогенными. Также было зафиксировано увеличение числа копий гена KRAS.
Диагностически значимые транслокации PAX3-FOXO1 или PAX7-FOXO1 отсутствовали, но была обнаружена ранее не описанная транслокация NSD1-FGFR4.
Для контроля найденных вариантов в опухолевой ткани пациента был проанализирован образец здоровой ткани (периферическая кровь). Транслокация NSD1-FGFR4 в здоровой ткани не выявлена.
Для оценки значимости обнаруженной нами транслокации были проанализированы актуальные данные литературы. Нам не удалось найти ни одной публикации, где указывалось бы на наличие транскрипта NSD1-FGFR4 в ткани альвеолярной рабдомиосаркомы. Однако данный транскрипт был описан в ткани немелкоклеточного рака легкого, что свидетельствует о наличии онкогенного потенциала у генов-партнеров и позволяет предположить, что NSD1-FGFR4 является патогенной драйверной молекулярной поломкой.
Приведенный клинический случай представляет интерес вследствие установления новых генетических нарушений у пациентов детского возраста с РМС. В настоящий момент девочка находится в ремиссии по основному заболеванию, и мы рассчитываем, что обнаруженная новая для РМС молекулярная транслокация NSD1-FGFR4 ассоциирована с благоприятным клиническим исходом.
