По данным ВОЗ, ежегодно в мире рождается 4 млн детей в асфиксии, 1 млн — в последующем имеют стойкие нервно-психические отклонения. При тяжелых формах гипоксического повреждения головного мозга летальность превышает 50 %, половина детей погибает в первый месяц. Часть детей с тяжелыми неврологическими нарушениями погибают в младенчестве в основном от сопутствующих инфекций. На сегодняшний день нет ни одного препарата, который может с 100 % эффективностью прервать каскад разрушающих нейроны процессов, вызывающих их гибель и неврологический дефицит. Перспективной методикой, позволяющей снизить неблагоприятные последствия перенесенной асфиксии при рождении, является терапевтическая гипотермия.
История вопроса
Первое упоминание о применении гипотермии у новорожденного относится к 1697 году, когда французский врач Бернар де Гордон опустил в бадью с ледяной водой младенца, родившегося по современным представлениям в асфиксии. Ребенок выжил, получил имя в честь оживившего его доктора, а спасительное действие низких температур стало поводом для исследований.
 В 1954 году Марин Лакомм из Франции применила управляемую гипотермию в лечении 29 недоношенных детей. Ее опыт не имел положительного результата, однако помог другим ученым в постижении данного вопроса. В 1958 году Джеймс Миллер из Нового Орлеана провел исследование, включившее 10 новорожденных с оценкой по шкале Апгар 0–1 балл на первой минуте жизни. Он опускал новорожденных в ванну с ледяной водой (над поверхностью оставались нос, рот и пуповина ребенка), в которую вводились инфузионные растворы и препараты крови. Девять из 10 малышей выжили.
В 1954 году Марин Лакомм из Франции применила управляемую гипотермию в лечении 29 недоношенных детей. Ее опыт не имел положительного результата, однако помог другим ученым в постижении данного вопроса. В 1958 году Джеймс Миллер из Нового Орлеана провел исследование, включившее 10 новорожденных с оценкой по шкале Апгар 0–1 балл на первой минуте жизни. Он опускал новорожденных в ванну с ледяной водой (над поверхностью оставались нос, рот и пуповина ребенка), в которую вводились инфузионные растворы и препараты крови. Девять из 10 малышей выжили.
Ученые из СССР также пытались применить перспективную методику. В 1965 году был создан аппарат для гипотермии «Холод 2Ф», а в 1985-м модифицирована техника охлаждения — избирательное воздействие на голову холодной водой, циркулирующей по резиновым трубкам в шлеме. Однако методика не получила широкого распространения из-за часто возникавших тяжелых осложнений.
Новая стратегия — индуцированная гипотермия
Очередной виток исследований по применению гипотермии начался в 21-м веке. Благодаря техническому прогрессу и клинико-лабораторным возможностям появилась отдельная терапевтическая стратегия: умеренная аппаратная терапевтическая гипотермия (ТГ). Она подразумевает контролируемое индуцируемое снижение температуры тела пациента до 33–34 °С.
Метаанализ 11 рандомизированных контролируемых исследований, включавших в общей сложности 1 505 детей, подтвердил благотворное влияние ТГ на доношенных и поздних недоношенных детей с гипоксически-ишемической энцефалопатией (ГИЭ). Международный комитет по содействию в области реанимации (ILCOR) отнес ТГ к жизненно необходимым мероприятиям и внедрил ее в стандарты оказания неотложной помощи новорожденным. С 2015 года методика управляемой ТГ включена в обновленные руководства по сердечно-легочной реанимации Европейского и Американского обществ реаниматологов, а впоследствии и в национальные протоколы многих стран мира.
Повреждающее действие гипоксии на клетки
Наиболее уязвимым к повреждающему действию гипоксии является головной мозг, что объясняется интенсивностью метаболизма нейронов. Лишь несколько минут отделяют начало острой гипоксии от старта масштабной церебральной катастрофы. Острый период гипоксически-ишемического повреждения длится первые 6 часов. Основные патофизиологические механизмы, происходящие на этом этапе:
- глубокий метаболический дисбаланс;
- некроз — разрушение клетки с поступлением разрушенных фрагментов ядер, органелл и др. во внеклеточное пространство, привлечением в очаг повреждения макрофагов, вырабатывающих процитокины и цитокины;
- апоптоз — запрограммированная клеточная гибель, запускаемая острой церебральной гипоксией, объем клетки постепенно уменьшается, межклеточные контракты пропадают.
У новорожденных основной путь гибели нейронов — апоптоз. Происходит он двумя путями. В первом варианте активируется внутриклеточный фермент каспаза, а с ней — разрушительный каскад биохимических реакций. Второй механизм, специфичный именно для нервной ткани, — эксайтотоксичность — обозначает гибель нервных клеток под действием нейромедиаторов.
Как замедлить патогенетические механизмы?
К сожалению, остановить начавшийся процесс клеточного разрушения невозможно. Тем не менее можно попытаться уберечь еще жизнеспособные нейроны. Для этого в первую очередь нужно замедлить метаболизм: охлаждение головного мозга всего на 1 °С значительно снижает метаболические потребности клетки, замедляет прогрессирование метаболического дисбаланса и делает нейроны менее чувствительными к гипоксии. Кроме того, охлаждение противодействует накоплению макрофагов в очаге поражения, предотвращая выброс провоспалительных цитокинов и отек, способный усугубить ишемию.
По современным представлениям, ТГ блокирует экспрессию каспазы — самого главного белка, связанного с апоптозом. Хотя апоптоз стартует в остром периоде гипоксического повреждения мозга, клинические проявления несколько запаздывают и приходятся уже на следующий этап — подострый. Он начинается спустя 6 часов с момента гипоксии и длится несколько суток, максимально — до недели. Восстановление кровообращения после длительной ишемии сопровождается реперфузионным повреждением: происходит вторая волна гибели нейронов, по своей силе в десятки раз превышающая первую. Воздействуя на процессы, происходящие в остром периоде, ТГ уменьшает интенсивность вторичного повреждения.
Таким образом, ТГ блокирует большинство патофизиологических механизмов гипоксически-ишемического повреждения головного мозга и одновременно усиливает нейропротективные процессы (см. табл. 2).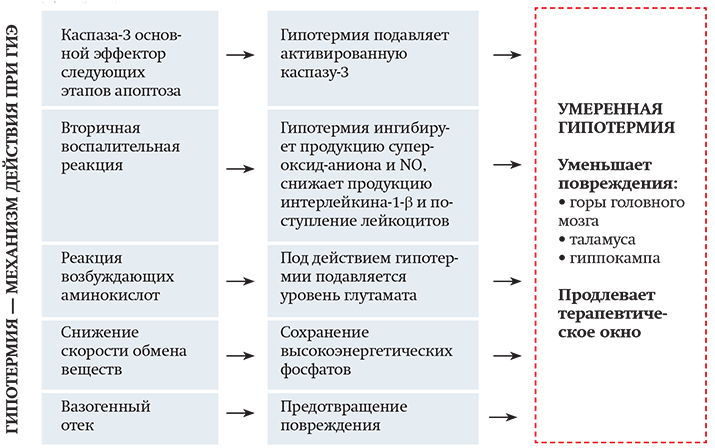 Терапевтическое окно, в течение которого должна быть начата гипотермия, составляет 6 часов: это тот самый «светлый» промежуток, после завершения которого прогрессирует вторичное повреждение головного мозга.
Терапевтическое окно, в течение которого должна быть начата гипотермия, составляет 6 часов: это тот самый «светлый» промежуток, после завершения которого прогрессирует вторичное повреждение головного мозга.
Белорусский опыт
С 2018 года в условиях отделения анестезиологии и реанимации новорожденных детей (ОАиРН) 5-й ГКБ Минска с использованием методики ТГ пролечено 10 новорожденных, родившихся в состоянии тяжелой асфиксии.
На факт наличия тяжелой интранатальной асфиксии указывали следующие анамнестические данные: разрыв матки, отслойка плаценты, тугое трехкратное обвитие пуповины вокруг шеи ребенка, рождение ребенка с помощью акушерских щипцов, антенатальное инфицирование и развитие синдрома фетального воспалительного ответа.
Критерии отбора для проведения ребенку ТГ определялись на основании регламентированных документов Российской ассоциации специалистов перинатальной медицины, центра неонатологии Вильнюса, европейских и американских рекомендаций и отражены в таблице (см. табл. 1).
Таблица 1. Критерии для проведения общей терапевтической гипотермии Общими критериями отбора на ТГ для новорожденных являлись: гестационный возраст более 35 недель и масса тела при рождении более 1 800 г. Далее новорожденные последовательно оценивались по трем группам критериев.
Общими критериями отбора на ТГ для новорожденных являлись: гестационный возраст более 35 недель и масса тела при рождении более 1 800 г. Далее новорожденные последовательно оценивались по трем группам критериев.
Результаты наблюдений показали максимальную эффективность ТГ при более раннем начале от момента рождения. Исходя из этого мы оценивали возможность включения ребенка в группу исследования на этапе первичной реанимации в течение первых 10 минут жизни. Это определяло аспекты первичного ухода за новорожденным и его транспортировки в отделение.
Стабилизация состояния в отделении реанимации
При поступлении в ОАиРН дети помещались в открытую реанимационную систему Babytherm 8004. Реанимация и стабилизация состояния проводились в соответствии с клиническими протоколами, утвержденными приказом Минздрава Республики Беларусь от 28.01.2011 № 81. Дети получали стандартную посиндромную терапию, гемодинамика поддерживалась с помощью волемических нагрузок, инотропных и вазопрессорных препаратов в различных комбинациях (дофамин, добутамин, адреналин, норадреналин). Гемодинамический мониторинг осуществлялся инвазивным и неинвазивным методами.
С 2021 года используем методику функциональной прикроватной эхокардиографии, которая также дает ценную информацию о состоянии гемодинамики и волемичского статуса. В течение часа повторно определялись критерии из групп А и В, у всех детей присутствовало как минимум по 2 критерия каждой группы.
Пациентам была проведена нейросонография (НСГ) с допплерометрией мозгового кровотока с целью исключения массивных внутричерепных кровоизлияний и оценки состояния церебральной гемодинамики. В связи с возможной технической задержкой для проведения и расшифровки ЭЭГ начинали нейромониторинг уже на фоне проведения ТГ. С родителями проводили подробную беседу, объясняли суть методики с целью максимально раннего получения информированного согласия на проведение манипуляций, в т. ч. ТГ.
Алгоритм индуцированного снижения температуры
Для достижения контролируемой гипотермии применяем аппарат Blancetrol III. Температуру тела новорожденных постепенно снижаем до 33,5 ± 0,5 °C и поддерживаем на таком уровне в течение 72 часов с последующим согреванием до нормального уровня в течение 6 часов со скоростью 0,5 °C в час. У всех детей группы ТГ была начата в течение первого часа жизни, ко второму часу были достигнуты значения ректальной температуры в диапазоне от 33,2 до 33,8 °C.
Динамика показателей на фоне проводимой ТГ
При поступлении в ОАиРН оценивались степень тяжести ГИЭ с использованием модифицированной шкалы Sarnat и дальнейшая неврологическая динамика, наличие судорог, динамика кислотно-щелочного баланса, параметры ИВЛ (фракция кислорода во вдыхаемой смеси FiO2, среднее давление в дыхательных путях MAP до и во время процедуры охлаждения).
У всех детей при поступлении отмечался декомпенсированный метаболический ацидоз (гиперлактатацидоз). На фоне проводимой ТГ уже через 3 часа удалось уменьшить метаболические расстройства, что сопровождалось снижением уровня дефицита оснований и лактата крови. К концу первых суток у всех детей были достигнуты приемлемые показатели газового состава крови и в дальнейшем не было значимых нарушений кислотно-щелочного равновесия.
Все дети при рождении имели неэффективное дыхание, что потребовало проведения ИВЛ, у половины — высокочастотной, пролонгировалась более 5 суток. По нашим наблюдениям, FiO2 и MAP снижались к 12-му часу жизни и доходили до минимума к концу 3-х суток.
Гемодинамические нарушения различной степени выраженности отмечались во всех клинических случаях, в двух диагностирован комбинированный гиповолемический и перераспределительный шок. Высокие и средние терапевтические дозы кардиотоников и вазопрессоров для стабилизации гемодинамики использовались у всех пациентов. Средняя длительность инотропной поддержки составила 5 дней (индивидуально максимальная — 17 дней, минимальная — 3 дня).
Нарушения коагуляции разной степени выраженности наблюдались во всех случаях и проявлялись повышенной кровоточивостью из мест инъекций, контактной кровоточивостью слизистых желудка и трахеобронхиального дерева, изменениями коагулограммы в виде гипофибриногенемии менее 1,5 г/л и удлинения показателей активированного частичного тромбопластинового времени и тромбинового времени (у 90 % детей). Всем детям проводились трансфузия факторов свертывания крови (свежезамороженная плазма, «Октаплас») и введение витамина К.
Противопоказаниями для применения ТГ являются: гестационный возраст менее 35 недель, вес ≤1 800 г, массивные внутричерепные геморрагии, повреждение мягких тканей головы или переломы костей свода черепа, атрезия ануса или множественные пороки развития, возраст старше 6 часов.
Случаи из практики
1. Анамнез матери: монохориальная диамниотическая двойня. Срочные роды через естественные родовые пути первым плодом. Острая гипоксия второго плода. Экстренное кесарево сечение.
Оценка по шкале Апгар 1/ИВЛ. В родильном зале проводился комплекс реанимационных мероприятий. Восстановление сердечной деятельности на 4-й минуте. С родзала ребенок не согревался. На 10-й минуте — глубокое угнетение ЦНС, зрачки широкие, реакция зрачков на свет (РЗС) отсутствовала.
ТГ начата в течение первого часа.
Из обследования: ОАК — анемический синдром, БАК — повышение АсАТ, АлАТ. КЩС: декомпенсированный метаболический лактат-ацидоз (рН 6,8; ВЕ -22,0; лактат 18 ммоль/л). НСГ: выраженная перивентрикулярная инфильтрация, ИР ПМА 0,58, затруднение венозного оттока.
ЭЭГ на 1-е сутки (на фоне ТГ): постоянный фоновый паттерн с крайне низким вольтажом (см. рис. 1). Клинически — кома. РЗС за период лечения отсутствует. Выраженные вегетативно-висцеральные нарушения. Длительная потребность в инотропной помощи.
Рисунок 1. Тяжелые нарушения фоновой активности (макс. амплитуда ≤ 10 мкВ; мин. амплитуда ≤ 5 мкВ)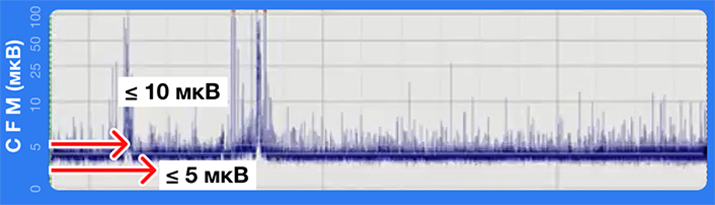 Наличие бульбарных расстройств, невозможность экстубации.
Наличие бульбарных расстройств, невозможность экстубации.
КТ: снижение плотности мозговой паренхимы, мультифокальные кортикальные и субкортикальные очаги пониженной плотности.
Исход: тяжелое органическое поражение ЦНС, паллиативная помощь.
2. Анамнез матери: женщина поступила в приемный покой в потужном периоде 4-х самопроизвольных родов. Длительный безводный период (18 ч). Тугое обвитие пуповины вокруг шеи плода.
Оценка по шкале Апгар 1/ИВЛ. В родзале — комплекс реанимационных мероприятий. Восстановление сердечной деятельности на 5-й минуте. Глубокое угнетение ЦНС. Через 3 часа после рождения появился легкий тремор, реакция на осмотр в виде вздрагиваний, восстановилась РЗС.
Из обследования: ОАК, БАК: возрастная норма. КЩС: декомпенсированный метаболический лактат-ацидоз (рН 6,9; ВЕ -26,0; лактат 23). НСГ: ПВИ. Снижение ИР и скорости артериального кровотока, кровоток в вене Галена не определяется.
ЭЭГ (2-е сутки): прерывистый паттерн с нормальным вольтажом (см. рис. 2).
Рисунок 2. 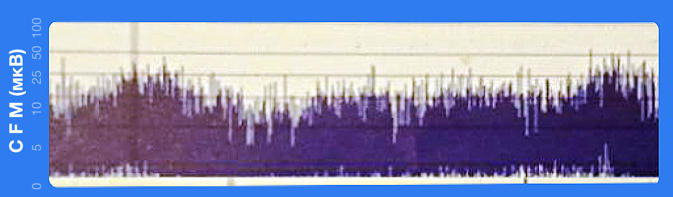
Экстубирован на 5-е сутки. Переведен в ПО на 8-е сутки. С 10-х суток совместное пребывание с матерью, приложен к груди.
КТ, МРТ: без структурной патологии.
Растет и развивается по возрасту.
3. Анамнез матери: Роды первые, срочные, слабость потуг. Острая гипоксия плода. Извлечение плода с использованием вакуум-экстрактора. Тугое обвитие пуповины вокруг шеи плода.
Оценка по шкале Апгар 3/ИВЛ. В родильном зале — комплекс реанимационных мероприятий. На фоне ИВЛ со 2-й минуты восстановление нормальной сердечной деятельности.
Из обследования: ОАК: лейкоцитоз без сдвига лейкоформулы. БАК: повышен АсАТ. КЩС: декомпенсированный метаболический лактат-ацидоз (рН 7,0; ВЕ -26,0, лактат 15). НСГ: ПВИ. Отек ГМ. Выраженная дисциркуляция мозгового кровотока — маятникообразный характер артериального кровотока, резко снижена скорость венозного кровотока. Раннее появление тонико-клонических судорог. РЗС сохранена, симметрична. Исключены травматические повреждения черепа и головного мозга, массивные ВЧК.
ЭЭГ: судорожная активность (см. рис. 3).
Рисунок 3. 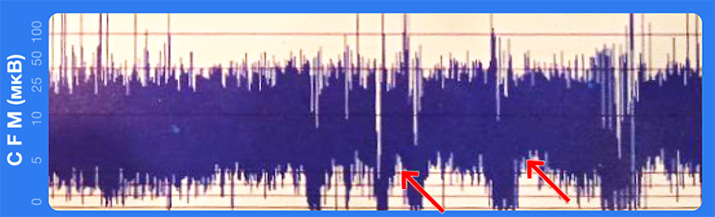 Увеличена доза мидазолама до максимальной. Мультифокальные клонические судороги. Ребенок введен в барбитуровую кому. С 3-х суток — фенобарбитал перорально. Судороги не повторялись.
Увеличена доза мидазолама до максимальной. Мультифокальные клонические судороги. Ребенок введен в барбитуровую кому. С 3-х суток — фенобарбитал перорально. Судороги не повторялись.
Экстубирован на 7-е сутки.
ЭЭГ на 7-е сутки: прерывистый паттерн с нормальным вольтажом без судорожной готовности.
НСГ: восстановление допплерометрических характеристик по артериальному и венозному кровотоку.
Переведен в ПО на 9-е сутки. С 10-х суток совместное пребывание с матерью, сосет из рожка.
КТ, МРТ: без структурной патологии.
Растет и развивается по возрасту.
Результаты
У всех пациентов из группы наблюдения отмечена положительная динамика состояния, летальных исходов в неонатальном периоде не было. У большинства детей — положительная динамика по неврологическому статусу. Экстубированы 8 пациентов (70 %), переведены в педиатрическое отделение (ПО). Два пациента на фоне продолжающейся ИВЛ были переведены в реанимационное отделение 3-й ГДКБ.
Анализ катамнестических данных показывает наличие тяжелого органического поражения ЦНС к концу 1-го года жизни у 2 пациентов. Пятеро из 10 детей на данный момент здоровы, растут и развиваются по возрасту (отдаленные последствия пока неизвестны).
Вне сомнения, некорректно делать какие-либо выводы, опираясь всего на 10 исследований. Доказательная медицина не знает сослагательного наклонения, наша команда использовала мировой опыт и внедрила его в свою работу.

