Данные эпидемиологических исследований свидетельствуют о том, что опухоли гормоносекретирующих и гормонозависимых органов и тканей составляют около 15–20 % всех новообразований. Для разработки наиболее эффективных моделей организации медицинской помощи пациентам с опухолевыми заболеваниями органов эндокринной системы целесообразно междисциплинарное взаимодействие специалистов, их знания и опыт.
В Беларуси в рамках ГНТП «Научно-техническое обеспечение качества и доступности медицинских услуг», подпрограммы «Злокачественные опухоли» на 2019–2023 годы выполнено задание 03.12 «Разработать и внедрить метод диагностики медуллярного рака щитовидной железы и синдрома множественной эндокринной неоплазии 2А типа».
В условиях научно-исследовательской части БГМУ была создана междисциплинарная научная группа «Онкоэндокринология», в которую вошли сотрудники кафедры эндокринологии БГМУ, Минского городского клинического онкоцентра, Республиканской молекулярно-генетической лаборатории канцерогенеза РНПЦ ОМР им. Н. Н. Александрова, имеющие большой опыт в проведении молекулярно-генетических исследований, а также клинической, лабораторной и инструментальной диагностики медуллярного рака щитовидной железы, гиперпаратиреоза, феохромоцитом.
Общее руководство работой осуществлялось профессором кафедры эндокринологии БГМУ, доктором мед. наук Аллой Шепелькевич и заведующей республиканской молекулярно-генетической лабораторией канцерогенеза, доктором мед. наук Анной Портянко.
Варианты синдромов МЭН
Под термином «синдром множественных эндокринных неоплазий» (МЭН) объединяются заболевания, при которых выявляются опухоли нейроэктодермального происхождения и (или) гиперплазии (диффузные, узелковые) в 2 эндокринных органах и более.
Согласно рекомендациям экспертов Европейского общества по медицинской онкологии (European Society for Medical Oncology) 2020 года, различают несколько фенотипических вариантов синдромов МЭН в зависимости от характера генетических нарушений и сочетанного поражения внутренних органов (см. табл. 1).
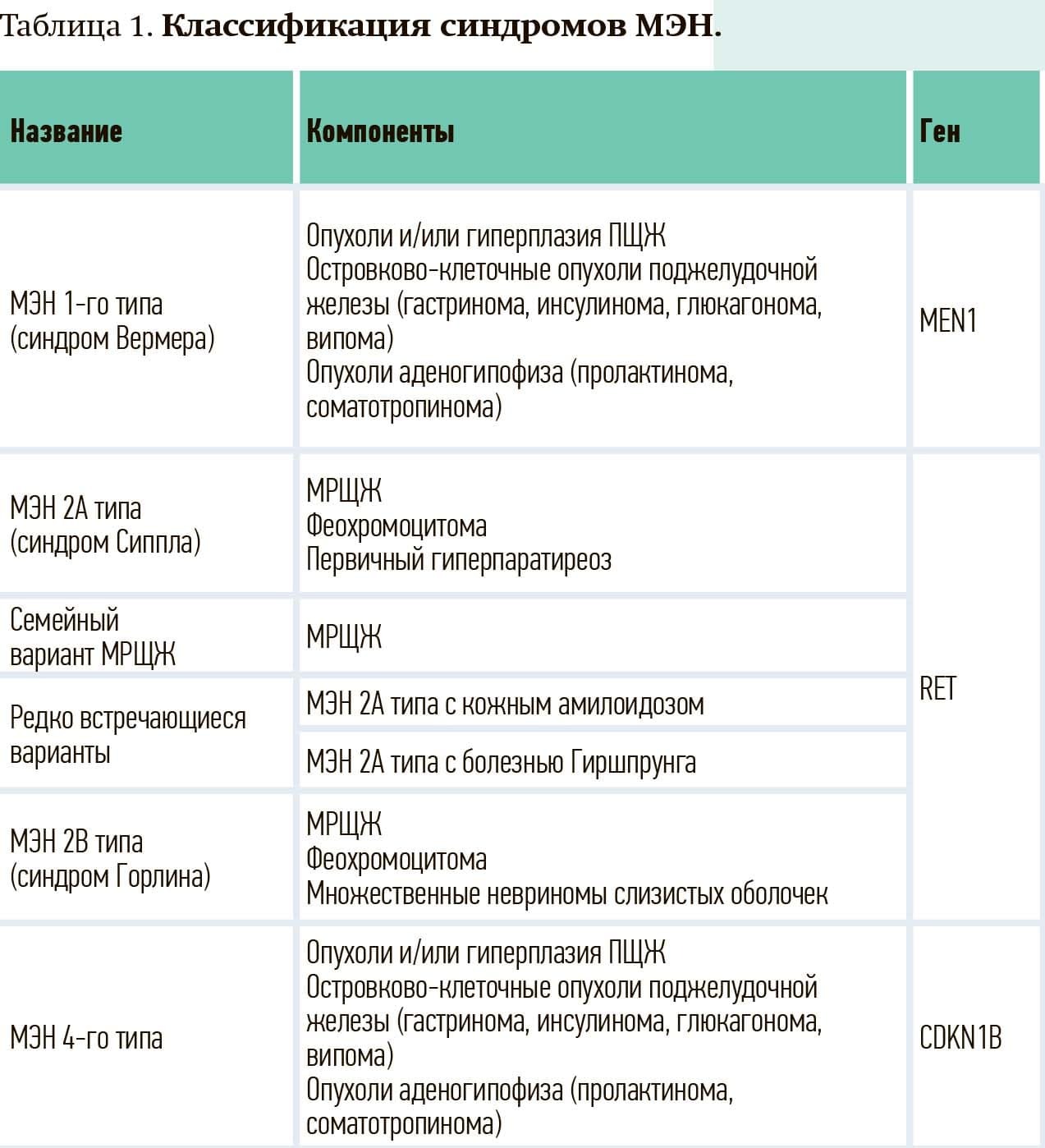
В то же время наиболее распространенным вариантом МЭН является сочетание медуллярного рака щитовидной железы (МРЩЖ), феохромоцитомы (ФХЦ) и поражения паращитовидных желез, которое определяют как синдром множественной эндокринной неоплазии 2А типа (МЭН 2А), или синдром Сиппла.
Генетической основой МЭН 2-го типа является точечная мутация в RET-протоонкогене. У 95 % пациентов обнаруживают точечную мутацию протоонкогена с-ret (10q11), кодирующего рецептор нейротропного фактора, регулирующего пролиферацию и дифференцировку клеток, производных нервного гребня. Было установлено, что продуктом активации RET-протоонкогена является тирозинкиназа рецепторного типа, отвечающая за рост, дифференцировку и выживание клетки. Мутация гена RET в эмбриональных клетках приводит к экспрессии патологически измененного сверхактивного RET-протеина в нейроэндокринных тканях, что влечет за собой бесконтрольную клеточную пролиферацию.
Ранее выделялась изолированная семейная форма МРЩЖ (сейчас — вариант МЭН 2А), которая отличается изолированным поражением ЩЖ (как правило, в нескольких поколениях без других проявлений классического синдрома МЭН 2А). Однако описаны случаи поздней манифестации ФХЦ у одного из пробандов в семьях с семейным изолированным МРЩЖ. В связи с этим в 2024 году в Клинических рекомендациях по МРЩЖ Российской ассоциации онкологов было предложено считать семейную форму МРЩЖ вариантом синдрома МЭН 2А с низкой пенетрантностью ФХЦ. МРЩЖ при этой форме, как правило, развивается позже, протекает менее агрессивно, фенотипическая пенетрантность МРЩЖ при семейной изолированной форме может быть не абсолютной (часть пациентов с мутацией не имеют МРЩЖ).
Компоненты синдрома МЭН 2-го типа
Согласно клиническим рекомендациям по ведению пациентов с МРЩЖ, принятым Американской ассоциацией по щитовидной железе в 2015-м и Ассоциацией онкологов России в 2024 году, выделяют следующие варианты синдрома МЭН 2-го типа (см. табл. 2).
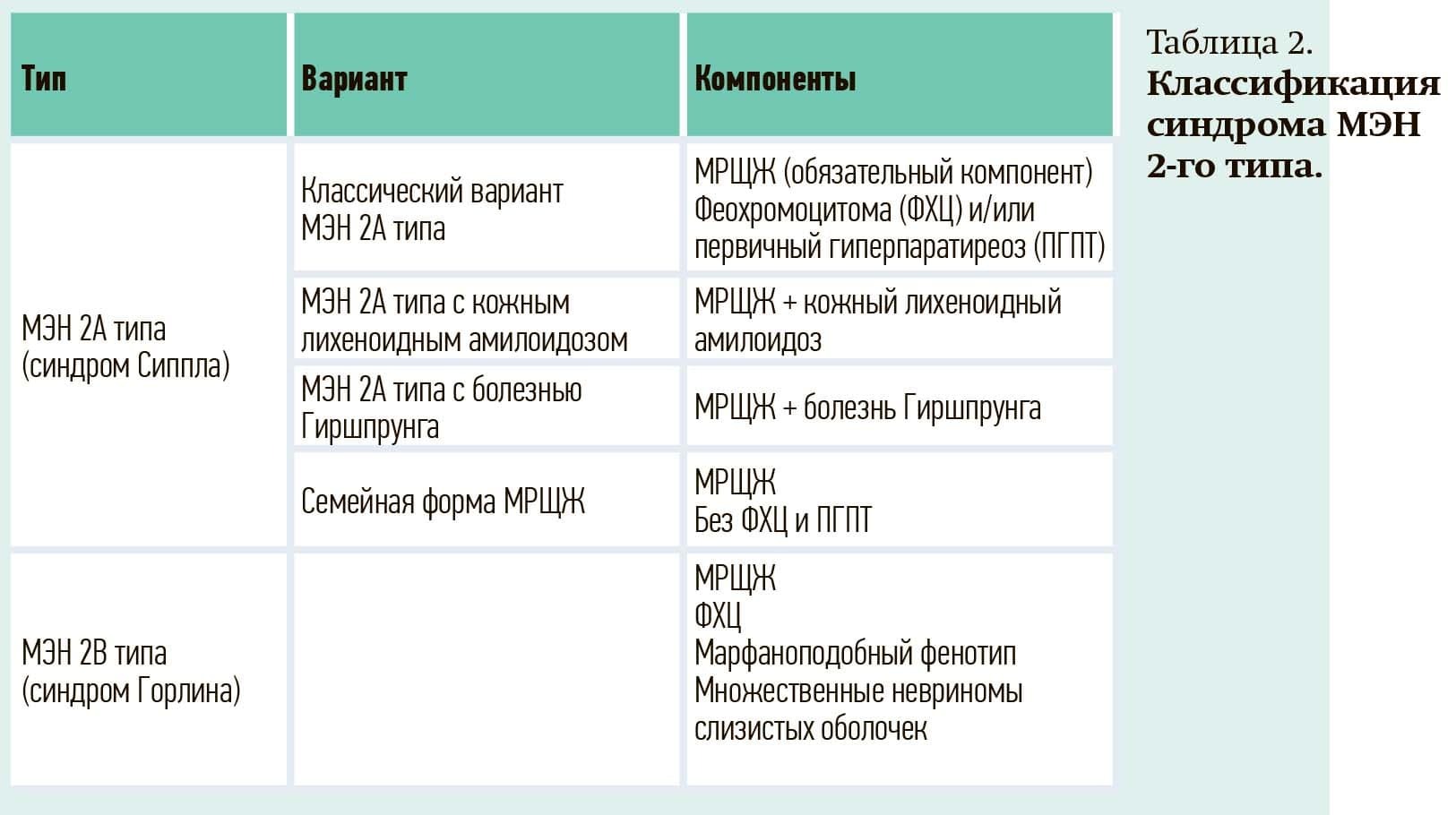
Типы МЭН-2 различаются распространенностью, возрастом манифестации заболевания, типом мутации, ассоциацией с другими заболеваниями, агрессивностью МРЩЖ и прогнозом.
Наиболее распространенным из наследственных вариантов является синдром МЭН 2А (90–95 % пациентов с МЭН 2-го типа), тогда как синдром МЭН 2В составляет 5–10 % всех случаев.
МРЩЖ как первичное проявление данного синдрома развивается в возрасте от 5 до 25 лет, фенотипическая пенетрантность МРЩЖ при МЭН 2А составляет 100 %.
Одно- либо двусторонняя ФХЦ и ПГПТ развиваются в 55–75 % и 15–30 % случаев, соответственно. Наиболее редкими проявлениями считаются болезнь Гиршпрунга (аганглиоз толстой кишки) и кожный лихеноидный амилоидоз, часть экспертов рассматривают последние сочетания как самостоятельные нозологические формы.
Классический вариант синдрома МЭН 2А типа является наиболее распространенным вариантом синдрома, его облигатный признак — МРЩЖ в сочетании с ФХЦ и/или ПГПТ. Частота развития ФХЦ и ПГПТ зависит от варианта RET-мутации.
Медуллярный рак щитовидной железы
МРЩЖ — опухоль из секретирующих кальцитонин парафолликулярных С-клеток щитовидной железы, которые происходят из нейроэктодермы — эмбриональной закладки, отличающейся от мезодермального происхождения А- и В-клеток ЩЖ.
Распространенность МРЩЖ варьирует от 0,1 % до 1,3 %. Частота встречаемости спорадической формы колеблется от 56 % до 77 %, в то время как наследственные формы встречаются с частотой от 19 % до 44 %.
Согласно эпидемиологическим данным, распространенность случаев синдрома МЭН 2-го типа: 1 случай на 80–200 тысяч человек. Так, по результатам эпидемиологического исследования, проведенного в Норвегии, распространенность синдрома МЭН 2-го типа составила 1 случай на 79 тысяч населения, в то время как частота выявления пациентов с RET-мутациями, ассоциированными с синдромом МЭН 2А типа, равнялась 1 случаю на 66,5 тысячи населения.
В Беларуси до начала реализации проекта отсутствовали данные о распространенности синдрома МЭН 2А типа, что было обусловлено как сложностями комплексной (клинической и молекулярно-генетической) диагностики, так и отсутствием алгоритма диагностики. В рамках проекта было проведено ретроспективное продольное исследование, включавшее всех заболевших (658) МРЩЖ в период 1980–2019 годов, в т. ч. анализ данных 394 пациентов с МРЩЖ за 2019–2024 годы. По результатам исследования была создана и зарегистрирована «База данных пациентов с медуллярным раком щитовидной железы».
Регистрируемые средние 5-летние уровни заболеваемости МРЩЖ в Беларуси за период с 1980-го по 2019 год увеличились в 8 раз (0,03 и 0,24 на 100 тысяч населения) и сопоставимы в последние годы с показателями заболеваемости в других европейских странах. Имеется возрастная, половая и территориальная вариабельность (город/село) в распространенности. Показатель смертности на протяжении последних 25 лет сохраняет стабильность, варьируя от 0,03 до 0,04 на 100 тысяч населения.
Наследственная форма МРЩЖ является обязательным компонентом синдрома МЭН 2А типа. Для данной формы характерна ранняя манифестация (1-я декада жизни при проведении генетического и биохимического скрининга), двустороннее мультифокальное поражение ЩЖ с очагами С-клеточной гиперплазии.
Этиология МРЩЖ в рамках МЭН 2-го типа связана с мутацией в гене RET, кодирующем трансмембранный тирозинкиназный рецептор. Активация данного рецептора приводит к бесконтрольной пролиферации С-клеток.
Для наследственного варианта МРЩЖ экспертами Американской ассоциации по щитовидной железе была разработана классификация на основе характера мутации RET-онкогена:
- Уровень D — наиболее высокий риск агрессивности МРЩЖ. RET-мутация в кодоне М918Т связана с началом заболевания в раннем возрасте, высоким риском метастазирования и смертности. К этому уровню относятся пациенты с МЭН 2В.
- Уровень С — высокий риск агрессивного течения МРЩЖ, ассоциирован с RET-мутацией в кодоне C634 и кодоне А883F.
- Уровни А и В — умеренный риск агрессивности МРЩЖ. Пациенты с наследственным вариантом МРЩЖ с RET-мутацией во всех остальных кодонах, за исключением кодонов С634, А883F, М918Т.
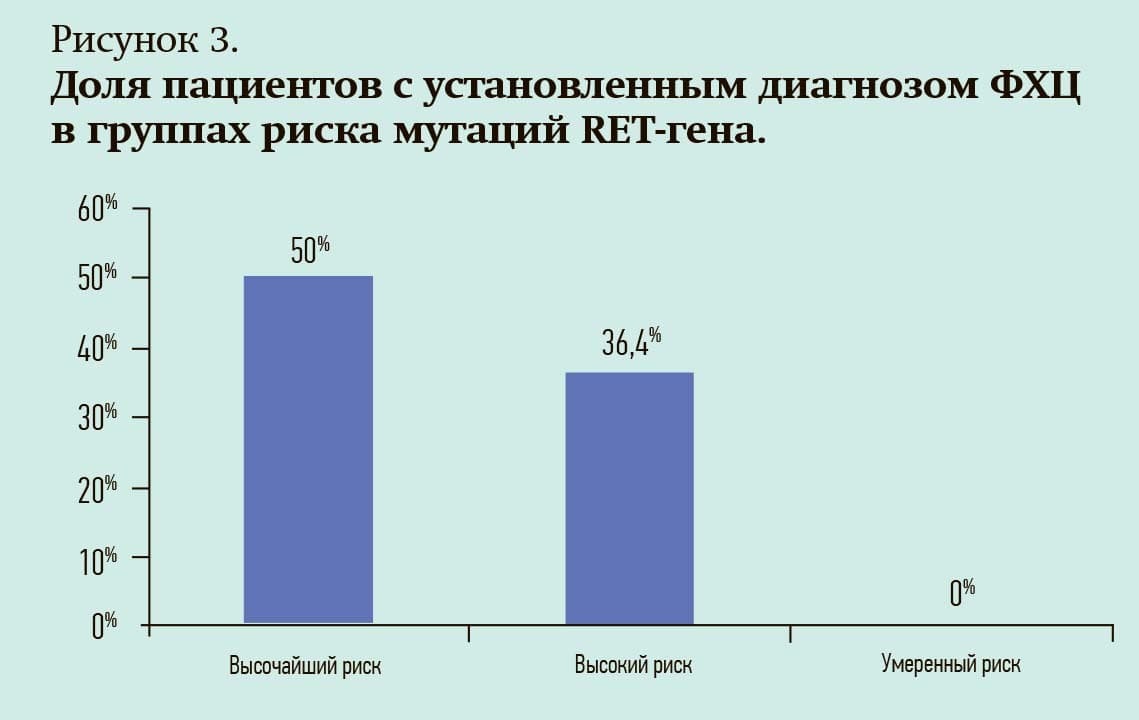
По результатам нашего исследования генетически детерминированный МРЩЖ выявлен в 15,1 % наблюдений, также определена частота мутаций в белорусской популяции в соответствии с группами риска. Данные представлены на рис. 1.
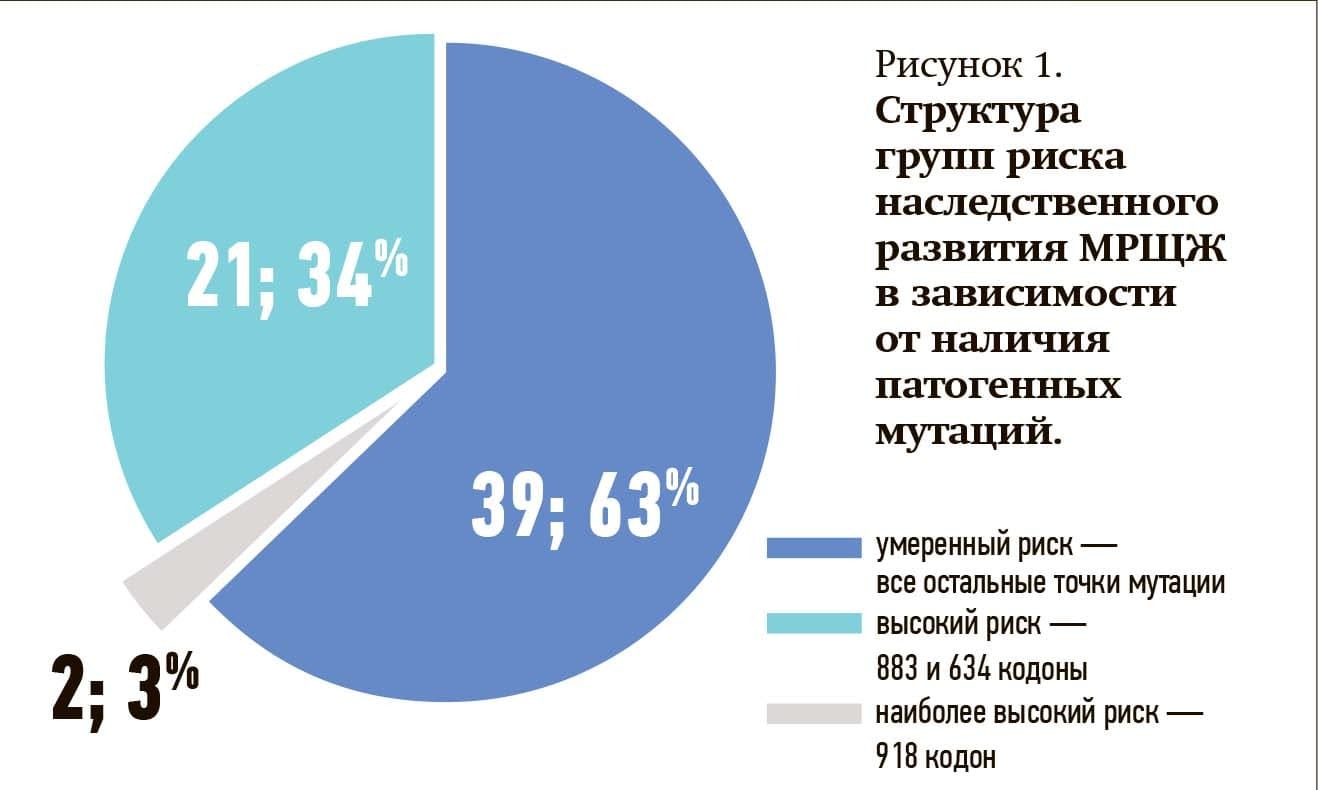
Определены степени агрессивности клинического течения МРЩЖ в зависимости от выявленных мутаций с представлением гистограммы распределения групп риска у жителей республики.
В 3 % случаев выявлены мутации наиболее высокого риска, в 34 % – высокого риска, 63 % пациентов отнесены к умеренному уровню риска.
Установление генетических параметров является важным, поскольку пациенту с наличием RET-мутации показано наблюдение для раннего выявления ФХЦ и ПГПТ. Также установлено, что у родственников пациента с выявленной RET-мутацией выше риск развития МРЩЖ.
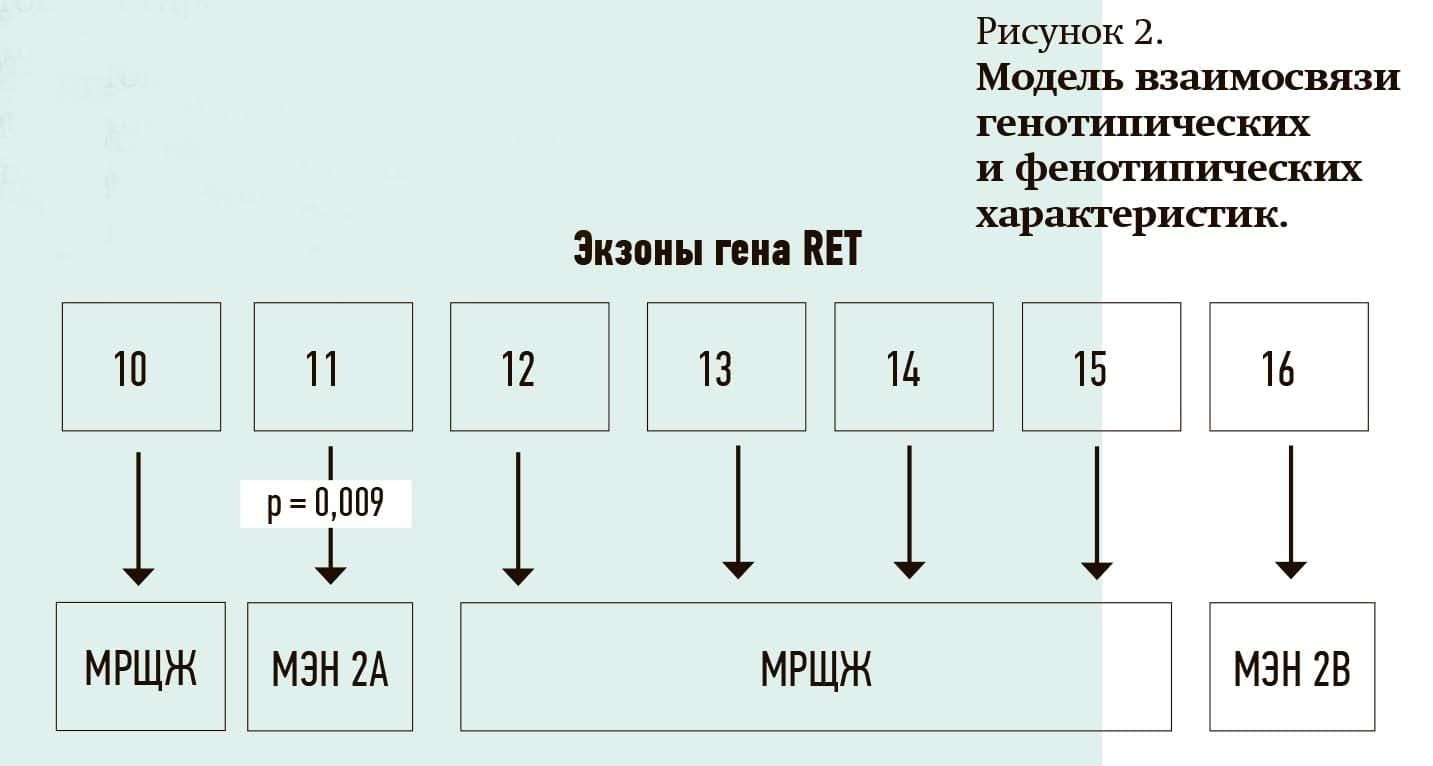
Также определена модель взаимосвязи генотипических и фенотипических характеристик. Выявлена корреляционная связь между наличием ФХЦ и мутаций в 11 экзоне протоонкогена RET (p=0,009). Пенетрантность ФХЦ в группе пациентов с наличием патогенных вариантов в 634 кодоне 11 экзона и патогенного варианта М918Т в 16 экзоне протоонкогена RET составила 50 % (см. рис. 2).
При выявлении мутации RET обсуждается вопрос о проведении профилактической тиреоидэктомии и интраоперационной ревизии ПЩЖ. Приблизительно у 95 % пациентов с МЭН 2А и МЭН 2B типов, а также у 88 % пациентов с семейной формой МРЩЖ выявляется мутация RET.
Кроме того, установлена высокая вероятность наличия RET-мутации у пациентов с многофокусным поражением ЩЖ и/или с МРЩЖ в детском возрасте.
Согласно российским клиническим рекомендациям по МРЩЖ (2024) и белорусским клиническим протоколам по онкологии (2018), под профилактической тирэоидэктомией (ПТЭ) понимают тиреоидэктомию у пациентов с отсутствием клинических проявлений МРЩЖ с доказанной RET-мутацией, без узловых образований ЩЖ более 5 мм и/или измененных лимфатических узлов по данным УЗИ.
Основная цель ПТЭ заключается в предотвращении метастазирования. Кроме того, тиреоидэктомия, выполненная до метастатического поражения лимфатических узлов, позволяет избежать проведения центральной лимфодиссекции, которая ассоциирована с более высоким риском гипопаратиреоза и повреждения возвратных гортанных нервов.
Пациенты с синдромом МЭН 2-го типа, у которых выявляется пальпируемый МРЩЖ, имеют плохой прогноз в отношении полного излечения. Оптимальные сроки выполнения ПТЭ определяются на основании статуса мутации RET (сведения о поврежденном кодоне) и возраста пациента.
Профилактические операции проведены 20 пациентам (10 детей и 10 взрослых) на основании данных генотипирования, уровня сывороточного и стимулированного кальцитонина, результатов клинических обследований. В 50 % случаев выявлен МРЩЖ и в 50 % — С-клеточная гиперплазия, являющаяся доказанным предиктором развития заболевания.
При предоперационном обследовании признаков опухолевой патологии ЩЖ не было выявлено.
Лабораторно-инструментальные аспекты диагностики МРЩЖ
Для раннего выявления опухолей внедряются новые методы диагностики. Так, особое внимание уделяется методам визуализации и проведению тонкоигольной аспирационной биопсии (ТАБ) узловой патологии ЩЖ. Характерными УЗ-признаками МРЩЖ, как и других видов рака щитовидной железы, являются солидное строение, гипоэхогенность, неровность контуров, наличие микро-/макрокальцинатов.
Проба на стимуляцию уровня кальцитонина глюконатом кальция в Беларуси впервые была проведена в 2017 году в условиях онкологического консультативно-диагностического отделения тиреоидной патологии Минского городского клинического онкоцентра (Республиканского центра опухолей щитовидной железы).
В рамках проекта проба выполнялась:
- для своевременной диагностики рецидива заболевания у пациентов с МРЩЖ (выявление раннего биохимического рецидива);
- уточнения показаний к ПТЭ у родственников пациентов с МРЩЖ при наличии мутации в протоонкогене RET;
- дифференциальной диагностики узловой патологии ЩЖ (первичная диагностика МРЩЖ у пациентов с узловой патологией неопределенного потенциала злокачественности и при повышенных уровнях кальцитонина).
Проба проводилась согласно следующему протоколу:
- определение уровня базального кальцитонина в сыворотке крови — забор крови до введения глюконата кальция;
- определение стимулированного уровня кальцитонина в сыворотке крови — забор крови через 2 и 5 минут после внутривенного введения 10 % раствора глюконата кальция.
Важно соблюдение порядка проведения пробы определения стимулированного уровня кальцитонина. В связи с возможными побочными эффектами тест проводится в стационарных условиях, в положении пациента лежа, строго натощак.
После забора крови из вены с целью определения уровня базального кальцитонина внутривенно болюсно вводят глюконат кальция из расчета 2,5 мг (0,27 мл 10 % раствора) на 1 кг массы тела. При массе тела пациента более 70 кг вводят 20 мл 10 % раствора глюконата кальция. Стимулированный уровень кальцитонина определяется через 2 и 5 минут после введения раствора.
В рамках настоящего исследования было проведено более 50 проб.
Учитывая увеличение уровня кальцитонина в результате стимуляционной пробы, проведено выделение следующих критериев, определяющих тактику ведения пациентов:
- увеличение уровня стимулированного кальцитонина менее чем в 10 раз свидетельствует о низкой вероятности рецидива МРЩЖ;
- увеличение уровня стимулированного кальцитонина в 10 и более раз свидетельствует о возможном рецидиве.
В рамках настоящего проекта выполнена оптимизация протокола проведения пробы и продолжено ее клиническое внедрение.
Феохромоцитома
ФХЦ представляет собой редкую катехоламин-секретирующую нейроэндокринную опухоль. Согласно классификации нейроэндокринных опухолей ВОЗ 2017 года (4-й пересмотр), к ФХЦ относится опухоль, возникающая из хромаффинных клеток мозгового слоя надпочечников. На долю ФХЦ приходится примерно 80–85 % всех катехоламин-секретирующих нейроэндокринных опухолей, оставшиеся 10–15 % — симпатические параганглиомы, реже — с локализацией в области головы и шеи.
Результаты эпидемиологических исследований свидетельствуют о том, что заболеваемость ФХЦ варьирует от 2 до 8 случаев на 1 млн человек в год. ФХЦ выявляется у 5 % пациентов с инциденталомами надпочечников, у 1 % пациентов с артериальной гипертензией.
Пик заболеваемости приходится на 30–50 лет, средний возраст выявления опухоли для подтвержденных наследуемых синдромов — 24,9 года, для спорадических случаев — 43,9 года.
Данные генетических исследований подтверждают тот факт, что ФХЦ в 35 % случаев имеют наследственную природу. Известно более 20 спорадических или наследуемых мутаций генов, играющих триггерную роль в этиопатогенезе ФХЦ.
Выделяют доброкачественную (неметастатическую) и злокачественную (метастатическую) ФХЦ. В 10 % случаев первым проявлением заболевания являются регионарные и/или отдаленные метастазы. В 30–50 % случаев злокачественность остается нераспознанной, приводя к серьезным осложнениям и смерти пациентов.
ФХЦ манифестирует приблизительно у 50 % пациентов с МЭН 2A и МЭН 2В типов. ФХЦ у пациентов с синдромом МЭН 2А типа локализуется только в надпочечниках и в 30 % случаев уже при первичном диагнозе присутствует с обеих сторон. У 50 % пациентов с односторонней ФХЦ в течение 10 лет выявляется ФХЦ контралатерального надпочечника.
В нашем исследовании был проведен анализ частоты встречаемости клинических проявлений заболевания в зависимости от генетических нарушений в протоонкогене RET у пациентов с верифицированным диагнозом МРЩЖ. Медиана возраста установления диагноза 35 лет. Патогенные варианты в 634 кодоне выявлены в 27,8 % случаев. Пенетрантность ФХЦ в данной группе пациентов составила 50 % (n=5) (см. рис. 3).
Средний возраст пациентов с ФХЦ составил 31,9 года. Среди пациентов с мутациями в других кодонах протоонкогена RET ФХЦ была обнаружена у 2,7 % у пациентов с вариантом М918Т. Пенетрантность ФХЦ у пациентов с данным патогенным вариантом также составила 50 %, что соответствует результатам аналогичных исследований.
Первичный гиперпаратиреоз
ПГПТ — клинико-лабораторный симптомокомплекс, развивающийся в результате гиперпродукции паратиреоидного гормона патологически измененными паращитовидными железами (ПЩЖ), проявляющийся нарушением фосфорно-кальциевого обмена и гиперкальциемией, приводящими к полиорганной патологии и повышенному риску внезапной смерти.
ПГПТ занимает 3-е место по распространенности в структуре эндокринных заболеваний после сахарного диабета и патологии ЩЖ (распространенность в популяции — 1 %). До 90 % всех случаев ПГПТ составляют спорадические формы заболевания, обусловленные аденомой, гиперплазией или раком ПЩЖ. Около 10 % ПГПТ развивается на основе имеющихся генетических нарушений.
ПГПТ отмечается у 20–30 % пациентов с синдромом МЭН 2А типа, при этом наблюдается более мягкое течение ПГПТ, чем при синдроме МЭН 1-го типа.
По данным французского национального исследования пациентов с синдромом МЭН 2-го типа (200 семей, включенных в Национальный французский регистр с 1984 года), распространенность ПГПТ составила 19 %, средний возраст 33,7 года, вероятность развития ПГПТ с возрастом повышалась.
Ретроспективный анализ 119 пациентов с синдромом МЭН 2А типа, проведенный в США в период с 1963-го по 1989 год, показал, что для ПГПТ в составе синдрома МЭН 2А типа в 48,5 % случаев была характерна диффузная клеточная гиперплазия паратиреоцитов, в то время как аденомы одной или более ПЩЖ — у 8,6 % пациентов. Важно отметить, что у 43 % пациентов с синдромом МЭН 2А типа были выявлены эктопически расположенные ПЩЖ.
Среди обследованных пациентов 51 % принимают препараты кальция и витамина D, гипопаратиреоз установлен у 18,9 %. У 23,9 % пациентов уровни кальция остаются ниже референсного интервала нормы.
Клиническая интерпретация синдрома МЭН 2А. Для создания базы данных пациентов с МЭН 2А типа были проанализированы данные базы пациентов с МРЩЖ, сформированной на основании канцер-регистра Беларуси и медицинской документации Республиканского центра опухолей щитовидной железы.
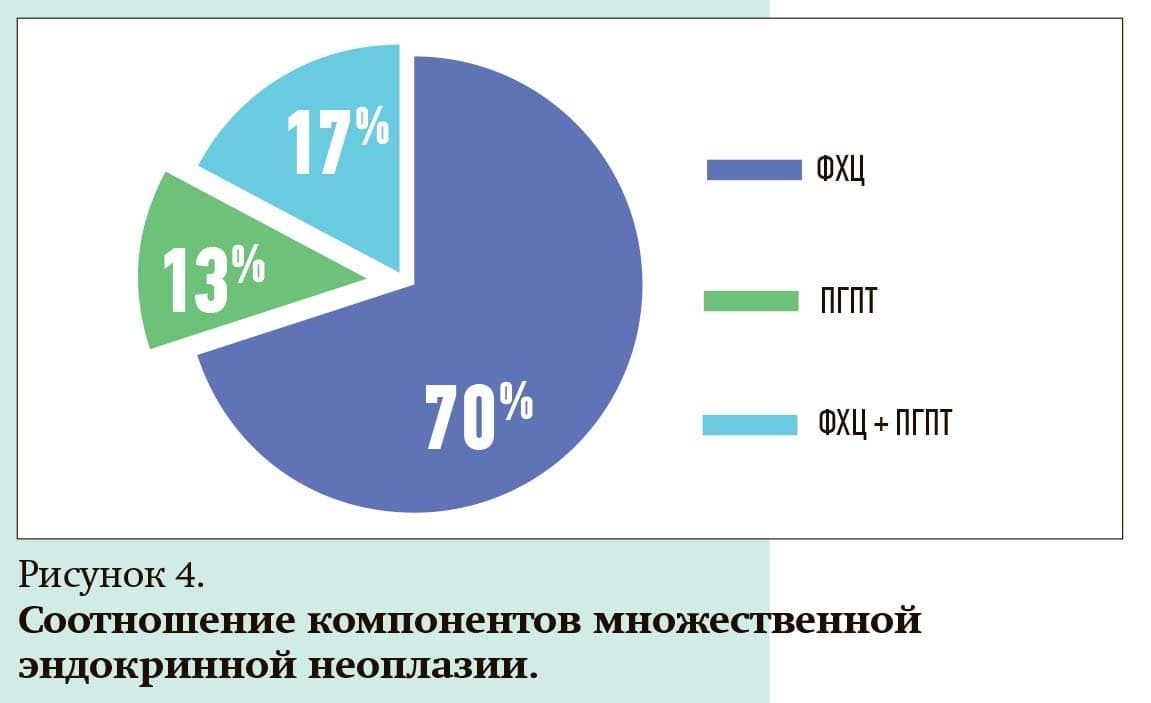
В группу МЭН-2А включены пациенты с МРЩЖ и наличием еще одной эндокринной опухоли, всего 23 человека.
ФХЦ выявлена у 69,6 % пациентов (16 человек), ПГПТ — у 17,4 % (4 пациента), сочетание трех нейроэндокринных опухолей имело место в 13 % случаев (3 пациента) (см. рис. 4).
Количество пациентов, внесенных в базу данных МЭН-2А на 1 июня 2024, составляет 23 человека, возраст от 17 до 56 лет. Проведено лабораторное исследование биохимических параметров крови пациентов с МЭН-2А (см. табл. 3).

Выводы. Таким образом, в результате проведенного популяционного исследования по изучению МРЩЖ и синдрома МЭН 2А типа генетически детерминированный МРЩЖ в Республике Беларусь выявлен в 15,1 % наблюдений. Заболевание было ассоциировано с мутациями, относящимися в 3 % случаев к мутациям наиболее высокого риска, в 34 % — высокого риска, в 63 % — умеренного риска.
В рамках проекта проведена оптимизация протокола пробы определения уровня стимулированного глюконатом кальция кальцитонина и продолжено ее клиническое внедрение.
В подгруппу синдрома МЭН 2А типа включены пациенты с МРЩЖ и наличием еще одной эндокринной опухоли, всего 23 человека.

