На третьем Белорусском биохимическом конгрессе в Гродно большой интерес вызвала модель для ранней диагностики немелкоклеточного рака легкого на основе определения белков крови. Масштабное исследование проводит коллектив сотрудников БГМУ и РНПЦ онкологии и медрадиологии имени Н. Н. Александрова. О результатах, полученных на этом этапе работы, и о дальнейших направлениях научного поиска рассказывают заведующий кафедрой биохимии БГМУ, доктор мед. наук Анатолий Таганович и доцент кафедры, кандидат хим. наук Николай Ковганко.
Актуальность для всего мира
 В индустриальных странах рак легкого занимает первое место среди всех онкологических заболеваний. В Беларуси он находится на втором месте, уступая раку предстательной железы.
В индустриальных странах рак легкого занимает первое место среди всех онкологических заболеваний. В Беларуси он находится на втором месте, уступая раку предстательной железы.
Различают два основных типа рака легкого: мелкоклеточный и немелкоклеточный (НМРЛ). Наиболее распространен НМРЛ (80 %). Одногодичная летальность при нем достигает 70 %, в Беларуси — 49 %. Такая высокая вероятность неблагоприятного исхода связана с тем, что примерно в половине случаев НМРЛ выявляется на поздних стадиях.
 Даже при раннем выявлении НМЛР 5-летний барьер выживаемости преодолевают 60–70 % пациентов с 1-й стадией, 35–40 % — при 2-й.
Даже при раннем выявлении НМЛР 5-летний барьер выживаемости преодолевают 60–70 % пациентов с 1-й стадией, 35–40 % — при 2-й.
Причиной столь высокой смертности практически всегда является рецидив опухоли, который обусловлен наличием в организме скрытых метастазов, даже несмотря на постановку диагноза в ранней стадии и оперативное удаление опухоли.
Разное течение НМРЛ в пределах одной стадии побуждает к разработке прогнозных показателей, которые бы позволяли предсказывать длительность безрецидивного периода у пациентов на ранних стадиях развития опухоли с тем, чтобы правильно построить стратегию и тактику лечения.
Выявить заболевание на ранней стадии
Когда клиническая симптоматика еще отсутствует, самым приемлемым является проведение скрининговых исследований. Для этих целей используются три направления: визуализация опухоли, гистологические и биохимические методы.
К сожалению, существующие сегодня методы визуализации опухоли имеют ограничения, обусловленные, с одной стороны, их разрешающей способностью и облучением организма. С другой, действуют экономические причины, связанные с высокой стоимостью оборудования. Гистологическое исследование предполагает наличие биопсийного материала опухолевой ткани, который чаще можно получить только инвазивным путем.
Одним из диагностических инструментов служат циркулирующие биомаркеры рака легкого. Они появляются и обнаруживаются в кровотоке на ранней стадии опухолевого процесса. С развитием технологий протеомики в качестве диагностических и прогнозных показателей злокачественного роста, в т. ч. у пациентов с НМРЛ, предлагались различные белки. Они являются или компонентами опухолевых клеток, или участниками звеньев молекулярных событий развития опухолевой ткани. К ним, в частности, относятся CYFRA 21-1 (фрагмент цитокератина 19), SCC (антиген плоскоклеточного рака), CEA (раковый эмбриональный антиген).
Было показано, что CYFRA 21-1 является чувствительным маркером НМРЛ (в особенности плоскоклеточного рака легкого (ПКРЛ)), а СЕА — аденокарциномы (АК). Дело в том, что НМРЛ включает гистологические подтипы, основными среди которых являются АК и ПКРЛ. Однако результаты определения в сыворотке крови уровня каждого из них в отдельности не смогли продемонстрировать необходимых специфичности и чувствительности.
Использование новейших чувствительных методов, таких как компьютерная, позитронно-эмиссионная томография, аутофлуоресцентная бронхоскопия, оказывают существенную помощь в диагностике рака легкого. Однако смертность от этого заболевания все еще высока.
В поиске новых биомаркеров
Наше исследование как раз и направлено на поиск новых биомаркеров, которые бы обладали преимуществом перед имеющимися в плане информативности при постановке диагноза рака легкого.
Мы исходили из того, что развитию рака легкого, как правило, сопутствует воспаление, которое сопровождается секрецией биологически активных белков — хемокинов. Хемокины связываются со своими рецепторами на поверхности клеток. Из-за этого происходит направленное перемещение клеток в микроокружении опухоли, активируются сигнальные пути, опосредующие прорастание опухолевой ткани кровеносными сосудами и метастазирование.
В образцах крови пациентов с впервые диагностированным НМРЛ, доброкачественной опухолью легкого и здоровых людей мы анализировали более 20 показателей, характеризующих цитокины CXCL5 и CXCL8 (интерлейкин-8), их рецепторы (CXCR1 и CXCR2) и др. Использовали современные анализаторы, работа которых основывается на принципах хемилюминесценции, иммуноферментного определения, проточной цитометрии.
Первые и очень важные результаты
На первом этапе исследования было выявлено изменение уровня указанных белков у пациентов с НМРЛ. Установлена их связь с размером опухоли и степенью ее злокачественности, метастазированием в регионарные лимфоузлы и отдаленными метастазами, рассчитана диагностическая эффективность их определения, которая превысила таковую для «классических» маркеров — опухолевых антигенов CYFRA 21-1, SCC, TPA.
Оказалось, что при аденокарциноме существенные различия между здоровыми людьми и пациентами как с ранними, так и с поздними стадиями наблюдались в уровне CXCL5, параметрах рецептора CXCR2, концентрации С-реактивного белка. У пациентов с плоскоклеточным раком легкого информативными для диагностики начальных этапов развития опухоли был дополнительно уровень SCC.
Однако диагностическая эффективность определения каждого из этих маркеров в крови пациентов с АК или ПКРЛ не превышала 75 %. Чтобы увеличить ее, отобранные показатели были вовлечены в регрессионный анализ, позволяющий объединить несколько маркеров в один интегрированный показатель. Для него были рассчитаны пороговые значения. В результате появилась возможность отличить ранние стадии аденокарциномы или с высокой долей вероятности подтвердить наличие поздних стадий. Диагностическая эффективность критерия достигала 97,9 %.
Аналогичным образом было составлено регрессионное уравнение, включающее результаты исследования биомаркеров у пациентов с ПКРЛ. Рассчитанный на его основе показатель позволяет судить о наличии опухоли в начальной стадии развития у пациентов с ПКРЛ с диагностической эффективностью 96,7 %.
Прогнозирование рецидива
Часто спрашивают, можно ли использовать биохимические маркеры для прогнозирования течения рака легкого после проведенного лечения? Мы надеемся на это. Сейчас совместно с сотрудниками РНПЦ онкологии и медрадиологии им. Н. Н. Александрова мы выполняем научный проект, или задание государственной программы научных исследований «Трансляционная медицина».
Важной составляющей задания является разработка критериев прогнозирования рецидива. Существует специальный термин «безрецидивная выживаемость». По сути, это интервал времени от начала лечения до прогрессирования заболевания. Необходимы критерии, на основании которых можно было бы предсказывать развитие у пациентов рецидива опухоли после ее удаления с тем, чтобы правильно построить стратегию и тактику последующего лечения.
Обычно в качестве таких критериев течения НМРЛ используют стадию, возраст и состояние пациента. Вместе с тем в начале заболевания они малоэффективны.
В своем исследовании мы оценили вероятность развития рецидива в течение первого года после оперативного удаления опухоли легкого. Были выделены группы риска рецидива. Для этого использовались данные Белорусского канцер-регистра. В расчет принимались только те факторы, которые связаны с развитием опухоли и прежде всего могут оказывать влияние на прогрессирование. Данные анализировались специальным графическим методом статистического анализа Каплана — Мейера. Он позволяет наглядно продемонстрировать различия безрецидивной выживаемости разных групп пациентов.
В зависимости от стадии (1-я или 2-я) и степени дифференцировки опухолевых клеток при НМРЛ пациенты разделились на группы быстрого и медленного прогрессирования опухоли.
Первая объединяет пациентов с более коротким периодом безрецидивной выживаемости. В нее вошли те, у кого была 1-я стадия и низкодифференцированная опухоль, и пациенты с 2-й стадией, опухолевые клетки у которых средне- или низкодифференцированы.
Вторая группа включает пациентов с более длительной безрецидивной выживаемостью. В нее вошли те, у которых была 1-я стадия НМРЛ и высокодифференцированная опухоль (G1) или средней степени дифференцировка (G2), а также пациенты с 2-й стадией заболевания и высокодифференцированной опухолью.
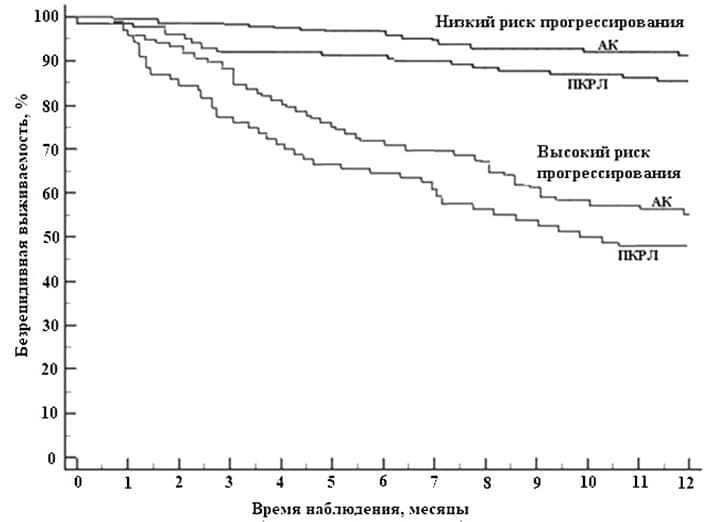
Разница безрецидивной выживаемости между этими двумя группами превысила различия выживаемости в зависимости только от стадии НМРЛ или только от степени дифференцированности опухолевых клеток (см. рис. 1).
Рисунок 1. График безрецидивной выживаемости пациентов с аденокарциномой и плоскоклеточным раком легкого в зависимости от риска прогрессирования опухоли.
В дальнейшем мы сопоставили значения определяемых лабораторных параметров в крови пациентов (более 20) в зависимости от длительности безрецидивного периода. Важно уточнить, что исследование параметров крови проводилось до начала лечения пациентов, а наблюдение безрецидивного периода у них осуществлялось спустя год после проведенного хирургического лечения.
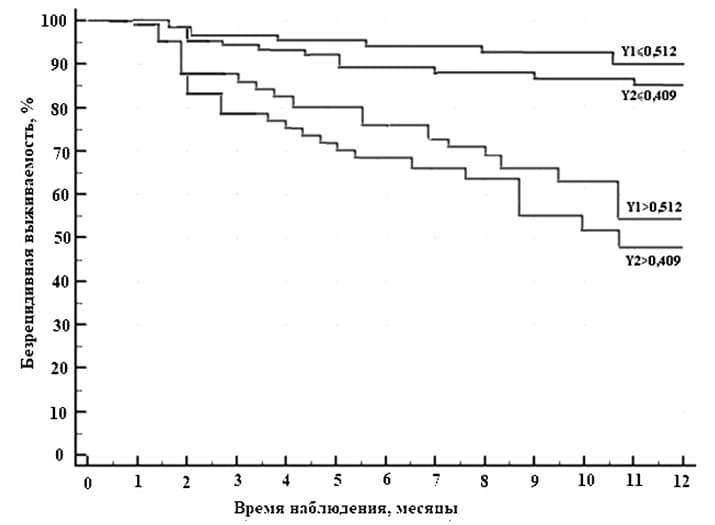
Уровень трех показателей в случае АК и такого же количества в случае ПКРЛ существенно отличался у пациентов с высоким и низким риском прогрессирования опухоли. Помимо этого была доказана связь значений этих параметров с риском прогрессирования опухоли. Именно они были вовлечены в построение моделей определения риска опухолевой прогрессии методом логистической регрессии. Оказалось, что распределение вероятности безрецидивной выживаемости на основании данных регрессионных уравнений соответствует результатам ретроспективного исследования (см. рис. 2).
Рисунок 2. График безрецидивной выживаемости пациентов с аденокарциномой (Y1) и плоскоклеточным раком легкого (Y2) в зависимости от значений результата регрессионных уравнений.
Итоги исследования дают основание рекомендовать разработанный комплекс лабораторных показателей для определения в крови пациентов с АК и ПКРЛ на ранних стадиях заболевания с целью оценки у них риска рецидива опухоли (см. табл. 1, 2). Сейчас диагностическая и прогностическая модели утверждены Минздравом Беларуси в качестве инструкций по применению.
Таблица 1. Диагностическая значимость определения уровня CYFRA 21-1 и рецепторов к цитокинам в крови пациентов с аденокарциномой в зависимости от риска прогрессирования опухоли.
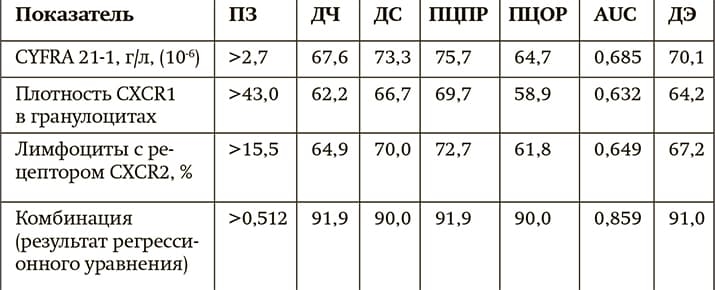
Таблица 2. Диагностическая значимость определения уровня SCC и рецепторов к цитокинам в крови пациентов с ПКРЛ в зависимости от риска прогрессирования опухоли.
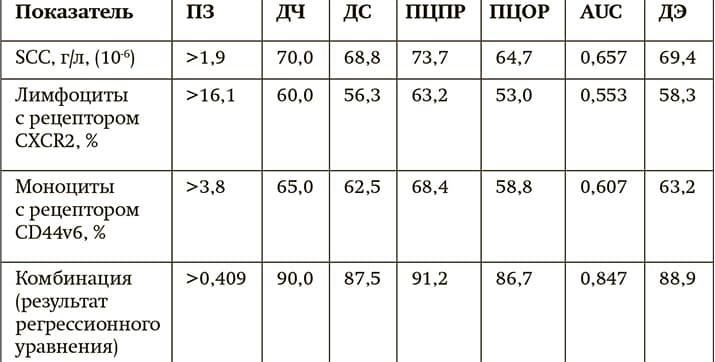
Примечания: ПЗ — пороговое значение, ДЧ — диагностическая чувствительность, ДС — диагностическая специфичность, ПЦПР — прогностическая ценность положительного результата, ПЦОР — прогностическая ценность отрицательного результата, AUC — площадь под ROC-кривой, ДЭ — диагностическая эффективность.
Биомаркеры для оценки эффективности лечения
В настоящий момент мы исследуем возможность использования разработанных комплексов биомаркеров для оценки эффективности проводимого лечения пациентам с НМРЛ. Оно не ограничивается оперативным удалением опухоли и включает полихимиотерапию, радиолучевую терапию.
Для этого отобранные показатели определяются в динамике до и после проводимых схем хирургического лечения пациентов, а также хирургического лечения в сочетании с адъювантной и неоадъювантной полихимиотерапией. Подобно тому как агрессивная, быстро растущая опухоль с множественными метастазами продуцирует очень высокий уровень опухолевого маркера в сыворотке крови, указывающий на плохой прогноз, хорошо дифференцированная опухоль менее агрессивна и продуцирует меньшее количество маркера.
Поэтому уровень маркера до начала лечения, концентрация и скорость/степень его изменения после хирургического лечения в сочетании или без предварительной и последующей полихимиотерапии соответствуют развитию опухоли. На основе наиболее информативных показателей для прогноза длительности безрецидивного периода у пациентов с IА–IIIB стадиями НМРЛ, максимально связанными с опухолевым ростом и минимально между собой, предполагается создать модель оценки эффективности проводимого лечения.