Ведущее место в структуре общей гинекологической заболеваемости долгое время было отведено воспалительным процессам. Однако в последние годы лидирующую позицию в рейтинге занимают дисгормональные нарушения, которые могут проявляться в виде дисфункций менструального цикла и гиперпролиферативных заболеваний. Дисгормональная гиперпролиферативная патология представлена группой заболеваний, объединенных общностью патогенеза и высокой частотой рецидивирования.
 О сложностях диагностики и эффективной терапии гиперпролиферативных заболеваний женской репродуктивной системы в рамках научно-практической конференции с международным участием «Междисциплинарное взаимодействие в акушерско-гинекологической практике» рассказала Галина Гребенникова, эксперт в области репродуктивного здоровья Института репродуктивной медицины (Алматы), член Казахстанской ассоциации по половому и репродуктивному здоровью, магистр мед. наук.
О сложностях диагностики и эффективной терапии гиперпролиферативных заболеваний женской репродуктивной системы в рамках научно-практической конференции с международным участием «Междисциплинарное взаимодействие в акушерско-гинекологической практике» рассказала Галина Гребенникова, эксперт в области репродуктивного здоровья Института репродуктивной медицины (Алматы), член Казахстанской ассоциации по половому и репродуктивному здоровью, магистр мед. наук.
Женщина вчера и сегодня
К заболеваниям органов репродуктивной системы с выраженным пролиферативным компонентом относятся:
- фибромиомы, лейомиомы;
- эндометриоз;
- мастопатии;
- гиперпластические процессы эндометрия;
- дисплазия шейки матки.
Учитывая тот факт, что дисгормональные гиперпролиферативные заболевания объединяет общность патогенеза, по данным медицинской статистики, они часто сочетаются — до 63 %. На этапе менопаузального перехода, когда те или иные изменения в гормональной системе еще более усугубляются, частота сочетаемости пролиферативных заболеваний возрастает до 73 %.
Кроме того, для гиперпролиферативных заболеваний характерна высокая частота рецидивирования.
Сравнительно недавно, в прошлом веке, женщины и их социальная роль кардинально отличались от настоящего времени. Основным приоритетом были семья и дети. Соответственно, для женщин того времени были свойственны ранний брак, большое количество родов, длительный (до 3 лет) период кормления грудью, отсутствие активной позиции в обществе, как, впрочем, и в семье. С физиологической точки зрения «вчерашняя» женщина имела 160 овуляций в течение жизни. В контексте проблем гинекологического здоровья длительный период гестации и длительная лактационная аменорея (гипоэстрогения) обеспечивали женщинам эффективную профилактику гиперэстрогении.
Современные женщины имеют совершенно другую социальную роль и абсолютно иной репродуктивный анамнез. Им присущи позднее вступление в брак, меньшее количество родов, непродолжительный период лактации и до 450 овуляций в течение жизни.
Длительный менструальный и овуляторный анамнез увеличивает вероятность дисгормональных заболеваний и может явиться причиной гиперпролиферативных процессов.
В подтверждение своих слов Галина Гребенникова привела статистику Казахстана, которая не существенно отличается от белорусской, что подтверждает и усиливает межнациональную и межстрановую актуальность проблемы женского репродуктивного здоровья в контексте дисгормональных нарушений.
- Четверть населения Казахстана (26,7 %), как и Беларуси, — женщины фертильного возраста. 42,8 % из них проживают в сельской местности (в Беларуси — около 20 %).
- Коэффициент рождаемости у 25–29-летних женщин выше, чем у 20–24-летних (10 лет назад ситуация была прямо противоположная).
- Возраст сексуального дебюта 16,5 года (в Беларуси — 15–15,5 года).
- Средний возраст женщин Казахстана при первых родах составляет 24,7 года (в Беларуси — 26,7 года).
- Ежегодная рождаемость с 2015 года держится в пределах 400 тысяч родившихся живыми детей.
Согласно приведенным данным, очевидна тенденция к откладыванию рождения первенца, при этом период между сексуальным дебютом и первыми родами составляет порядка 10 лет. Именно в этот период, по словам Галины Гребенниковой, женщины нуждаются в эффективной контрацепции. Но, например, для Казахстана это является проблемой. Не из-за дефицита контрацептивов, а из-за отсутствия культуры контрацепции, считает эксперт.
Ежемесячная овуляция, колебания уровня гормонов на протяжении менструального цикла, аборты в случае незапланированной беременности представляют риски развития гормонозависимых состояний и гиперпролиферативных процессов.
В Казахстане чаще всего прерывают беременность женщины в возрасте от 24 до 35 лет, причем почти 70 % из них — жительницы городов. В то же время только каждая третья представительница этой возрастной группы из числа тех, кто не планирует беременность, пользуется контрацептивами.
Теоретически 70 % женщин имеют риск незапланированной беременности и ее прерывания, что может отрицательно сказаться на гормональном статусе.
Итак, современная женщина, учитывая ее существенно изменившуюся социальную роль, подвергается повышенным рискам нарушения овариальной функции и развития на этом фоне:
- функциональных кист яичников;
- гиперпластических процессов эндометрия и молочных желез;
- миомы матки;
- эндометриоза. В последние годы эндометриоз значительно «помолодел». Существует много теорий и взглядов, почему он в принципе возникает и в чем причина его развития во все более раннем возрасте.
От дисбаланса к пролиферации
Одна из современных теорий механизма пролиферации заключается в том, что в его основе лежат:
- гиперэстрогения (абсолютная или относительная);
- формирование при овуляторном цикле так называемых канцерогенных метаболитов эстрогенов (16α-ОНE1 и 2-ОНE1) и дисбаланс между ними;
- нарушение экспрессии цитохрома Р-450 в тканях-мишенях.
По данной теории механизм пролиферации протекает на фоне активации митогенных, противовоспалительных факторов роста, активации неоангиогенеза, активации онкогенных факторов за счет подавления апоптоза.
Доказано, что между активностью метаболитов эстрогена 2-ОНЕ1/16α-ОНЕ1 и развитием процессов гиперплазии в эстроген-зависимых тканях существует четкая связь.
Соотношение метаболитов эстрогена 2-ОНЕ1/16α-ОНЕ1 является биомаркером развития патологической клеточной пролиферации в эстроген-чувствительных тканях.
Галина Гребенникова:
Ввиду особенности своей химической структуры 16-альфа-гидроксиэстрон формирует достаточно прочные ковалентные связи и оказывает длительный — от нескольких часов до нескольких дней — пролиферативный эффект, что как раз и способствует гиперпролиферации. Более того, доказано его канцерогенное действие на клетки.
Чтобы не допустить отрицательного влияния, соотношение между метаболитами эстрогена 2-ОНЕ1 и 16α-ОНЕ1 должно быть 2:1 соответственно. Именно в такой ситуации достигается баланс между пролиферацией и апоптозом. В случае возникновения дисбаланса превалируют воспалительные процессы, неоангиогенез, пролиферация, инвазия — все это характерно для развития эндометриоза, миомы матки, аденомиоза, гиперплазии эндометрия.
Эндометриоз — крайне распространенная в мире проблема, от которой страдает каждая 10-я женщина репродуктивного возраста. Среди пациенток с синдромом хронических тазовых болей эндометриоз встречается у 70 %. В 25–35 % случаев он является причиной бесплодия. Заболевание оказывает прямое влияние на качество жизни женщин, значительно ухудшая его.
Задача на лечение
Вместе с тем эндометриоз был и остается большой загадкой. Существует целый ряд теорий его возникновения, включая иммунную, эмбриональную, теорию менструального рефлюкса и др. Но ни одна из этих теорий до сих пор не нашла достоверного научного обоснования.
Схожая ситуация и с миомой матки — доброкачественной, гормонозависимой опухолью миометрия. В структуре гинекологических заболеваний она занимает долю в 31–50 % и встречается у 15–17 % женщин старше 30 лет. На протяжении многих лет считалось, что ключевую роль в формировании миомы матки играет эстроген. Но сегодня есть понимание, что это в большей степени прогестерон-зависимая опухоль. В целом же миома — это гиперпролиферативный процесс, который достаточно часто сочетается с эндометриозом (44 %) и гиперплазией эндометрия (37–76 %).
К сожалению, патологические состояния молочных желез тоже молодеют, констатирует эксперт. Так, они выявляются у каждой 2-й женщины старше 40 лет и у каждой 4-й моложе 30 лет. У 50 % больных отмечается диффузная форма мастопатии, в 20 % клинических случаев — узловая.
Мастопатия — это фиброзно-кистозная болезнь (ФКБ), характеризующаяся нарушением соотношения эпителиального и соединительного компонентов, а также спектром пролиферативных и регрессивных изменений тканей молочной железы. На фоне различных вариантов ФКБ риск рака молочной железы (РМЖ) возрастает в 4–37 раз при диффузной мастопатии и в 30–40 раз при узловой.
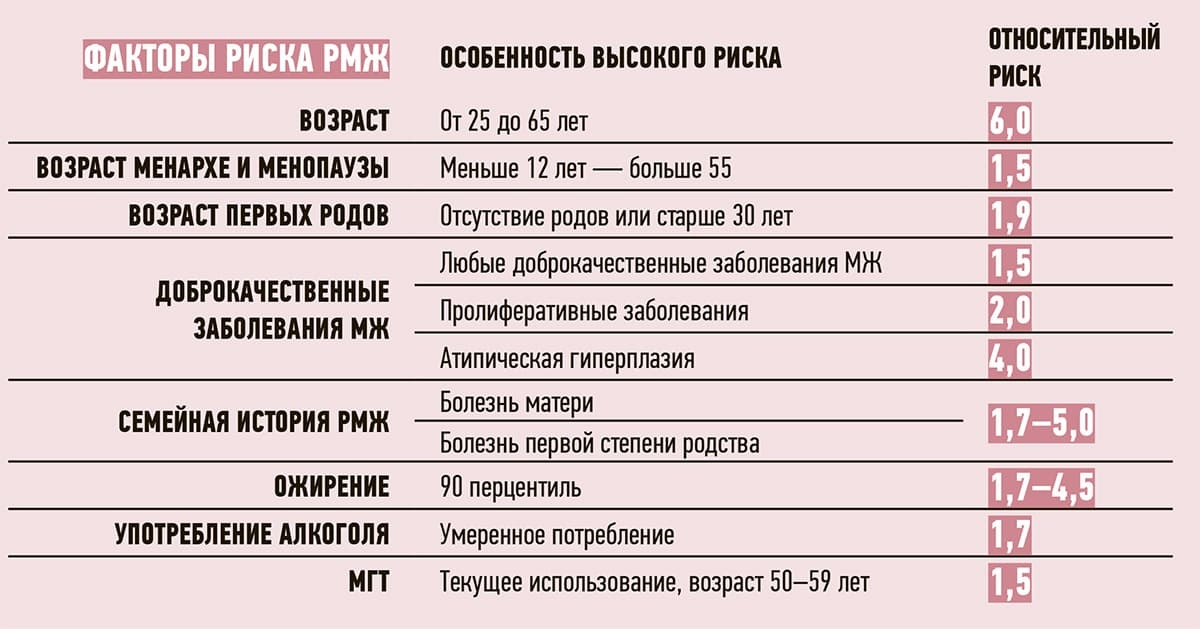
За последние 10 лет заболеваемость РМЖ женщин в возрасте от 19 до 39 лет выросла на 34 %. На сегодня определены условия, при которых доброкачественные дисплазии могут перейти в РМЖ:
- повышенная пролиферация (изменение баланса метаболитов эстрадиола 2-ОНЕ1/16α-ОНЕ1, т. е. абсолютная или относительная гиперэстрогения, факторы роста); сниженный апоптоз, хроническое воспаление;
- возможные эпигенетические изменения: метилирование генов, деацетилирование гистонов;
- опухолевые стволовые клетки.
Галина Гребенникова:
К сожалению, до сих пор нет эффективной патогенетической терапии эндометриоза, миомы матки, гиперплазии эндометрия и других гормонозависимых заболеваний. Есть лекарственные препараты, которые действуют на ряд звеньев патогенеза эндометриоза. Но при их отмене вновь возникает рецидив заболевания. То же самое касается других гиперпролиферативных процессов — это рецидивирующие состояния.
Так, трудности с медикаментозным лечением сочетанных доброкачественных опухолей и гиперпластических процессов матки связаны со многими факторами:
- не изучены до конца их этиология и патогенез;
- наличие широкого разнообразия клинических проявлений — например, у одной пациентки с эндометриозом могут фактически отсутствовать клинические проявления болезни даже при наличии эндометриоидной кисты больших размеров, а у другой крошечный очаг эндометриоза может быть случайной находкой при УЗ-исследовании, но при этом сопровождаться сильнейшим болевым синдромом;
- сложность дифференциальной диагностики с использованием неинвазивных методов;
- отсутствие биохимических маркеров заболевания;
- ограниченный круг предложенных на данный момент методов безопасного лечения, рассчитанного на длительную перспективу, поскольку гормонозависимые заболевания, как правило, рецидивируют после прекращения лечения.
Учитывая сложность с подбором эффективной патогенетической терапии гиперпролиферативных процессов, главным остается вопрос: чем дополнить комплексную терапию, чтобы профилактировать гиперпластические процессы или облегчить уже сложившееся состояние.
По мнению Галины Гребенниковой, чтобы остановить процессы патологической клеточной пролиферации, необходимо осуществлять фармакологическую коррекцию трех сигнальных каскадов: гиперэстрогении, нарушения цитокинов и влияния на ростовые факторы.
Удар по трем мишеням
Нужно одновременно блокировать пролиферацию посредством антиэстрогенного действия препаратов, индуцировать апоптоз, добиться противовоспалительного и антиангиогенного эффекта. Только таким образом можно прекратить или нарушить «питание» очагов гиперпролиферативных процессов и свести к минимуму склонность к их прогрессированию или возникновению рецидивов заболевания.
В этом контексте особый интерес вызывает ряд различных исследований, проведенных с применением индол-3-карбинола и индинола — негормональных препаратов, которые воздействуют на все причины возникновения клеточной пролиферации и имеют длительный, стойкий эффект. Они могут оказывать положительное влияние на все три сигнальные каскада.
Так, в одном из рандомизированных плацебо-контролируемых исследований участницы были разделены на 3 группы по 20 человек. Первая группа пациенток получала индол-3-карбинол в дозе 400 мг/сут; вторая и третья группы получали плацебо и клетчатку соответственно. Наблюдение проводилось в течение 12 недель.
Результаты показали, что у пациенток в группах, получавших плацебо и клетчатку, соотношение метаболитов эстрадиола не изменилось. А в той группе, которая принимала индол-3-карбинол, — нормализовалось, тем самым отрицательное влияние 16α-ОНЕ1 на эстроген-зависимые органы было нивелировано.
Еще одно открытое наблюдательное исследование было направлено на изучение влияния индол-3-карбинола на уменьшение плотности ткани молочных желез, уменьшение размеров и приостановление роста кист, снижение болевого синдрома при фиброзно-кистозной мастопатии. В нем приняли участие 60 женщин от 21 года до 55 лет с диагностированной фиброзно-кистозной мастопатией.
Основная жалоба, которую предъявляли пациентки, — боль в молочных железах преимущественно во вторую фазу менструального цикла. Участницы исследования получали препараты индол-3-карбинола по 2 капсулы дважды в день в течение 6 месяцев. В итоге снижение интенсивности боли через 3 месяца было отмечено в 52 % наблюдаемых случаев, через 6 месяцев — в 85 %. Снижение пальпаторной плотности ткани МЖ: через 3 месяца — в 58 % случаев, через 6 месяцев — в 70 %. Уменьшение размера кист через 3 месяца отмечено у 55 % участниц; через полгода — у 57 %.
Несмотря на то что индол-3-карбинол больше изучен при лечении пролиферативных процессов молочных желез, есть исследования и в отношении гинекологических дисгормональных гиперпролиферативных заболеваний. Например, в клиническом исследовании эффективности терапии больных с сочетанной патологией (аденомиоз + миома матки) участие принимали 72 пациентки. Им был рекомендован к применению в течение 6 месяцев индол-3-карбинол в дозе 400 мг в сутки (по 100 мг 4 раза в день) в сочетании с эпигаллокатехин-3-галлатом по 300 мг 4 раза в день. Через 2 месяца 28 % больных отмечали улучшение состояния, через 6 месяцев — 91 %.
Итак, терапия индол-3-карбинолом и эпигаллокатехин-3-галлатом при аденомиозе и миоме матки является патогенетически обоснованной, действующей на молекулярные звенья патогенеза. Препараты оказывают положительное влияние на клиническую симптоматику заболевания, неоангиогенез, пролиферацию, инвазии и апоптоз.
В рамках еще одного исследования осуществлялось наблюдение за 492 женщинами с аденомиозом. В первую группу вошли 344 пациентки с клинически активным аденомиозом, во вторую — 148 женщин с клинически неактивным аденомиозом. Терапия также сочетала индол-3-карбинол с эпигаллокатехином. Критерий отбора — больные с отсутствием показаний для оперативного лечения. После 6-месячного курса на улучшение состояния указали 90 % женщин.
Галина Гребенникова:
Если говорить о терапии эндометриоза, то нужно помнить, что заболевание характеризуется неоангеогенезом, нарушением апоптоза, конечно же, гиперпролиферацией клеток, воспалительными процессами.
Так вот, патогенетическое влияние индол-3-карбинола на эндометриоз таково, что он блокирует пролиферацию клеток, вызывает, так скажем, антиэстрогенное действие, индуцирует апоптоз, а в сочетании с эпигаллокатехин-3-галлатом обладает противовоспалительным действием и выраженным антиангиогенным эффектом.
Первостепенная задача врача — обеспечить профилактику рецидивов гиперпролиферативных процессов, убеждена Галина Гребенникова. Соответственно, в комплексную терапию необходимо включать препараты, содержащие индол-3-карбинол, эпигаллокатехин-3-галлат, поскольку они:
- вызывают избирательную гибель трансформированных клеток с аномально высокой пролиферативной активностью;
- не имеют побочных эффектов;
- обладают достаточно высокой эффективностью, что позволяет рекомендовать их в комплексном терапевтическом лечении эндометриоза, аденомиоза, миомы матки и гиперплазии эндометрия без атипии, мастопатии;
- не требуют лабораторного контроля;
- являются высокоэффективными и безопасными при длительном применении.