Сахарный диабет (СД) 1-го типа у детей — хроническое мультифакторное аутоиммунное заболевание, которое характеризуется абсолютной инсулиновой недостаточностью, связанной с разрушением островковых клеток поджелудочной железы.
Маркерами аутоиммунного процесса СД 1-го типа являются диабет-ассоциированные антитела (АТ к глутаматдекарбоксилазе (GAD), АТ к островковым клеткам (ICA), АТ к тирозинфосфатазе (IA-2A), АТ к инсулину, АТ к 8 транспортеру цинка (ZnT8)), которые можно выявить за несколько лет до начала (клинической манифестации) заболевания.
Комбинация поражений
 В трети случаев отмечается сочетание СД 1-го типа с другими эндокринными и неэндокринными аутоиммунными заболеваниями: диффузным токсическим зобом (болезнь Грейвса), аутоиммунным тиреоидитом, целиакией, хронической надпочечниковой недостаточностью (ХНН), витилиго, пернициозной анемией и др. (см. табл. 1). Комбинация нескольких аутоиммунных поражений носит название аутоиммунного полигландулярного синдрома (АПС).
В трети случаев отмечается сочетание СД 1-го типа с другими эндокринными и неэндокринными аутоиммунными заболеваниями: диффузным токсическим зобом (болезнь Грейвса), аутоиммунным тиреоидитом, целиакией, хронической надпочечниковой недостаточностью (ХНН), витилиго, пернициозной анемией и др. (см. табл. 1). Комбинация нескольких аутоиммунных поражений носит название аутоиммунного полигландулярного синдрома (АПС).
О роли генетических факторов в развитии АПС
Сочетание различных поражений аутоиммунной природы у членов одной семьи свидетельствует о наличии общих генов предрасположенности к этой группе заболеваний. Установлена ассоциация АПС с экспрессией генов главного комплекса гистосовместимости (HLA) класса II и не HLA-генами (см. табл. 2).
Так, генетическая предрасположенность к аутоиммунным заболеваниям щитовидной железы при сочетании с СД 1-го типа характерна для гаплотипа DR3-DQB1*0201. Гены, предрасполагающие к АПС, участвуют в регуляции иммунного ответа, в частности — в представлении антигенов Т-лимфоцитам. Гены взаимодействуют друг с другом, эпигенетическими и средовыми факторами.
Среди внешнесредовых триггеров аутоиммунных заболеваний у детей доказана роль раннего прекращения грудного вскармливания, преждевременного введения глютенсодержащих прикормов, вирусных инфекций, дисбаланса кишечной микрофлоры.
Таблица 1. Распространенность аутоиммунных заболеваний у пациентов с СД 1-го типа и в общей популяции.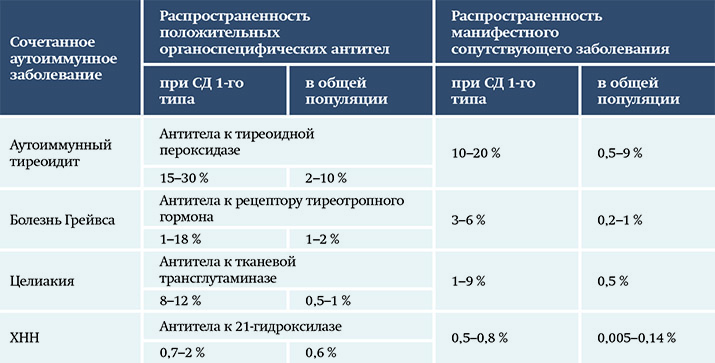 Таблица 2. Генетические факторы в развитии АПС.
Таблица 2. Генетические факторы в развитии АПС.
Аутоиммунная патология щитовидной железы и СД 1-го типа
В детской популяции наиболее распространено сочетание СД 1-го типа и аутоиммунного поражения щитовидной железы (ЩЖ). Факторами риска являются женский пол, наличие антител к GAD, генетическая предрасположенность.
Вероятность выявления антител к тиреоидной пероксидазе (ТПО) у детей с СД 1-го типа увеличивается с возрастом и стажем заболевания. Так, в группе детей от 0 до 5 лет частота повышенного уровня антител к ТПО составляет 3 %, у 15–20-летних пациентов этот показатель достигает 17 %. Риск развития аутоиммунной патологии ЩЖ возрастает с 4,5 % при манифестации СД 1-го типа до 21 % через 10 лет после диагностирования заболевания.
Распространенность субклинического гипотиреоза у детей с СД 1-го типа варьирует в пределах 7–20 %, манифестного гипотиреоза — 1–5 %. Сочетание СД 1-го типа с тиреотоксикозом встречается значительно реже (0,5–0,7 %).
Гормоны ЩЖ играют важную роль в регуляции углеводного и жирового обмена. Их органами-мишенями являются печень, белая жировая ткань, скелетные мышцы и островковые клетки поджелудочной железы. Тиреоидные гормоны одновременно обладают свойствами агонистов и антагонистов инсулина.
Контринсулярные эффекты гормонов ЩЖ:
- стимуляция глюконеогенеза и распада гликогена;
- подавление синтеза гликогена;
- усиление периферической инсулинорезистентности;
- повышение склонности к кетогенезу;
- активация симпатической нервной системы;
- ускорение клиренса инсулина.
Проинсулярные эффекты гормонов ЩЖ:
- повышение потребления глюкозы периферическими тканями;
- усиление кровотока в скелетных мышцах и утилизации ими глюкозы.
На фоне тиреотоксикоза у детей с СД 1-го типа отмечены рост инсулинорезистентности и потребности в инсулине, нестабильность гликемии, склонность к кетоацидозу.
У пациентов с СД 1-го типа и гипотиреозом увеличен риск гипогликемических состояний, характерно снижение чувствительности к инсулину, что приводит к повышению потребности во вводимом инсулине.
При впервые выявленном СД 1-го типа или длительной декомпенсации заболевания совокупность метаболических нарушений может привести к депрессии гипоталамо-гипофизарно-тиреоидной оси. При лабораторном обследовании регистрируется снижение концентрации свободных Т3 и Т4 на фоне нормального уровня ТТГ.
Такие состояния получили название «синдром нетиреоидных заболеваний» или «синдром эутиреоидной патологии».
Дефицит гормонов ЩЖ в свою очередь усиливает инсулинорезистентность, замыкая порочный круг и усугубляя обменные нарушения. После достижения компенсации СД 1-го типа тиреоидная функция нормализуется.
Целиакия и СД 1-го типа
Целиакия является вторым по частоте встречаемости аутоиммунным заболеванием у детей с СД 1-го типа. Распространенность целиакии у пациентов с СД 1-го типа варьирует от 4 до 11 %, что в 5–20 раз выше по сравнению с показателем в общей популяции (0,6–1 %). Риск развития целиакии выше, если манифестация СД 1-го типа произошла в возрасте младше 4 лет.
Формы целиакии: классическая (явная), потенциальная, скрытая и латентная. Потенциальная целиакия характеризуется наличием специфических антител (к тканевой трансглутаминазе, эндомизию) и генотипа главного комплекса гистосовместимости HLA (DQ2 и/или DQ8) при нормальной гистологической структуре слизистой тонкого кишечника по данным биопсии.
- Скрытая форма диагностируется в случае выявления специфических антител, генотипа, изменений слизистой тонкого кишечника и отсутствия клинических проявлений заболевания.
- О латентной целиакии говорят, когда у пациента в анамнезе была выявлена аутоиммунная энтеропатия, но на момент осмотра отмечено восстановление слизистой тонкого кишечника при употреблении глютенсодержащих продуктов. Специфические для целиакии антитела при этой форме заболевания могут отсутствовать.
Наиболее выраженные симптомы целиакии связаны с синдромом мальабсорбции. Они включают потерю массы тела, диарею, анорексию, запор, рвоту, вздутие и боль в животе и обычно встречаются у детей в возрасте до 3 лет. Внекишечные симптомы этой энтеропатии (низкорослость, задержка полового развития, усталость, гиповитаминоз, железодефицитная анемия) чаще отмечаются в более старшем возрасте.
У детей с СД 1-го типа гастроинтестинальные проявления целиакии регистрируются редко (<10 % случаев). Многие пациенты не имеют типичных признаков заболевания.
Могут отмечаться железодефицитная анемия, задержка роста и полового развития, диспепсия, герпетиформный дерматит и рецидивирующий афтозный стоматит.
Диарея у пациентов с СД 1-го типа как симптом целиакии нередко ошибочно принимается за осложнение основного заболевания. Однако определенные клинические и лабораторные признаки (анамнез гастроинтестинальных проявлений, повторные эпизоды гипогликемии, отсутствие нейропатии, анемия, низкие сывороточные уровни фолата и альбумина, признаки мальабсорбции) помогают заподозрить недиабетическое происхождение диареи.
Повреждение слизистой оболочки тонкого кишечника у детей с СД 1-го типа на фоне недиагностированной целиакии нарушает всасывание питательных веществ. Это ухудшает показатели долговременного метаболического контроля: увеличивается частота тяжелых эпизодов гипогликемии при адекватных уровнях гликированного гемоглобина и сниженной потребности в эндогенном инсулине. При манифестации СД 1-го типа у пациентов с явной целиакией отмечена более высокая частота кетоацидоза.
Наличие целиакии в 2,25 раза увеличивает частоту эпизодов симптоматической гипогликемии при адекватных уровнях НbА1с и сниженной потребности в инсулине.
После диагностирования целиакии и исключения глютена из рациона у детей с СД 1-го типа частота тяжелых гипогликемий уменьшается.
В детском возрасте СД 1-го типа обычно диагностируется первым. Выявление целиакии предшествует манифестации диабета в 15–20 % случаев. У детей с диабетом преобладают потенциальные и скрытые формы энтеропатии.
Сочетание СД 1-го типа с целиакией связано с более высокой смертностью и ранним развитием микроваскулярных осложнений.
У пациентов со стажем диабета более 20 лет при диагностировании ранее нелеченой целиакии распространенность ретинопатии выше в 2,3 раза, нефропатии — в 10 раз, периферической нейропатии — в 2,5 раза, чем при изолированном СД 1-го типа.
Развитие одного аутоиммунного поражения у лиц с СД 1-го типа повышает риск следующих заболеваний.
У детей с СД 1-го типа и аутоиммунной патологией ЩЖ вероятность выявления целиакии на 82 % больше, чем при изолированном диабете. У пациентов с сочетанием СД 1-го типа и целиакии риск аутоиммунных заболеваний щитовидной железы увеличивался на 67 %.
Существует гипотеза, что употребление глютена при недиагностированной целиакии является своеобразным иммунологическим триггером, который индуцирует развитие других аутоиммунных заболеваний (аутоиммунного тиреоидита, СД 1-го типа, болезни Шегрена и др.).
Наличие нескольких аутоиммунных поражений значительно ухудшает показатели углеводного контроля, влияет на темпы физического развития ребенка с СД 1-го типа.
Согласно рекомендациям международных экспертов, у детей с СД 1-го типа обязательно проведение скрининга на аутоиммунную патологию ЩЖ и целиакию.
Скрининг на функцию ЩЖ с помощью определения уровня ТТГ и АТ к ТПО в крови рекомендован при постановке диагноза СД и далее не реже 1 раза в 2 года у детей без клинической симптоматики. В противном случае может потребоваться более частая оценка тиреоидной функции.
Скрининг на наличие целиакии должен проводиться при постановке диагноза и далее раз в 1–2 года. Более частое тестирование показано при вероятности целиакии или наличии родственника первой линии родства с целиакией.
Ранняя диагностика нарушения тиреоидной функции и энтеропатии позволяет выявить возможную причину нестабильного уровня глюкозы крови, своевременно назначить соответствующее лечение и диету, предотвратить развитие острых и хронических осложнений сахарного диабета.
Клиническое наблюдение сочетанного течения целиакии и аутоиммунного тиреоидита у ребенка с СД 1-го типа
Девочка А., 6 лет, госпитализирована в Республиканский детский эндокринологический центр в связи с лабильным течением СД 1-го типа на фоне целиакии.
Из анамнеза жизни: ребенок от 2-й беременности, 2-х родов. Роды естественные в 38 недель. Оценка по шкале Апгар 8/9 баллов. При рождении масса тела 2 950 г, рост 49 см. Грудное вскармливание до 2-х месяцев. Затем смешанное вскармливание, из которого грудное молоко составляло 10–15 %. Первый прикорм (гречневая каша) был введен в 4,5 месяца.
Справочно: искусственное вскармливание является фактором риска развития СД 1-го типа и других аутоиммунных заболеваний. Гречневая крупа не содержит глютена, поэтому в отношении прикормов у пациентки не отмечено факторов риска аутоиммунной патологии.
Из перенесенных заболеваний: ОРВИ, ветряная оспа. Семейный эндокринологический анамнез не отягощен.
Из анамнеза заболевания: у ребенка в возрасте 10 месяцев был диагностирован СД 1-го типа. Физическое развитие среднее, гармоничное, показатели роста соответствовали ростовому генетическому коридору. В ОАК выявлено снижение уровня гемоглобина до 99 г/л, микроцитоз.
Рисунок. Показатели физического развития пациентки А. Генетический рост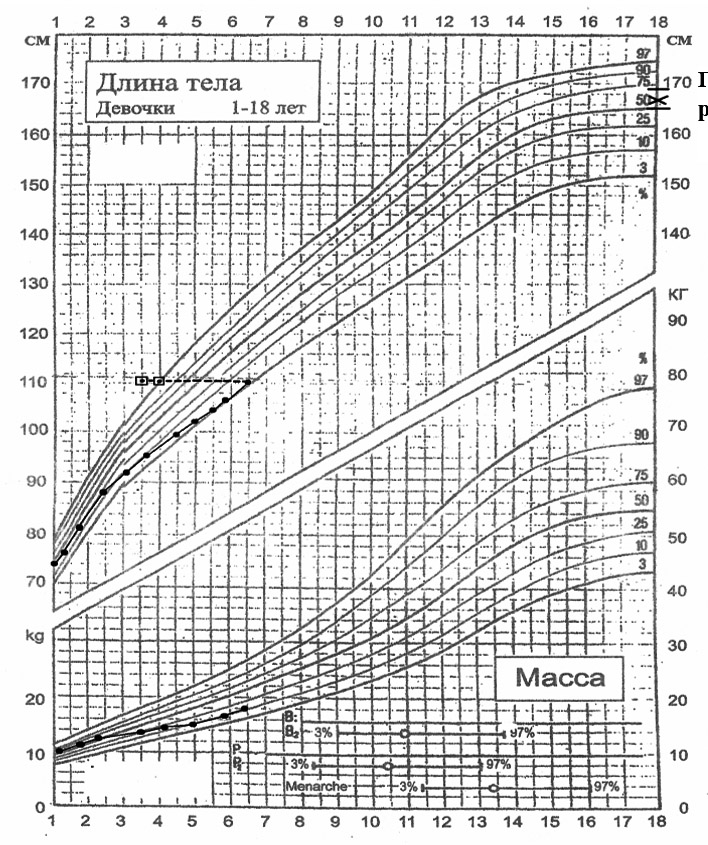 В БАК отмечено снижение концентрации сывороточного железа до 5,1 мкмоль/л; уровни калия, натрия, кальция, ионизированного кальция соответствовали референтным нормам. При гормональном обследовании установлена нормальная функция ЩЖ с незначительным повышением уровня антител к ТПО 55,3 Ед/л (норма менее 50 Ед/л); концентрация С-пептида соответствовала нижним границам нормы.
В БАК отмечено снижение концентрации сывороточного железа до 5,1 мкмоль/л; уровни калия, натрия, кальция, ионизированного кальция соответствовали референтным нормам. При гормональном обследовании установлена нормальная функция ЩЖ с незначительным повышением уровня антител к ТПО 55,3 Ед/л (норма менее 50 Ед/л); концентрация С-пептида соответствовала нижним границам нормы.
Ребенок получал аналоги инсулина ультракороткого и длительного действия. На этом фоне отмечена высокая вариабельность гликемии в течение суток (от гипогликемии 1,9 до гипергликемии 20 ммоль/л). Показатели гликированного гемоглобина НbА1с (8,2–8,9 %) соответствовали субкомпенсации углеводного обмена. Суточная доза инсулина у пациентки не превышала 0,25–0,33 Ед/кг, что ниже обычных возрастных значений.
Справочно: согласно рекомендациям Международного общества диабета, после завершения периода ремиссии СД 1-го типа средняя доза суточного инсулина для детей раннего возраста составляет 0,4–0,8 Ед/кг.
При оценке физического развития за период наблюдения отмечено снижение темпов роста (см. рисунок). В общих анализах крови выявлены признаки легкой железодефицитной анемии (гемоглобин 106–118 г/л), несмотря на периодическую терапию препаратами железа.
Учитывая высокую вариабельность уровня глюкозы крови с частыми гипогликемическими состояниями, уменьшенную потребность в инсулине, низкие показатели физического развития, девочке проведено скрининговое исследование на целиакию.
Выявлено увеличение уровня антител к глиадину класса IgG — 69,3 ME/мл (норма до 8 ME/мл). Концентрации остальных антител (к глиадину класса IgА, тканевой трансглютаминазе класса IgG и класса IgА) находились в пределах нормы. Учитывая отсутствие повышения показателя наиболее специфичных для целиакии антител (класса IgА к тканевой трансглутаминазе), безглютеновая диета не назначалась. Было рекомендовано наблюдение в динамике с проведением повторного скринингового исследования.
При обследовании через 6 месяцев отмечено значительное повышение всех групп антител (к глиадину класса IgG — 134 ME/мл, класса IgА — 125,6 ME/мл, к тканевой трансглутаминазе класса IgG — 97,5 ME/л, класса IgА — 240,2 ME/мл).
При копрологическом исследовании выявлена кашицеобразная консистенция стула, наличие мыл (2+), мышечных волокон (1+) и крахмала (1+); жирные кислоты и нейтральный жир не обнаружены. Эти изменения (креаторея, амилорея, энтеральный тип стеатореи с преобладанием мыл или жирных кислот при отсутствии нейтрального жира) характерны для целиакии. От проведения биопсии слизистой кишечника мама девочки отказалась.
Ребенку выставлен клинический диагноз целиакии и назначена безглютеновая диета.
В течение 2-х последующих лет пациентка соблюдала безглютеновую диету. Несмотря на высокую приверженность лечению, использование флеш-мониторирования для контроля гликемии, целевые показатели углеводного обмена не были достигнуты: глюкоза крови в течение дня в пределах 4–15 ммоль/л, уровни НbА1с соответствовали декомпенсации заболевания (9,2–9,4 %). Отмечены низкие темпы физического развития. Девочка была госпитализирована в Республиканский эндокринологический центр для коррекции инсулинотерапии.
При лабораторном обследовании ОАК и БАК — без патологии.
По данным суточного мониторирования глюкозы: 6,2–12,8 ммоль/л. НbА1с — 8,3 %.
Гормонально: первичный гипотиреоз. Высокий титр антител к ТПО (766 Ед/л) свидетельствовал в пользу аутоиммунного поражения ЩЖ. ИФР-1 был ниже возрастной нормы — 47,43 нг/мл. При УЗИ ЩЖ отмечено увеличение объема по сравнению с возрастной нормой, изменения в паренхиме по типу тиреоидита. Рентгенограмма левой кисти: отставание костного возраста от паспортного, соответствует показателям 3 года 6 месяцев — 4 года.
При исследовании титров антител, ассоциированных с целиакией, отмечена положительная динамика показателей на фоне безглютеновой диеты.
Выставлен клинический диагноз: аутоиммунный полигландулярный синдром 3А типа; СД 1-го типа, стадия субкомпенсации; аутоиммунный тиреоидит, гипертрофический вариант, манифестный гипотиреоз; целиакия; задержка физического развития смешанного генеза.
Пациентке назначено заместительное лечение левотироксином в дозе 25 мкг (1,4 мкг/кг). Проведена коррекция схемы инсулинотерапии. Суммарная доза инсулина достигла 1,1 Ед/кг, что выше средних возрастных величин.
Справочно: согласно рекомендациям Международного общества диабета, доза инсулина у детей с СД 1-го типа допубертатного возраста составляет 0,7–1,0 Ед/кг. Высокая потребность в инсулине была обусловлена ростом инсулинорезистентности на фоне манифестного гипотиреоза и длительной декомпенсации углеводного обмена.
По данным мониторирования суточного профиля гликемии отмечена положительная динамика: снижение вариабельности и отсутствие гипогликемий. Девочка была выписана на амбулаторный этап в субкомпенсированном состоянии с рекомендациями продолжить прием левотироксина под контролем уровней ТТГ и Т4св, темпов физического развития, соблюдения безглютеновой диеты.
