Увеличение груди имплантами является одной из самых популярных пластических операций в мире. Однако маммопластика, как и любое хирургическое вмешательство, сопряжена с определенными рисками и негативными последствиями. Так, к поздним осложнениям операции относится парапротезная серома, при которой в редких случаях развивается особый вид лимфомы — ассоциированная с имплантом груди анапластическая крупноклеточная лимфома (АИГ-АКЛ). В статье рассматривается первый и пока единственный случай АИГ-АКЛ в Беларуси.
Актуальность вопроса
 Впервые неходжкинская лимфома, возникающая на имплантах груди оперированных женщин, была упомянута в классификации ВОЗ опухолей молочной железы 2012 года. На тот момент были опубликованы данные о небольшом числе случаев заболевания — порядка 50. Как отдельная единица АИГ-АКЛ появилась в 2017 году в классификации ВОЗ опухолей гемопоэтической и лимфоидной ткани, а в 2019-м — опухолей молочной железы.
Впервые неходжкинская лимфома, возникающая на имплантах груди оперированных женщин, была упомянута в классификации ВОЗ опухолей молочной железы 2012 года. На тот момент были опубликованы данные о небольшом числе случаев заболевания — порядка 50. Как отдельная единица АИГ-АКЛ появилась в 2017 году в классификации ВОЗ опухолей гемопоэтической и лимфоидной ткани, а в 2019-м — опухолей молочной железы.
Риск развития АИГ-АКЛ молочной железы в результате эстетических и реконструктивных операций возникает у женщин после установки имплантов в срок от 2 до 32 лет (в среднем через 7–10 лет) в возрасте от 27 до 90 лет (средний возраст 50 лет). Как правило, единственной жалобой пациенток является увеличение размеров груди.
При объективном осмотре кожа молочной железы в основном не изменена. С помощью инструментальных методов обследования (УЗИ, МРТ) определяется жидкость вокруг импланта (объем удаленной жидкости обычно небольшой, но может достигать 700 мл).
 Примерно у каждой 3-й женщины выявляется опухолевидное образование в груди, а у каждой 5-й — регионарная лимфаденопатия. Примерно в 5 % случаев АИГ-АКЛ диагностируется и на противоположной груди. Гораздо реже болезнь распространяется системно, может поражать костный мозг. Смертельный исход встречается в менее чем 5 % случаев, непосредственной причиной становится вовлечение средостения или бронхиальная обструкция.
Примерно у каждой 3-й женщины выявляется опухолевидное образование в груди, а у каждой 5-й — регионарная лимфаденопатия. Примерно в 5 % случаев АИГ-АКЛ диагностируется и на противоположной груди. Гораздо реже болезнь распространяется системно, может поражать костный мозг. Смертельный исход встречается в менее чем 5 % случаев, непосредственной причиной становится вовлечение средостения или бронхиальная обструкция.
Таким образом, АИГ-АКЛ следует включать в спектр дифференциальной диагностики при наличии следующих симптомов через год и более после установки грудных имплантов:
- скопление жидкости в кармане вокруг импланта, что часто ассоциировано с переохлаждением, повышением температуры тела, физической активностью (60–85 % случаев);
- увеличение груди в объеме;
- наличие пальпируемого образования (8–18 % случаев);
- кожная сыпь или изъязвление (2–3,5 случаев).
Следует помнить, что после установки имплантов поздние серомы диагностируются редко — в 0,8 % случаев. Поздним принято считать накопление выпота вокруг импланта более чем через 12 месяцев.
Интересно, что в отношении других изделий, имплантируемых в тело человека (водители ритма и дефибрилляторы, искусственные клапаны сердца, тестикулярные, пенильные и ягодичные импланты, протезы суставов и даже внутриглазной силикон), также опубликованы наблюдения в связи с развитием лимфомы.
Принципы выявления и лечения АИГ-АКЛ
Национальная комплексная сеть США по борьбе с раком (National Comprehensive Cancer Network, NCCN) в 2016 году разработала принципы диагностики и лечения АИГ-АКЛ,которые были дополнены в 2019-м. С целью верификации серомы следует выполнить УЗИ или МРТ обеих молочных желез. 5–10 мл жидкости вокруг импланта у бессимптомных женщин не требуют дальнейшего исследования.
В ином случае серома должна быть аспирирована, на исследование отдается вся полученная жидкость, а при больших объемах — не менее 50 мл тщательно перемешанного экссудата. Если пальпаторно или инструментально обнаружено опухолевое образование, требуется биопсия. Цитологическое исследование парапротезной жидкости следует дополнить иммунофенотипированием методом проточной цитометрии либо, что предпочтительнее, на клеточных блоках.
АИГ-АКЛ относится к Т-клеточным неходжкинским лимфомам и верифицируется только с использованием иммуноцитохимического исследования (ИЦХ). Обязательное условие — выраженная положительная реакция на мембране или реже в цитоплазме всех или абсолютного большинства атипичных лимфоидных клеток с антителом CD30 и отсутствие реакции с антителом ALK в тех же клетках.
Для подтверждения лимфомы недостаточно выяснить экспрессию только этих двух маркеров, проводится иммунофенотипирование с большой панелью антител, т. к. их экспрессия в АИГ-АКЛ непостоянна, и в первую очередь маркеров Т-клеточной линии (CD4, CD43, CD45RB, CD2, CD3, CD5, CD8, PAX5, ЕМА). Полезно определять рецепторы клональности Т-лимфоцитов TRB, TRG, TRD: поликлональность характерна для реактивных процессов, моноклональность — для злокачественных. Также уместно поставить маркеры цитотоксичности TIA-1, granzyme B и/или perforin.
Иммунофенотипирование биологической жидкости в нашей стране можно провести двумя способами. Первый из них — метод проточной цитометрии, где на небольшом объеме жидкости (даже 0,5–1,5 мл) ставят 20–30 антител, однако в арсенале нет одного из ключевых маркеров — ALK. Второй метод — изготовление в патоморфологической лаборатории парафиновых клеточных блоков из сконцентрированного осадка жидкости и проведение иммуноцитохимического исследования на срезах, аналогичных тканевым.
Большое исследование парапротезных выпотов провели итальянские патоморфологи под руководством Di Napoli. Они изучили 67 выпотов у 50 пациенток, в 6 из них у 5 женщин была диагностирована АИГ-АКЛ.
По микроскопическому составу выпоты были разделены на кровянистые и воспалительные. Воспалительные серомы в свою очередь были разделены на 4 подгруппы: острое воспаление (50 % и более нейтрофилов); смешанное воспаление (нейтрофилов 5–50 % клеточного состава); хроническое воспаление устанавливается, когда нейтрофилов менее 5 %, оно может быть двух видов — с преобладанием гистиоцитарных клеток и с преобладанием лимфоидных клеток.
Итальянские коллеги установили, что кровянистый или богатый гистиоцитарными элементами выпот может быть ассоциирован с травмой, приводящей к разрыву импланта и протеканию геля и/или кровотечению из микротрещин, а также может возникать при приеме оральных антикоагулянтов, пролонгированной воспалительной реакции, провоцирующей повреждение эндотелия и повышение проницаемости микрокапилляров. В этих случаях выпоты часто могут содержать гигантские клетки типа инородных тел.
С другой стороны, жидкости, богатые лимфоидными клетками, могут свидетельствовать о вирусной инфекции (явной или латентной) либо о персистирующей лимфоидной пролиферации вследствие нарушения иммунного ответа на инородное тело с возможным последующим развитием АИГ-АКЛ.
На основании анализа литературы, научного исследования Di Napoli с соавторами, а также собственного опыта предлагаем использовать в Беларуси следующий алгоритм цитологического исследования поздних парапротезных выпотов.
При отсутствии в цитограмме атипичных опухолевых клеток и наличии клеток воспалительного ряда с доминированием нейтрофильных лейкоцитов либо их заметным числом выдается заключение об остром или смешанном воспалении.
При остром воспалении обоснованы поиск флоры в цитологических мазках и микробиологическое исследование. При кровянистом выпоте и хроническом воспалении с преобладанием гистиоцитов/макрофагов рекомендуется исключить повреждение импланта и сосудов.
Если цитограмма характерна для хронического воспаления с преобладанием лимфоидных клеток вне зависимости от наличия или отсутствия атипичных форм, проводится иммунофенотипирование с определением маркера CD30.
Если доля CD30-положительных Т-клеток <1 %, это хроническое воспаление; 1–9 % — хроническое воспаление с активированными клетками, и здесь важна корреляция с морфологией и клиническими данными, есть риск начинающейся АИГ-АКЛ, поэтому требуются комплексные клинико-лабораторные исследования и динамическое наблюдение. Если CD30-положительных клеток 10 % и более, это уверенная лабораторная диагностика АИГ-АКЛ.
Вместе с тем подтверждение диагноза АИГ-АКЛ требует мультидисциплинарного подхода: наряду с цитологической верификацией лимфомы в парапротезной жидкости обязательно использование визуализирующего метода, оптимально ПЭТ/КТ.
Затем удаляются имплант с капсулой en bloc, выявленные вне капсулы образования в пределах здоровых тканей и выполняется биопсия подозрительных лимфоузлов. Если в удаленной капсуле и окружающих тканях гистологически не выявлены клетки лимфомы, лечение можно считать завершенным. В ином случае это распространенная стадия, показана системная химиотерапия.
Случай из практики
В Беларуси в 2019 году был зарегистрирован первый и пока единственный в стране случай АИГ-АКЛ.
Единых стандартов по диагностике и ведению таких пациенток в республике нет. Предлагаемая тактика лабораторной диагностики
АИГ-АКЛ основана на изучении порядка 100 источников мировой литературы, посвященных увеличению молочной железы имплантами, а также на основании собственного опыта.
АИГ-АКЛ диагностирована у 43-летней пациентки в правой молочной железе через 9,5 года после двусторонней установки имплантов. Женщина обратилась с единственной жалобой — на резкое увеличение в размере правой груди, произошедшее без видимых причин.
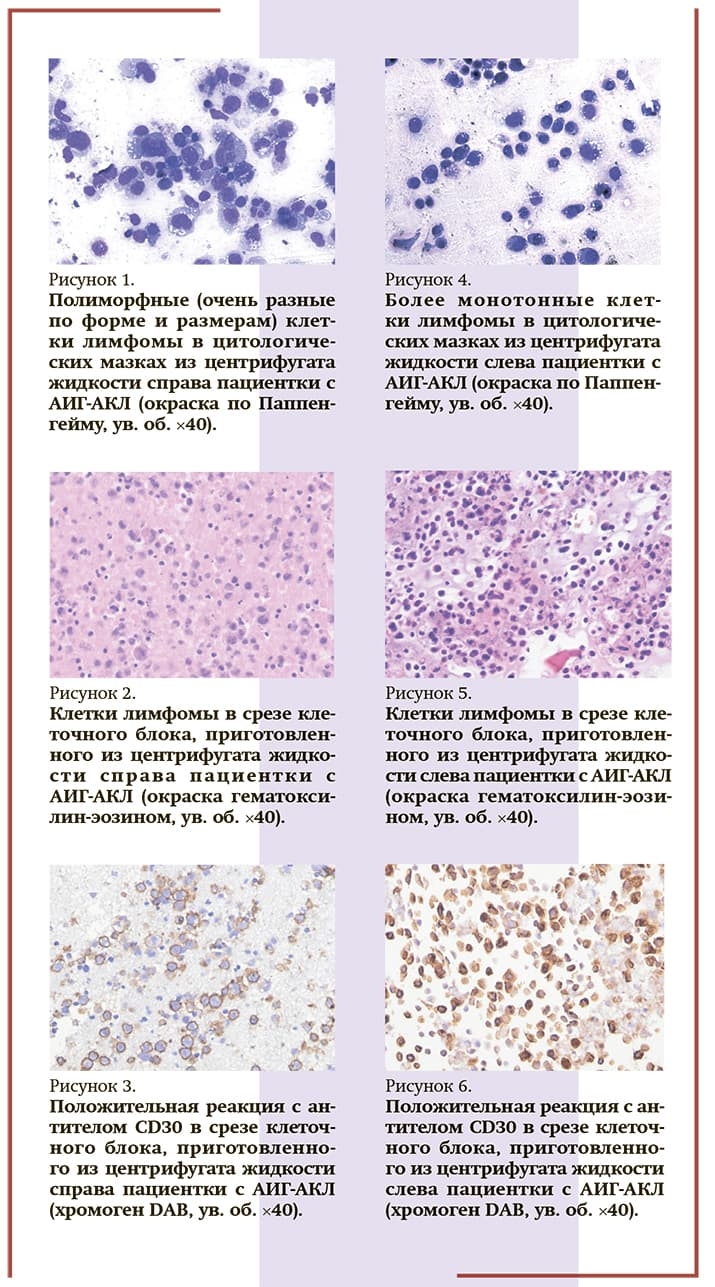
В процессе диагностики аспирация серомы была проведена 4 раза в течение трех месяцев, получены и доставлены в цитологическую лабораторию 300, 16, 200 и 250 мл полупрозрачного желтого выпота без запаха, т. е. он накапливался достаточно интенсивно. Цитоморфологически: классическая картина анапластической крупноклеточной лимфомы (см. рис. 1, 2), при ИЦХ CD30-позитивной в абсолютном большинстве клеток (см. рис. 3) и ALK-негативной. Иммунофенотипирование выполнялось на клеточных блоках и методом проточной цитометрии, иммунопрофиль сходный и представлен в таблице ниже.
Во время операции по двустороннему удалению имплантов с капсулой в левой молочной железе также выявили 20 мл жидкости (бессимптомное течение). Морфология клеток лимфомы несколько другая: из крупных, относительно мономорфных клеток, гигантские полиморфные клетки приходилось искать (см. рис. 4, 5).
Иммунофенотип также отличался от первичной опухоли справа: значения основных для верификации диагноза антител те же — CD30+ (см. рис. 6) и ALK–, но изменилась экспрессия нескольких антигенов: CD4, CD56, CD15, CD38 и HLA-DR — реакция была положительной, стала отрицательной; CD3 и CD30 выраженная экспрессия сменилась на слабую — dim (см. таблицу).
Таблица. Иммунопрофиль АИГ-АКЛ слева и справа у одной пациентки.
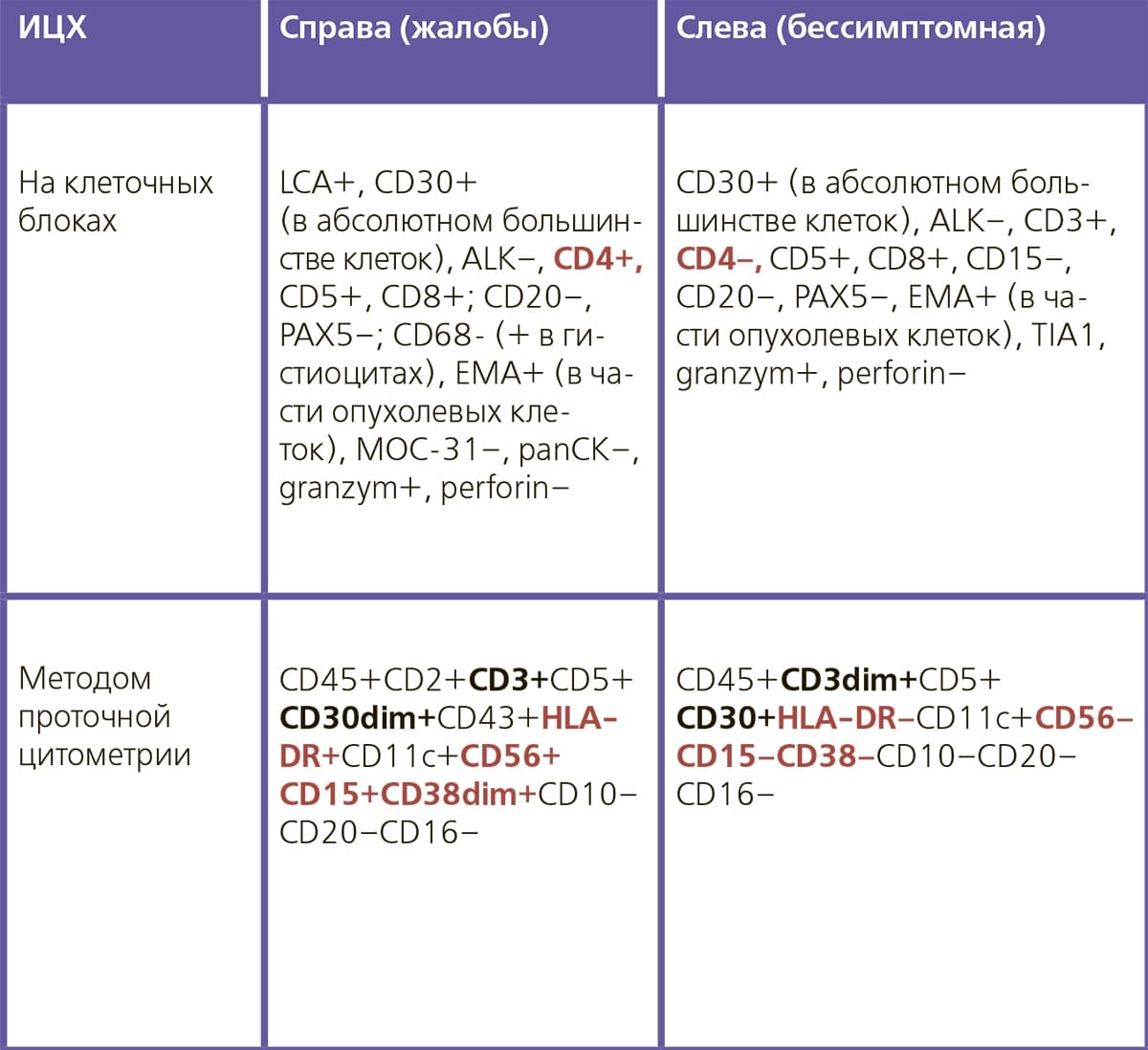
По результатам проточной цитометрии при объективном подсчете доля крупных атипичных лимфоцитов справа составила 70 %, из них CD30–позитивных клеток 62 %; а слева крупных клеток 90 %, но CD30+ всего 30 %.
При гистологическом исследовании капсул и окружающих тканей с двух сторон опухолевого роста не выявлено, доказана 1-я стадия заболевания. При ПЭТ/КТ через год после лечения рецидива нет.
В настоящее время рекомендуется все вновь выявленные случаи АИГ-АКЛ вносить в специальный регистр PROFILE, созданный Американской ассоциацией пластических хирургов и FDA, для ускорения процесса изучения рассматриваемого редкого осложнения маммопластики (www.thepsf.org/research/registries/profile).

